| J Korean Neurol Assoc > Volume 40(1); 2022 > Article |
|
Abstract
Anti-Hu antibody causes paraneoplastic syndrome of the nervous system. Most of the anti-Hu antibodies are found with small cell lung cancer, but can rarely be found with other cancers such as non-small cell lung cancer, prostate cancer, and breast cancer. We report a 57-year-old male patient with advanced gastric adenocarcinoma who had paresthesia and limb ataxia. Electrophysiologic study and imaging showed peripheral neuropathy accompanied with myelitis. Anti-Hu antibody was detected in the patient’s serum, leading to the diagnosis of paraneoplastic syndrome.
항Hu항체는 종양세포과 신경세포에서 발현되는 종양신경항원을 인식하여 공격하는 신생물딸림항체의 하나로, 종양뿐만 아니라 말초신경계와 중추신경계 또는 자율신경계를 공격하여 다양한 신경학적결손을 일으키는 신생물딸림신경계증후군을 유발할 수 있다. 항Hu항체는 대부분이 소세포폐암에서 발견되지만, 그 외에도 드물게 비소세포폐암, 전립선암, 유방암 등에서도 발견된다고 알려져 있다.
저자들은 특이하게도 진행위샘암종 환자에서, 항Hu항체로 인한 신생물딸림척수염이 발생한 흔치 않은 증례를 경험하여 문헌고찰과 함께 보고하고자 한다.
57세 남자가 항암치료 이후부터 점차 악화되는 양측 상하지 저림과 보행장애로 병원에 왔다. 2년 전 토혈 증상으로 시행한 복부 컴퓨터단층촬영(Fig. 1-A) 및 상부내시경검사에서 진행위암 의심 소견을 보였고, 해당병변 조직검사에서 샘암종(adenocarcinoma)이 발견되었다(Fig. 1-B). 주변 림프절과 간에 전이 병터가 확인되어(Fig. 1-C) 수술 없이 3주 간격으로 12주기 항암치료(capecitabine, trastuzumab, cisplatin)를 하였으며, 이후 손발저림이 발생하여 시스플라틴(cisplatin)을 제외하고 항암치료를 지속하였으나, 발바닥에서 무릎 아래까지, 손바닥에서 팔꿈치 아래까지 저림이 점차 악화되었다.
신경계 진찰에서 사지 근력과 통각, 촉각은 보존되어 있었으나, 양측 상하지에서 위치각과 진동각이 소실되어 있었고, 양측 하지에서 운동실조가 보였으며, 바뱅스키징후가 양성이었다.
사지의 운동신경전도검사에서 복합운동활동전위의 진폭과 전도 속도는 정상이었으며, 감각-복합신경전도검사에서 하지는 정상이었지만 상지의 감각신경활동전위의 진폭 저하 및 경도의 전도속도 저하를 보였고, 몸감각유발전위 검사에서는 양측 상하지 모두에서 중추전도지연을 보였다.
중추전도지연의 원인을 확인하기 목뼈와 등뼈 자기공명영상검사를 시행하였고, T2강조영상에서 2번 목뼈부터 12번 등뼈 위치까지 척수 뒤기둥에 고강도신호(Fig. 2)를 보였다. 뇌 자기공명영상검사는 시행하지 않았다.
웨스턴블롯을 이용한 혈청 신생물딸림항체검사에서 항Hu항체가 2+ 양성이었으며, 그 외에 호모시스테인은 17.39 μmol/L, 비타민 B12는 1676 pg/mL로 정상치보다 증가되어 있었다. 혈색소 수치는 9.9 g/dL였으며, 평균적 혈구용적 95.8 fL, 평균적혈구혈색소 34.5 pg으로 정상적 혈구정상색소빈혈(normocystic normochromic anemia)을 보였다.
항암치료를 지속하면서 저림에 대한 대증치료를 시행하였으나, 증상은 계속 악화되어 손으로 물건을 쥐어도 떨어뜨리게 되었고, 양측 하지의 심한 운동실조로 독립 보행이 불가능해졌다. 4개월 뒤 추적 신생물딸림항체검사에서도 항Hu항체가 2+ 양성을 보였기 때문에 스테로이드 충격 요법을 시행하였지만 신경계증상의 호전은 없었으며, 2주 후 진행위암병터에서 위천공이 발생하여 수술치료를 시행한 뒤 전신상태를 고려하여 항암치료를 중단한 상태로 안정 가료를 위해 요양병원에 입원하였다.
항Hu항체는 신생물딸림항체 중 하나로, 정상적으로는 신경세포에서만 발현되는 항원이 종양세포에서도 발현되는데, 면역교차반응에 의해 종양뿐만 아니라 신경계에도 손상을 일으켜 다양한 신경계증상을 유발한다. 항Hu항체는 신경세포핵 내에 있는 분자량 35-40 kDa 정도의 ribonucleic acid (RNA)결합단백질인 HuD, HuC와 Hel-N1을 인식하여 결합하며, RNA대사 및 필수단백질 합성장애를 일으키는 것으로 알려져 있다[1,2]. 항Hu항체에 의한 직접 신경손상의 기전은 아직 명확하게 규명되지는 않았지만, 항Hu항체가 발견된 신생물딸림증후군 환자의 부검에서 중추신경계 내에 염증세포가 확인되었으며, 특히 혈관주변(perivascular region)에서는 CD4+T림프구가 우세하였고, 세포사이공간(interstitial space)에는 CD8+T림프구가 주로 침윤되어 있는 사실들을 미루어 볼 때 T림프구에 의한 일종의 면역반응이 관여할 것으로 추정된다[3].
항Hu항체는 중추신경계와 말초신경계의 모든 신경세포에 영향을 줄 수 있지만, 말초신경병이 더 흔하게 나타나며 대개 감각신경병 또는 감각신경세포병의 형태로 나타난다. 중추신경계를 침범하게 되는 경우 소뇌운동실조, 변연계뇌염, 뇌줄기뇌염, 척수병 등이 발생할 수 있으며 그 외에도 자율신경병, 다발신경침범 등 다양한 신경계증상을 유발할 수 있다[2,4,5].
암이 진단된 항Hu항체 양성 환자의 74%[4]-93%[2]에서 소세포폐암이 발견되었으며, 그 외에 비소세포폐암, 전립선암, 유방암, 자궁내막암, 생식세포종에서 보고되어 있고[4], 드물게 방광이행세포암, 두경부암, 자궁경부암, 난소암 등에서도 발견된 증례가 있다. 하지만 위샘암종에서 항Hu항체가 발견된 증례는 희귀하기 때문에 본 증례가 매우 독특하다고 할 수 있다.
증례의 환자는 진행위암으로 항암치료를 받던 중 사지의 감각저하와 운동실조가 발생하였고, 신경생리검사에서는 상지의 감각신경병 및 양측 상하지에서 중추전도지연을 보였다. 감별해야 할 질환으로 항암제에 의한 말초신경병, 척수내전이암, 아급성연합변성을 고려할 수 있다.
척수 자기공명영상에서 뒤기둥이나 외측피질척수로의 긴 이상 신호는 아급성연합변성에서도 보일 수 있지만[6,7], 혈액검사에서 비타민 B12는 정상수치 이상이었고, 큰적혈구고혈색소빈혈은 보이지 않았으며, 혈청 신생물딸림항체검사에서 두 차례 모두 항Hu항체 강양성이었기 때문에 아급성연합변성보다는 신생물딸림 신경계증후군에 합당하다. 다만 혈청에서 비타민 B12가 증가되어 있는 것은 고형암이나 혈액질환에서 역설적으로 조직 이용률이 떨어져서 발생하는 기능적결핍상태일 수도 있음이 재고되어야 하겠다[8]. 2021년에 제안된 진단기준에 따르면 paraneoplastic neurologic syndrome-care score 9점으로 신생물딸림척수병 확정 진단에 해당한다[9].
생물딸림증후군의 치료는 일차적으로 종양 자체를 치료하는 것이 가장 중요하며, 더불어 면역요법을 시도해 볼 수 있다. 하지만 항Hu항체와 같은 새포핵 내 항원에 대한 항체의 치료는 어렵고 예후가 좋지 않은 것으로 알려져 있다. 본 증례의 경우에도 항암치료를 지속하면서 고용량 스테로이드 요법을 시행하였으나 증상의 호전은 없었고, 오히려 위산 분비 억제제와 위점막 보호제를 병용하였음에도 불구하고 병변 부위에 위천공이 발생하여 결국 수술치료가 불가피했다.
REFERENCES
1. Kim KK. Paraneoplastic syndrome. J Korean Neurol Assoc 2002;20:215-222.
2. Lucchinetti CF, Kimmel DW, Lennon VA. Paraneoplastic and oncologic profiles of patients seropositive for type 1 antineuronal nuclear autoantibodies. Neurology 1998;50:652-657.


3. McKeon A, Pittock SJ. Paraneoplastic encephalomyelopathies: pathology and mechanisms. Acta Neuropathol 2011;122:381-400.


4. Graus F, Keime-Guibert F, Reñe R, Benyahia B, Ribalta T, Ascaso C, et al. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain 2001;124:1138-1148.


5. Sillevis Smitt P, Grefkens J, de Leeuw B, van den Bent M, van Putten W, Hooijkaas H, et al. Survival and outcome in 73 anti-Hu positive patients with paraneoplastic encephalomyelitis/sensory neuronopathy. J Neurol 2002;249:745-753.


6. Flanagan EP, McKeon A, Lennon VA, Kearns J, Weinshenker BG, Krecke KN, et al. Paraneoplastic isolated myelopathy: clinical course and neuroimaging clues. Neurology 2011;76:2089-2095.


7. Shah S, Campo RV, Kumar N, McKeon A, Flanagan EP, Klein C, et al. Paraneoplastic myeloneuropathies. Neurology 2021;96:e632-e639.



8. Andrès E, Serraj K, Zhu J, Vermorken AJ. The pathophysiology of elevated vitamin B12 in clinical practice. QJM 2013;106:505-515.


9. Graus F, Vogrig A, Muñiz-Castrillo S, Antoine JG, Desestret V, Dubey D, et al. Updated diagnostic criteria for paraneoplastic neurologic syndromes. Neurol Neuroimmunol Neuroinflamm 2021;8:e1014.



10. Uneno Y, Yokoyama A, Nishikawa Y, Funakoshi T, Ozaki Y, Aoyama I, et al. Paraneoplastic limbic encephalitis in a human epidermal growth factor receptor-2-positive gastric cancer patient treated with trastuzumab-combined chemotherapy: a case report and literature review. Intern Med 2016;55:2605-2609.


Figure 1.
(A) Abdomen computed tomography. There is a large, irregular and ulcero-infiltrative wall thickening lesion at posterior wall of stomach antrum (arrowheads). (B) Endoscopic biopsy in stomach antrum (H&E staining, ×200). Atypical cells with hyperchromatic nucleus, high nuclear/cytoplasm ratio, and irregular cell shape are noted around gastric glands as can be seen a moderately differentiated adenocarcinoma. (C) Whole body positron emission tomography. Hypermetabolic lesions are noted at antrum of stomach, S2 and S4 segment of liver, and retropancreatic lymph nodes (arrowheads).
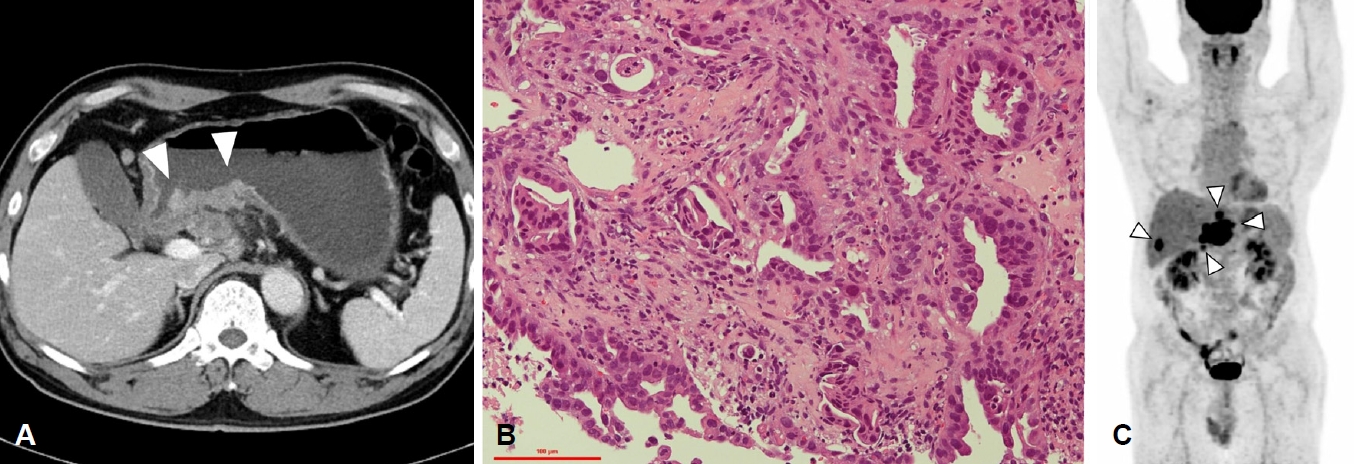
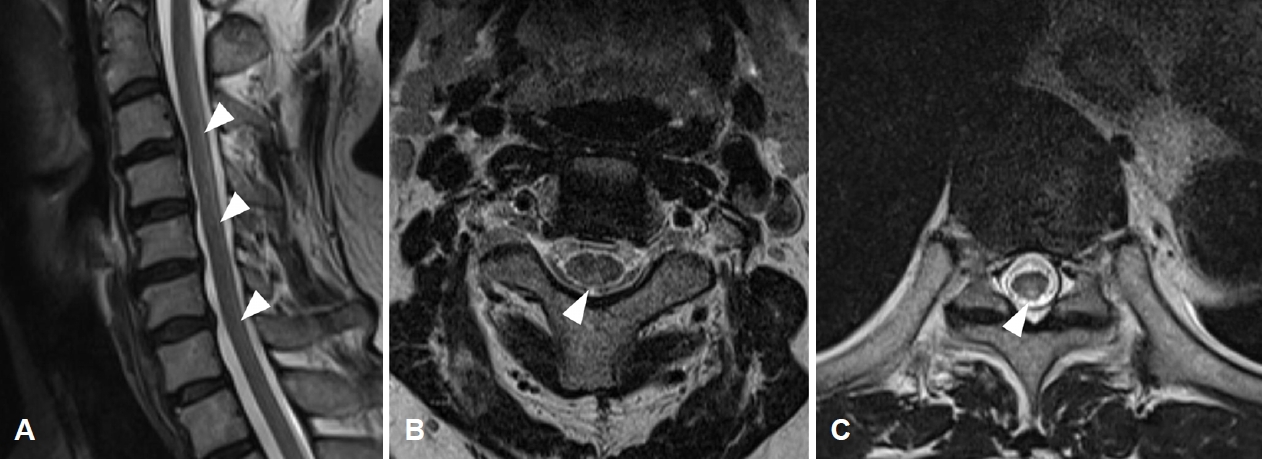
Figure 2.
Magnetic resonance images of spinal cord. (A) T2 sagittal image of cervical spine shows longitudinally extended high signal in the spinal cord (arrowheads). (B) T2 axial image of cervical spine shows high signal limited to the dorsal columns (arrowhead). (C) T2 axial image of thoracic spine also shows high signal at dorsal columns (arrowhead).
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 720 View
- 32 Download
- Related articles
-
Inflammatory Polyneuropathy Associated with Myelodysplastic Syndrome2022 October;40(4)
Myelitis Presenting Anti-Yo Antibody in a Patient with Prostatic Adenocarcinoma2020 November;38(4)
Anti-LGI1 Antibody Limbic Encephalitis Associated with Hepatocellular Carcinoma2020 November;38(4)
Wernicke Encephalopathy Associated with Acute Wet Beriberi2017 November;35(4)
Takotsubo Cardiomyopathy Associated With Status Epilepticus2014 ;32(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



