| J Korean Neurol Assoc > Volume 38(4); 2020 > Article |
|
Abstract
Antineuronal antibody-associated paraneoplastic neurologic syndromes result from tumor-stimulated autoimmune attacks against components of the nervous system. Paraneoplastic myelopathy associated with Purkinje-cell cytoplasmic autoantibody type 1 (anti-Yo) is extremely rare disorder. It is almost exclusively reported in women with gynecological tumors. Even though few cases of anti-Yo-associated paraneoplastic neurologic syndrome related to other cancers are reported, it is a very uncommon condition, especially in males. The author report here the first case of anti-Yo myelopathy with prostatic adenocarcinoma.
신생물딸림척수병증(paraneoplastic myelopathy)은 신생물딸림증후군의 하나로 신경계증상이 종양이 발견되기 전에 종종 선행하기 때문에 드물지만 매우 중요한 척수질환이다. 대부분의 환자들이 아급성 혹은 만성적으로 서서히 진행하는 척수병증의 임상 양상을 보이며 드물게는 재발-완화(relapsing-remitting) 경과를 보이기도 한다[1]. 신생물딸림척수병증 환자들에게서 주로 발견되는 항신경핵 혹은 항신경세포질항체는 항amphiphysin항체 혹은 항collapsin response-mediator protein-5 (CRMP-5)항체이며 항Yo항체가 발견되는 경우는 흔하지 않다. 또한 가장 연관된 신생물들은 폐암과 유방암이다[1,2]. 항Yo항체는 주로 여성에게서 난소암이나 유방암과 연관되어 관찰되며 아급성으로 발현하여 급속히 진행하는 소뇌실조와 연관되어 나타나는 경우가 대부분이다[3,4]. 항Yo항체 관련 소뇌실조가 남성에서 다른 종양들과 함께 보고되기도 하지만 매우 드물다[5-7].
저자는 서서히 진행된 척수병증을 보인 남성 환자에게서 항Yo항체와 전립샘선암종이 확인된 1예를 경험하였고, 국내외에 보고된 바가 없기에 보고하는 바이다.
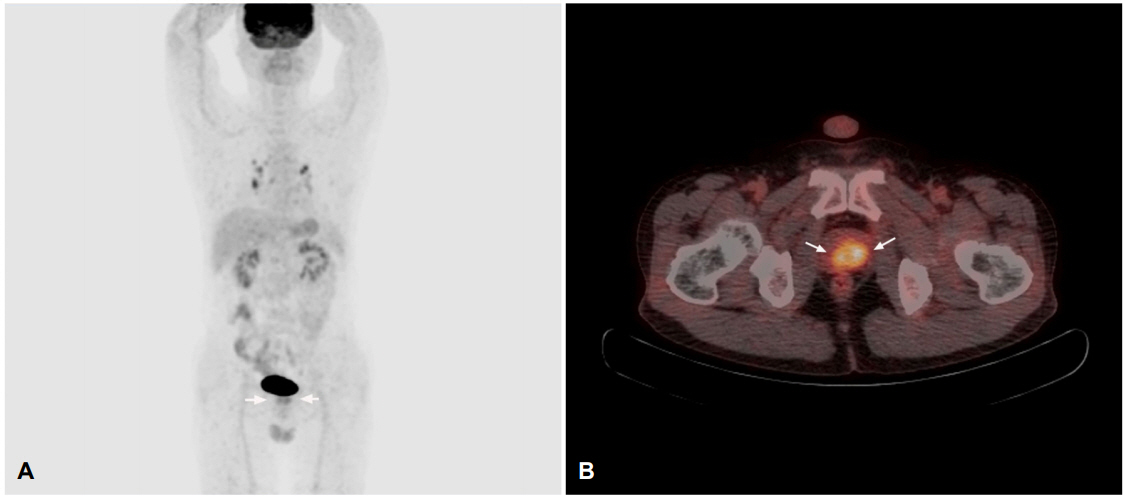
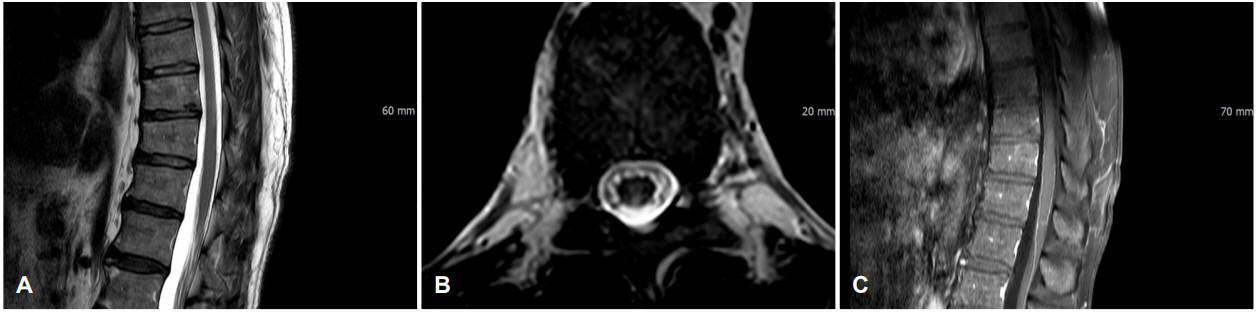
56세 남자가 약 3개월 전부터 발생하여 서서히 진행된 양하지 위약 및 감각저하를 주소로 입원하였다. 처음에는 엉덩이 주변으로 저리다가 양측 하지 전체로 저린감이 퍼졌고 오른쪽 하지의 저린감이 더 심하다고 하였다. 한 달 전부터는 보행이 불편해졌고 가속 페달을 적절한 힘으로 밟을 수가 없어 운전이 힘들어졌다고 하였다. 배뇨장애를 호소하였으나 뇨실금, 변실금, 발기부전은 없었다. 하루 한 갑씩 30년간 흡연하였으며 일주일에 3회 정도 소주 반 병씩 마신 음주력이 있었다. 과거력이나 가족력상 특이 사항은 없었고 최근 외상을 당하거나 백신을 맞지는 않았다. 입원 당시 열은 없었고 다른 활력징후도 정상이었다. 신경계진찰에서 의식은 명료하였고 뇌신경검사는 정상이었다. 근력검사에서 양 상지는 정상이었고 양 하지의 근력은 원위부에서 Medical Research Council 4등급 정도로 감소되어 있었다. 통각과 진동감각이 양측 L2피부절 이하에서 절반 이하로 감소되어 있었다. 심부건반사는 슬반사와 족반사가 양측에서 증가되고 바뱅스키징후가 양측에서 관찰되었다. 소뇌기능검사는 모두 정상이었다. 혈액검사, 소변검사, 혈액응고검사, 혈중지질검사는 모두 정상이었고 흉부엑스선촬영과 심전도도 모두 정상 소견이었다. 적혈구침강속도나 C반응단백도 모두 정상범위였다. 항중성구세포질항체, 류마티스인자, C/S단백질, 항인지질항체, 루푸스항응고인자, 항이중가닥 DNA항체, 항핵항체검사도 모두 정상이었다. 혈중 비타민B1, B6, B12는 모두 정상 수준이었고 망간, 구리와 아연도 정상범위였으며, 단순포진바이러스, 거대세포바이러스, 수두대상포진바이러스, 엡스타인-바바이러스, 사람면역결핍바이러스에 대한 항체검사, 매독검사 모두 음성이었다. 갑상샘기능검사는 정상이었고 혈중 전립샘특이 항원(prostate specific antigen, PSA) 수치만 6.05 ng/mL (정상, 0.75-5.36)로 약간 증가되어 있었다. 뇌 컴퓨터촬영검사는 정상이었다. 뇌척수액검사상 압력은 12 cmH2O, 백혈구 2/mm3 (단핵구), 단백 26.7 mg/dL, 당 62 mg/dL였고 올리고클론띠(oligoclonal band)는 음성이었다. 흉요추 자기공명영상검사(magnetic resonance imaging, MRI)에서 T2강조영상에서 T10-T11부위에서 주로 척수의 중심부에 위치하는 고신호강도병변이 관찰되었으며 이는 T1강조영상에서 약간의 가돌리눔조영증강을 보였다(Fig. 1). 그리고 신생물딸림척수병증을 감별하기 위하여 검사한 면역블로트검사에서 혈청 및 뇌척수액에서 항Yo항체가 확인되었다. 그 외 시행한 항Hu, Ri, Amphiphysin, CV2 (CRMP5), PNMA2 (Ma2/Ta), Recoverin, SOX1, Titin항체 등의 신생물딸림항체는 모두 음성이었다. 다른 혈액종양표지검사와 항aquaporin항체검사는 모두 음성이었다. 동반된 종양을 찾기 위해 시행한 전신양성자방출단층촬영/컴퓨터단층촬영(whole body positron emission tomography/computed tomography)검사에서 양측 전립샘엽에 경계가 뚜렷한 대사과다 병변이 관찰되었다(Fig. 2). 전립샘조직검사에서 전립샘선암종(Gleason 점수 3+4)이 진단되었다. 전립샘선암종에 동반된 신생물딸림척수병으로 진단 후 스테로이드 충격요법을 시행하였다. 메틸프레드니솔론(1 g/day)을 5일간 정맥주사로 투여한 후 경구용 프레드니솔론(60 mg/day)으로 바꾸어 투여하였고 이후 3개월에 걸쳐 서서히 감량하였다. 환자의 증상도 서서히 호전되어 위약감은 없어졌으나 양 하지의 저린감은 내원 시의 절반 정도로 남아있었다. 3개월 후 다시 검사한 흉요추 MRI검사에서 이전에 보였던 T10-T11부위의 병변은 거의 사라져 있었고 조영증강도 되지 않았다(Fig. 3). 환자는 근치전립선절제술을 받았고 3년간 추적 관찰하였는데 암의 재발이나 척수병증의 재발은 없었고 양 하지의 중등도의 저린감과 뻣뻣함, 약한 배뇨장애가 남아 대증 치료하며 경과 관찰 중이다.
신생물딸림척수병증은 단독으로 척수를 침범하여 나타나기도 하지만 주로 다른 신경계부위를 함께 침범하여 시신경염, 뇌병증, 운동장애, 소뇌증상 및 말초신경병과 동반되는 경우가 많다. 약 60%의 환자들이 여성이며 발병 연령은 중간값이 62세(37-79세 범위) 정도이다. 서서히 진행하는 척수병증을 보이는 경우가 일반적으로 일차진행형다발성경화증으로 오진되는 경우도 있다. 약 2/3의 환자들은 종양이 발견되기 전에 척수병증으로 나타나며 척수병증을 보인 후 종양발견까지의 기간은 중간값이 12개월(2-44개월 범위)이었다[1,2]. 뇌척수액검사에서는 보통 중등도의 림프구성 백혈구증가증(0-100 백혈구세포/µL)과 약간 혹은 중등도의 단백 증가 소견을 보이며 뇌척수액 oligoclonal band는 약 30%에서 나타난다[2].
신생물딸림항체와 연관되어 나타나는 경우에는 주로 항amphiphysin항체와 항CRMP-5항체가 가장 흔하며, 그 외에 항Ri, 항ANNA-3, 항Hu, 항Purkinje-cell cytoplasmic antibody type 2 순의 빈도로 나타나고 항Yo항체를 가진 환자의 5%에서 척수병증을 보인다[1,4]. 한 연구에서는 항Yo항체를 가진 환자들은 모두 여성이었는데 그중 89%에서 소뇌실조를 보였고 23%에서 다른 신경계증상이 함께 나타났으며 소뇌 이외의 신경계증상만을 보인 환자는 11%였으며 비교한 다른 항 Yo항체 환자집단에서 남자 환자의 비율은 2%였다[4]. 따라서 본 증례에서와 같이 남성이면서 항Yo항체를 보이는 신생물딸림증후군 환자는 매우 드물며 그중에서도 척수병증만으로 나타난 환자는 없었다.
신생물딸림척수병증과 동반된 종양은 유방암, 소세포폐암이 흔하며 그 외에 흉선종, 신장암, 대장암, 위장관암, 비호지킨 림프종, 난소암, 난관암, 고환암 등이 잘 동반된다[2]. 항Yo항체를 가진 환자들에게 종양은 난소암, 유방암, 난관암 등이 흔하고 드물게 복강암, 전이성암, 위장관암, 전립샘암, 폐암이 발견된다[4-9].
신생물딸림척수병증의 MRI검사상 특징은 세로로 광범위하고(longitudinally extensive), 대칭적이며, 신경로-특이적(tract-specific)이거나 회색질-특이적(gray matter-specific)인 신호강도의 변화가 척수 내에 나타나며 종종 가돌리눔에 의해 조영된다는 것이다[1,2]. 이런 특징은 환자들의 1/3에서 절반 정도까지 나타나며 주로 척수 가쪽기둥을 침범하나, 등쪽기둥이나 중앙부 회색질이 침범되기도 하는데 심지어 환자들의 절반에서는 자기공명영상에서 정상이다[2]. 본 증례에서는 전형적인 양상보다는 짧은 길이에 중심부와 등쪽기둥을 주로 침범하는 소견이 관찰되었다. 감별해야 할 질환으로는 비타민B12와 구리결핍, 허혈척수병증, 척수내전이암, 경막동정맥루, 신경사르코이드증 등이 있으나 본 증례에서는 비타민 B12와 구리의 혈중농도가 정상이었고 증상이 서서히 발생하여 만성적으로 진행되어 급성인 허혈척수병증과도 맞지 않으며 MRI 소견상 전이암이나 동정맥루의 소견은 없었고 사르코이드증의 특징인 연질막의 조영증강도 없어 모두 배제할 수 있었다.
항Yo항체와 관련된 신생물딸림뇌척수병증의 병태생리는 주로 CD8+세포독성T림프구에 의해 매개된다고 알려져 있다. 항원 단백질은 52 kDa의 CDR2로서 암세포와 신경세포에서 발현되며, 이러한 세포내항원으로부터 MHC class-1에 의해 세포 표면에 발현된 펩티드에 특화된 CD8+세포독성림프구가 종양에서 배액되는 림프절로부터 전신순환으로 들어가 중추신경계로 이동하여 신경손상에 기여한다고 알려져 있다[1,3].
신생물딸림척수병증의 치료는 일차적으로 숨어있는 종양의 발견과 치료이고 더불어 면역요법을 시행해 볼 수 있다. 면역 치료에 대해서는 현재까지 이루어진 무작위 대조시험이 없어 대부분 증례 연구나 전문가 의견에 의한 방법이 대부분이다. 신생물딸림척수병증의 병태생리에 따라서 B세포를 고갈시키는 치료보다는 T세포 감소에 초점을 맞춘 단독요법 혹은 병용요법(스테로이드, 마이코페놀레이트[mycophenolate], 아자싸이오프린[azathioprine], 사이클로포스퍼마이드[cyclophosphamide])이 추천된다[1]. 예후는 좋지 않아 대부분의 환자들이 휠체어에 의존하게 되는데, 한 연구에서는 50%의 환자들이 16개월까지 추적하였을 때 결국 휠체어의존 상태가 되었다[2]. 본 증례는 예후가 좋은 편에 속하였는데 비교적 나이가 젊은 환자이고 전립샘암을 3개월만에 빨리 발견하여 근치하였으며 MRI상 병변이 길이가 비교적 짧고 국소적인 점이 좋은 예후를 보인 것으로 추정된다.
본 증례의 제한점은 환자의 전립샘선암종의 조직검사에서 간접면역형광법으로 Yo항원의 발현을 확인하지 못한 점이다. 환자의 혈청과 뇌척수액에서 모두 항Yo항체가 양성으로 확인되었으므로 위양성일 가능성은 떨어지나 특발성척수염이 우연히 병발하였을 가능성을 완전히 배제할 수는 없었다. 하지만 척수염을 일으킬 수 있는 다른 원인들이 광범위한 검사들을 통하여 배제되었고 전립샘선암종의 근치절제술 후 3년간 추적하는 동안 전립샘암을 포함한 다른 종양들이 발생하지 않았으며 척수염도 재발하지 않은 점은 항Yo항체와 연관된 신생물딸림척수병증이 전립샘선암종 환자에게서 발생하였을 가능성이 매우 높다고 생각된다. 이러한 인과관계를 확립하기 위해서는 향후 더 많은 증례들에 대한 연구가 필요할 것이다.
결론적으로 본 증례는 전립샘선암종 환자에서 항Yo항체와 연관된 신생물딸림척수병증이 발생한 것으로 추정되는 최초의 보고이다. 남성 환자에게서 항Yo항체와 연관된 신생물딸림증후군은 매우 드문데 원인암으로 극히 드문 전립샘암이 발견된 것이 특히 주목할 점이다. 원인암의 빠른 발견과 치료가 예후에 큰 영향을 줄 수 있으므로 남성 환자에게서 항Yo항체가 발견되는 경우 반드시 PSA와 전립샘에 대한 검사가 필요하다.
REFERENCES
2. Flanagan EP, McKeon A, Lennon VA, Kearns J, Weinshenker BG, Krecke KN, et al. Paraneoplastic isolated myelopathy: clinical course and neuroimaging clues. Neurology 2011;76:2089-2095.


3. McKeon A, Pittock SJ. Paraneoplastic encephalomyelopathies: pathology and mechanisms. Acta Neuropathol 2011;122:381-400.


4. McKeon A, Tracy JA, Pittock SJ, Parisi JE, Klein CJ, Lennon VA. Purkinje cell cytoplasmic autoantibody type 1 accompaniments: the cerebellum and beyond. Arch Neurol 2011;68:1282-1289.


5. Linnoila J, Guo Y, Gadoth A, Raghunathan A, Parks B, McKeon A, et al. Purkinje cell cytoplasmic antibody type I (anti-Yo): predictive of gastrointestinal adenocarcinomas in men. J Neurol Neurosurg Psychiatry 2018;89:1116-1117.


6. Rosine N, Chrétien P, Adam C, Beaudonnet G, Not A, Drai J, et al. Expression of Yo antigen in a prostatic adenocarcinoma. Can J Neurol Sci 2017;44:221-223.


7. Matschke J, Kromminga A, Erbersdobler A, Lamszus K, Anders S, Köfüncü E. Paraneoplastic cerebellar degeneration and anti-Yo antibodies in a man with prostatic adenocarcinoma. J Neurol Neurosurg Psychiatry 2007;78:775-777.


8. Han SH, Chi HS, Kim KK, Lee YC, Park SH, Shin DS, et al. A case of paraneoplastic limbic encephalitis presenting anti-purkinje cell antibody. J Korean Neurol Assoc 2005;23:724-726.
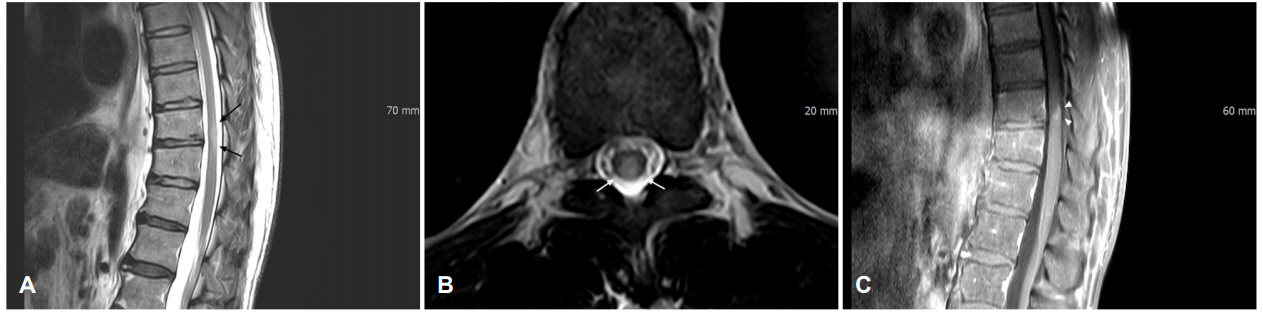
Figure 1.
(A) T2 sagittal and (B) axial images of thoraco-lumbar spine magnetic resonance imaging show short segmental ill-defined hyperintensity (arrows) in central area of spinal cord at the T10-T11 levels. (C) Sagittal image of gadolinium-enhanced T1-weighted spinal MRI reveals subtle enhancement (arrowheads).
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,721 View
- 45 Download
- Related articles
-
Anti-Hu Antibody-Mediated Myelopathy Associated with Gastric Adenocarcinoma2022 February;40(1)
Balo's Concentric Sclerosis in a Patient with Previous Recurrent Optic Neuritis2015 November;33(4)
Paraneoplastic Necrotizing Myopathy Associated With Ovarian Adenocarcinoma2014 ;32(1)
Incidental Right Sided Aortic Arch in a Patient With Right Pontine Infarction2013 ;31(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



