| J Korean Neurol Assoc > Volume 40(4); 2022 > Article |
|
Abstract
Inflammatory polyneuropathy may be associated with various tumorous diseases, including hematological malignancy. A 50-year-old man visited neurologic department complaining of bilateral lower extremities weakness, tingling sensation and weight loss. Initially he was diagnosed as demyelinating sensorimotor polyneuropathy after performing the nerve conduction study, furthermore myelodysplastic syndrome was revealed by the hematologic tests and bone marrow examination. Conclusively, high-dose steroid therapy, intravenous immunoglobulin and chemotherapy improved neurological symptoms. This case suggests myelodysplastic syndrome could be uncommon cause of the inflammatory polyneuropathy.
염증다발신경병(inflammatory polyneuropathy)은 다양한 면역 반응으로 인하여 나타날 수 있는 말초신경계질환으로 급성인 기얭-증후군(Guillain-Barré syndrome)부터 만성염증탈수초다발신경병(chronic inflammatory demyelinating polyneuropathy)까지 다양하고, 전신류마티스자가면역질환들이나 종양과 관련되어 발생하기도 한다[1]. 이외에도 비염증다발신경병의 원인으로 유전질환, 당뇨병, 특정 독소에 대한 노출, 영양부족, 외상, 약제유발 등이 잘 알려져 있어 이에 대한 정확한 감별이 요구된다. 혈액이상질환과 관련된 염증다발신경병의 원인으로 파라단백혈증과 관련되어 임상적으로 의미미결정단세포군감마글로불린병(monoclonal gammopathy of undetermined significance), 전신악성질환인 다발골수종(multiple myeloma), 발덴스트룀고분자글로불린혈증(Waldenström macroglobulinemia), 포엠스(polyneuropathy, organomegaly, endocrinopathy, M protein and skin changes)증후군, 아밀로이드증(amyloidosis) 등이 잘 알려져 있다. 이들과 유사한 혈액종양질환으로 골수형성이상증후군(myelodysplastic syndrome)이 있고 일반적으로 골수형성이상증후군은 혈모세포의 증식, 재발하는 유전이상, 골수형성이상, 부적절한 혈구형성, 세포감소증, 급성골수세포백혈병으로의 높은 발병 확률이 특징인 백혈병으로 알려져 있다[2]. 하지만 골수형성이상증후군과 관련된 다발신경병은 매우 드물뿐만 아니라 질환 초기에 진단이 쉽지 않다. 저자들은 아급성염증다발신경병으로 병원에 방문하여 골수형성이상증후군이 추가로 진단된 증례를 보고하고자 한다.
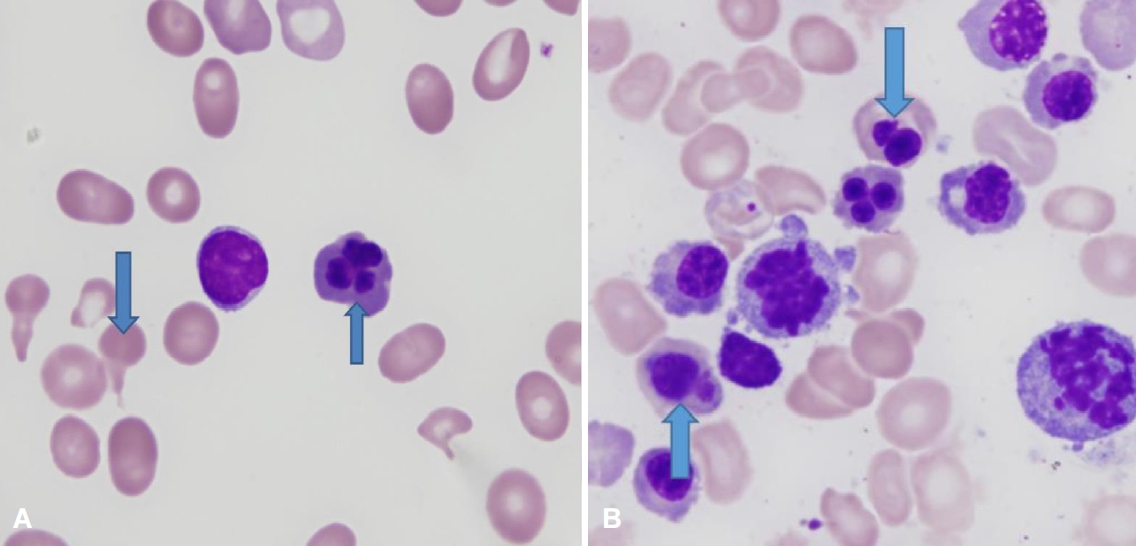
50세 남자가 수개월 전부터 서서히 악화되는 양측 상하지의 근력저하와 이상감각 및 보행장애로 외래에 왔다. 환자는 6개월 전 양쪽 발가락에 경미한 감각저하와 더불어 바늘로 찌르는 듯한 양상의 이상감각이 발생하였고, 이상감각은 시간이 지남에 따라 종아리, 무릎까지 진행하였다. 두 달 전부터는 몸무게가 급격하게 감소하기 시작해 총 15 kg의 체중이 감소하였으며 3주 전부터는 양측 상하지의 쇠약이 발생하였고 점차 악화되어 병원방문 당시 혼자 걷기가 불가능하였고, 양측 손의 근력저하로 젓가락질이나 병뚜껑 열기에 어려움이 있었다. 이러한 증상들은 지속적으로 점차 악화되었으며, 척추 magnetic resonance imaging는 정상이었다. 과거력에서 환자는 특이 병력이나 약물복용력 없이 건강하였으며 입원 후 공복혈당은 82 mg/dL, 당화혈색소 또한 5.6%로 정상이었다. 신경계진찰에서 의식은 명료하였고, 뇌 신경장애는 관찰되지 않았다. 근력검사에서 양측 하지에서 Medical Research Council(MRC) 3등급 정도의 근력저하를 보였고, 양측 사지 원위부에서 MRC 4등급 정도의 근력저하가 관찰되었다. 양측 상지 원위부와 양측 하지 전체적으로 온도감각, 진동감각 및 위치감각의 저하가 확인되었고 양측 하지에서는 통증 자극에 과민하였고 지속적인 저림과 찌르는 통증을 호소하였다. 양측 상하지의 깊은힘줄반사는 감소되어 있었고 바뱅스키징후는 나타나지 않았다. 롬베르크검사(Romberg test)와 일자보행검사(tandem gait test)는 수행이 불가능하였다. 신경전도검사와 침근전도검사에서 정중신경, 경골신경, 비골신경의 종말잠복기(terminal latency)가 지연되고, 운동신경전도속도는 저하되어 있었다. 표재비골신경 및 비복신경의 감각신경전도속도는 현저하게 저하되어 있었다. 이상의 검사 소견은 전기생리학적으로 다발탈수초운동감각신경다발신경병으로 해석할 수 있었다(Fig. 1) 임상적으로는 만성염증탈수초다발신경병의 가능성이 높았으나 환자가 뇌척수액검사는 거부하였고, 동반된 환자의 급격한 체중감소에 대해서 전신면역질환 및 잠복암에 대한 검사를 시행하였다. 암성질환을 감별하기 위해 말초혈액펴바른표본(peripheral blood smear), 골수조직검사, 종양표지자, 흉복부 컴퓨터단층촬영(enhanced chest, abdomen-pelvis)을 진행하였다. 혈액검사에서 항핵항체(antinuclear antibody)는 확인되지 않았으며, 백혈구 1,580/mm3, 혈색소 5.3 g/dL, 혈소판 47000/mm3로 확인되었으며 말초혈액펴바른표본검사에서는 큰적혈구(macrocytic red blood cell), 유핵적혈구(nucleated red blood cell)와 변형적혈구증가증(poikilocytosis)이 확인되었다. 골수검사에서는 핵싹(nuclear budding), 다염색적혈모구(polychromatic erythroblast), 정염색적혈모구(orthochromatic erythroblast)가 특징인 적혈구 형성과다와 형성이상이 확인되었다. 이를 통해 골수형성이상증후군으로 진단하였다(Fig. 2A, B). 이외의 종양표지자검사는 알파태아단백질(alpha-fetoprotein) 3.78 ng/mL, 암배아항원(carcinoembryonic antigen) 1.23 ng/mL, 암항원125(cancer antigen 125) 7.04 U/mL, 전립샘특이항원(prostate specific antigen) 0.15 ng/mL로 정상이었으며 흉복부 컴퓨터단층촬영 또한 정상으로 골수형성이상증후군 이외의 암성질환은 배제할 수 있었다.
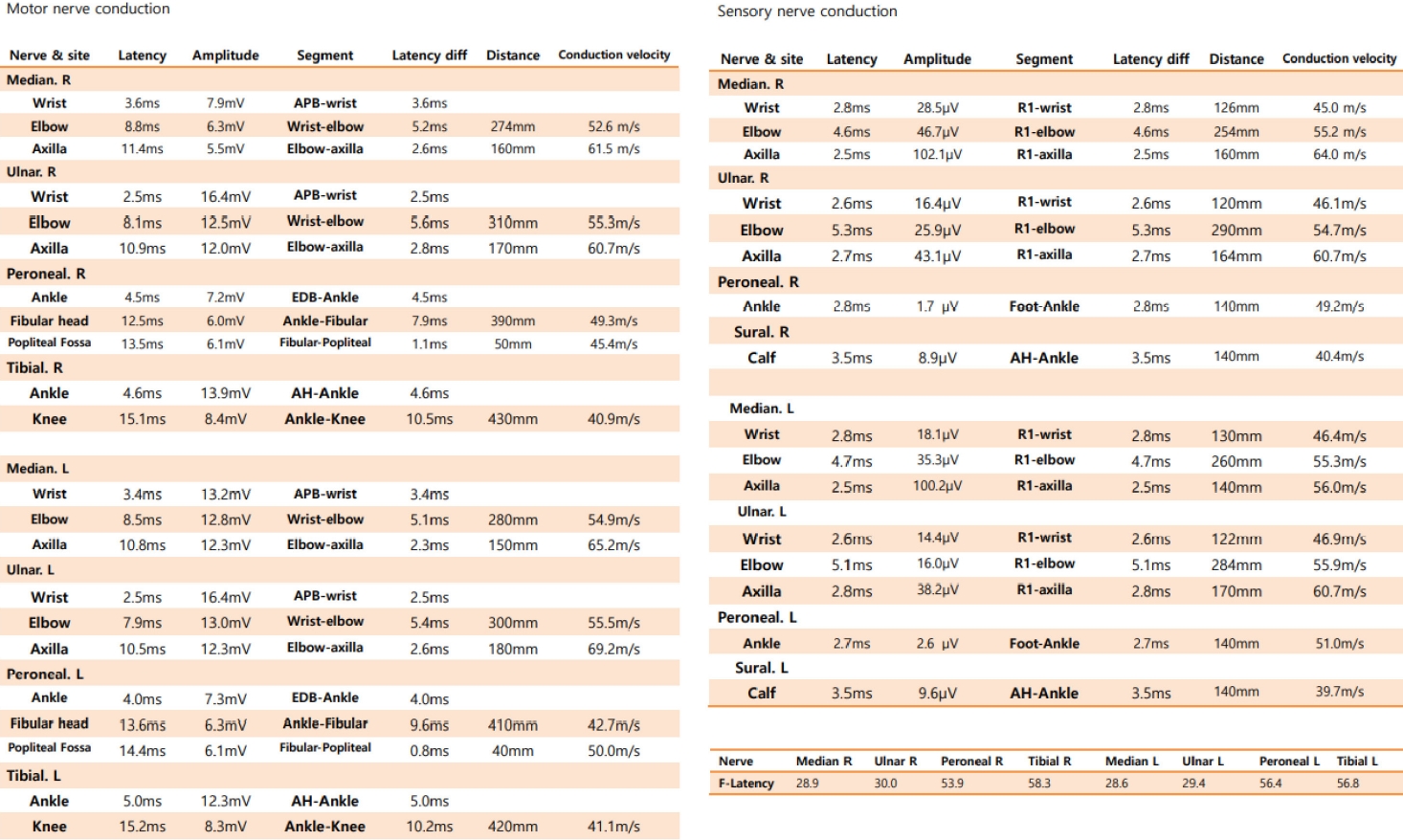
환자는 염증다발신경병의 치료를 위해 고용량의 경구 스테로이드 요법을 시행하였고 골수형성이상증후군에는 3개월간 데시타빈(decitabine)을 사용하여 네 차례 항암 치료를 진행하였다. 3개월간의 고용량 스테로이드 치료와 성공적인 항암 치료 후에도 보행장애 및 신경병통증이 지속되어 진단 후 6개월 시점에 한 차례의 면역글로불린주사 치료를 추가로 시행하였다. 환자의 쇠약과 감각장애는 점차 호전되어 외래 추적관찰 중으로 추가적으로 신경전도검사를 하였으며 면역글로불린주사 치료 후 9개월 뒤의 신경전도검사는 정상으로 뚜렷한 호전을 확인할 수 있었다(Fig. 3). 현재는 경구 스테로이드도 중단하였고 재발이나 악화없이 일상생활이 가능할 정도의 상태로 경과 관찰 중이다.
다발신경병은 전신의 많은 말초신경에 영향을 주는 비교적 균질한 과정을 가리키는 용어로, 전형적으로 대칭적인 감각저하, 타는듯한 감각 또는 운동의 약화가 특징이다. 말초신경병의 원인으로 당뇨병, 알코올남용, 독성물질, 기얭-바레증후군, 자가면역질환, 염증, 사람면역결핍바이러스 등의 감염, 샤르코-마리-투스질환(Charcot-Marie-Tooth disease) 등의 유전질환까지 다양한 원인이 알려져 있고, 원인에 따라 환자의 임상 양상 및 치료 방법이 매우 다양하여 정확한 원인을 밝히는 것이 예후와 치료를 결정하는데 중요하다[3].
일례로 만성염증탈수초다발신경병 환자에서 일부에서는 급성 악화 이후 안정기가 뒤따를 수 있으며, 일부에서는 안정기 없이 지속적인 악화를 보일 수 있다. 급성염증탈수초다발신경병 환자에서는 평균 4주 가량 점진적인 증상의 악화를 보인 다음 수개월에 걸쳐 증상의 안정과 호전이 뒤따른다.
골수형성이상증후군은 혈모세포의 비정상증식, 비효율적인 조혈, 말초혈구세포의 감소증 및 급성백혈병으로 분화할 가능성이 높은 것이 특징이다. 진단에는 전체혈구계산, 혈액펴바른표본, 골수검사를 사용한다. 평균 70세의 연령에서 호발하며 10만 명당 대략 4-5명의 유병률을 보인다. 치료법으로는 동종 줄기세포 이식이 가능한 환자에게는 줄기세포 이식을, 불가능한 환자에게는 아자시티딘(azacytidine), 데시타빈(decitabine), 사이타라빈(cytarabine), 도노루비신(daunorubicin) 등의 화학요법을 진행할 수 있다[4]. 개정 된 국제예후평가에 따르면(revised international prognostic scoring system) 높은 위험도에서는 기대여명 0.8년부터 낮은 위험도에서는 8.8년까지 다양한 예후를 보이며 잦은 감염, 피로로부터 혈관염, 신경염, 류마티스질환까지 흔하지 않은 다양한 임상 증상을 보일 수 있다[5,6]. 약 25%의 골수형성이상증후군 환자에서 자가면역 및 염증질환이 나타날 수 있다. 아직 이에 대한 발병 기전은 명확하지 않으나 세포면역 기전의 저하, 사이토카인 과분비, 유전이질성이 관여했을 것으로 생각되고 있다. 스테로이드와 면역억제제의 병용사용이 골수형성이상증후군과 관련된 자가면역 및 염증질환의 단기조절에 가장 효과적이긴 하나 많은 환자들은 증상의 재발이나 스테로이드 의존성으로 인해 추가적인 치료가 필요한 경우 또한 많다[7,8].
다발신경병의 진단에는 전기진단검사인 침근전도검사, 신경전도검사 및 혈청 포도당, 혈청 비타민B12 수준, 갑상샘기능검사, 혈청 단백질전기영동검사 같은 검사실검사뿐만 아니라 유전자검사, 신경생검, 자율신경검사들이 사용된다. 다발신경병의 치료는 원인 질환에 대한 치료와 발생한 증상을 완화시키는 치료로 크게 두 가지로 나뉘며 주로 고용량 스테로이드주사, 면역글로불린주사 치료 및 경구 스테로이드 복용을 사용해 볼 수 있다[9].
본 증례는 원인 미상의 팔다리 근력약화와 감각이상이 서서히 발생하였고, 신경전도검사를 통해 다발신경병으로 진단된 후에, 추가적인 검사를 통해 골수형성이상이 발견되어, 항암요법을 시행하면서 동시에 신경과에서 고용량 스테로이드와 면역글로불린주사 치료를 통해 정상적인 감각과 근력으로 회복되었던 환자이다. 환자의 두 달 이상 악화되었던 근력약화와 감각이상 및 진행한 전기 생리학적 소견은 만성염증탈수초다발신경병과 유사하여 감별이 어려우나 면역 치료와 항암 치료를 하며 악화없이 지속적인 호전을 보이며, 특히 현재 신경과약제를 모두 중단한 후에도 증상이 호전되는 점으로 골수형성이상증후군의 직접적인 말초신경계 침범보다는 세포면역기 전의 저하, 사이토카인 과분비 등의 이차적 면역학적 요인에 의한 아급성염증신경병으로 생각되는 환자였다. 다만 환자의 임상 경과가 악화되지 않는지에 대해 정기적인 외래 및 신경전도검사의 추적 관찰이 요구된다.
결론적으로 저자들은 다발신경병으로 병원에 방문하여 골수형성이상증후군이 새롭게 진단되었을 뿐만 아니라, 골수형성이상증후군 환자에서 동반된 염증말초신경병 환자를 면역글로불린과 스테로이드로 성공적으로 치료된 환자를 경험하여 보고하는 바이고, 환자의 임상 소견과 전기생리학적 검사에서 다발신경병이 진단된 환자에서 설명할 수 없는 체중감소, 빈혈 등의 혈액학적 문제가 동반되는 경우에는 골수형성이상증후군을 비롯한 혈액암이 동반되어 있을 가능성을 고려하는 것이 필요하다.
REFERENCES
1. Kieseier BC, Mathey EK, Sommer C, Hartung HP. Immune-mediated neuropathies. Nat Rev Dis Primers 2018;4:31.


2. Nakao S, Deeg HJ, Ishikawa T, Marsh J, List A, Tomonaga M. Myelodysplastic syndrome. Int J Hematol 2005;82:412-416.


3. Sommer C, Geber C, Young P, Forst R, Birklein F, Schoser B. Polyneuropathies. Dtsch Arztebl Int 2018;115:83-90.



5. Castro M, Conn DL, Su WP, Garton JP. Rheumatic manifestations in myelodysplastic syndromes. J Rheumatol 1991;18:721-727.

6. Lorand-Metze I, Niero-Melo L, Buzzini R, Bernardo WM. Part 2: myelodysplastic syndromes - classification systems. Hematol Transfus Cell Ther 2018;40:262-266.



7. Voulgarelis M, Giannouli S, Ritis K, Tzioufas AG. Myelodysplasia-as-sociated autoimmunity: clinical and pathophysiologic concepts. Eur J Clin Invest 2004;34:690-700.


Figure 1.
Nerve conduction study shows sensorimotor polyneuropathy involving bilateral upper and lower extremities. R; right, APB; abductor pollicis brevis, EDB; extensor digitorum brevis.
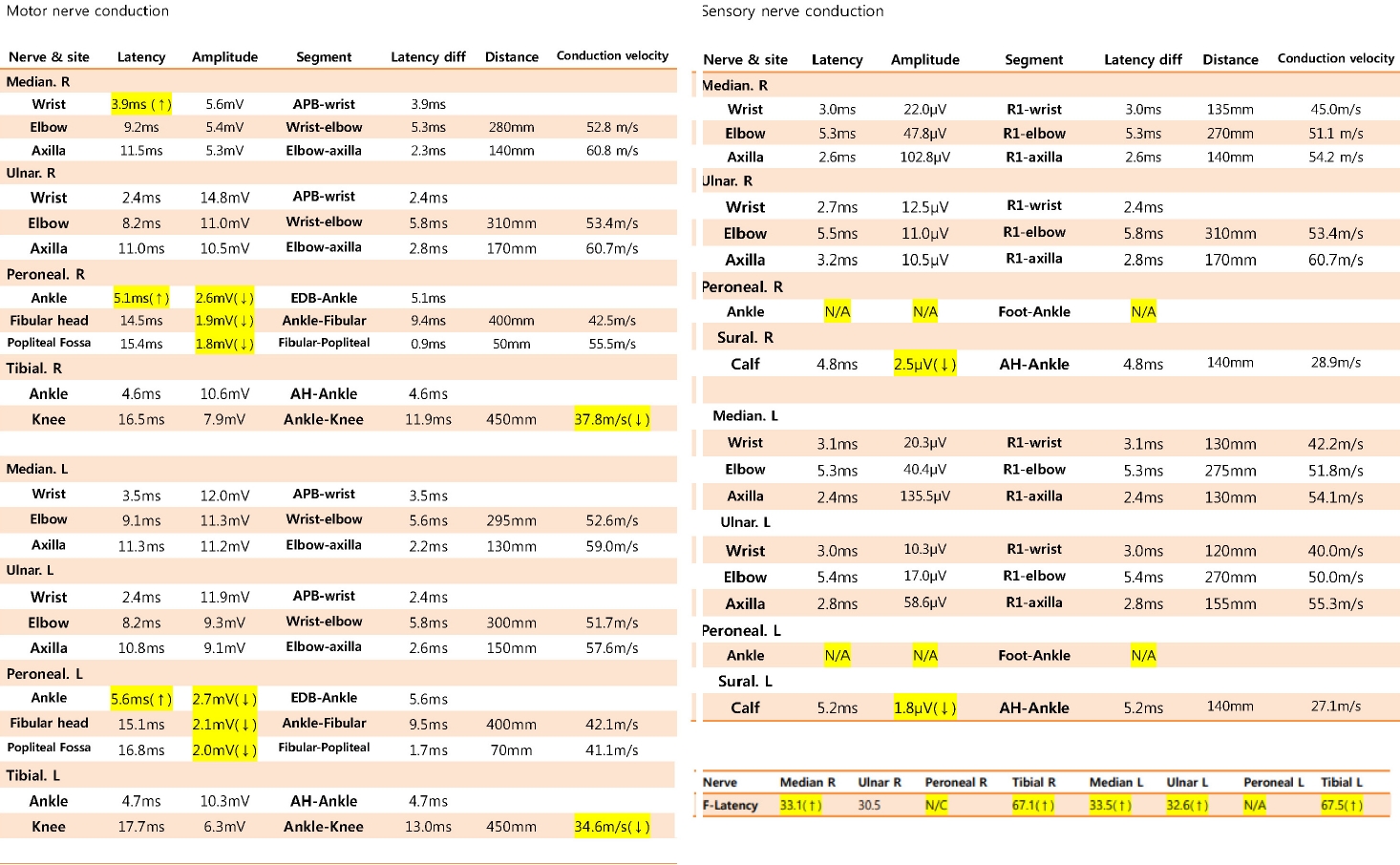
Figure 2.
(A) Peripheral blood (×1000) shows macrocytic red blood cell, poikilocytosis and nucleated red blood cell (arrows). (B) Bone arrows aspiration (×1000) shows erythroid hyperplasia and dysplastic features like nuclear budding, multinuclearity in polychromatic erythroblast (arrows) and orthochromatic erythroblast.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 488 View
- 22 Download
- Related articles
-
Worsening of Migraine Associated with Hyperprolactinemia2022 August;40(3)
Anti-Hu Antibody-Mediated Myelopathy Associated with Gastric Adenocarcinoma2022 February;40(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



