| J Korean Neurol Assoc > Volume 42(3); 2024 > Article |
|
Abstract
Hypervirulent Klebsiella pneumoniae (hvKp) infections are being increasingly reported globally, and cause severe central nervous system (CNS) and multiorgan infections even in immunocompetent individuals. The recent emergence of hvKp antibiotic resistance has generated escalating concern about effective infection control for this potentially neuroinvasive pathogen. Herein, we report two cases of Klebsiella pneumoniae-related CNS infection, including one patient with antimicrobial-resistant hvKp, confirmed by string test that demonstrated a hypermucoviscous phenotype.
폐렴막대균(Klebsiella pneumoniae)은 장내세균과(Enterobacteriaceae family)에 속하는 조건무산소(facultative anaerobe) 그람음성균으로 면역이 저하된 입원 환자에서 폐렴 및 요로 감염 등의 병원 내 감염(nosocomial infection)을 유발하는 것으로 잘 알려져 있다[1]. 그러나 1980년대경부터 기저질환이 없는 정상 면역인에서 중추신경계 감염을 비롯하여 간농양, 내인눈속염, 신농양 등의 다발 전이 감염을 유발하는 고병원성 폐렴막대균(hypervirulent Klebsiella pneumoniae, hvKp) 증례가 전 세계적으로 보고되고 있다[2-5]. hvKp가 고전 폐렴막대균(classical Klebsiella pneumoniae)과 비교되는 미생물학적 특징 중의 하나는 우무배지판(agar plate)에서 증식하였을 때 나타나는 고점액 점착 표현형(hypermucoviscous phenotype)으로 접종고리(inoculation loop)나 바늘 등으로 우무배지판 위의 폐렴막대균 집락을 늘려서 5 mm 이상의 점착성 실(viscous string)이 형성될 경우 실 검사(string test) 양성으로 판단한다[4,6]. 최근에는 동아시아 및 유럽 등지에서 항생제 내성을 획득한 고병원성 균주가 보고되고 있으며 연구에 따라 50% 이상의 현저히 높은 사망률을 보인다[2,6-8]. 저자들은 중추신경계를 침범한 폐렴막대균 감염에서 다발대뇌좁쌀(cerebral miliary) 양상을 보인 증례와 광범위베타락탐분해효소(extended-spectrum beta-lactamase, ESBL)에 의한 항생제 내성을 획득한 폐렴막대균 뇌실염 환자에서 실 검사를 통해 미생물학적으로 hvKp 여부를 확인하였던 증례를 경험하여 이를 보고하고자 한다.
특별한 기저질환 없이 평소 건강하게 지내오던 54세 남자가 1일 전부터 시작된 발열 및 갈색뇨, 우상복부 불편감으로 병원에 왔다. 응급실 방문 당시 복부컴퓨터단층촬영(computed tomography, CT)에서 간좌엽에 위치한 7×5×6 cm 크기의 간농양(Fig. 1-A)과 우측 신농양이 함께 발견되어 소화기내과로 입원하여 간농양의 경험적 치료로 메트로니다졸(1,500 mg/day), 메로페넴(1,500 mg/day), 시프로플록사신(800 mg/day) 및 반코마이신(2 g/day)을 투여받던 환자는 입원 다음날부터 점차 진행하는 의식 저하로 신경과에 의뢰되었다. 진료 시 체온은 38.7℃였고 혈압은 139/83 mmHg, 맥박과 호흡은 72회/분 및 20회/분이었다. 기면 상태로 눈을 감은 상태에서 통증 자극에 대해서만 눈을 뜰 수 있었으나 명령을 수행하지 못하였고 목경축이 확인되었다. 양안 결막이 붉게 충혈되었고 고름 분비물이 있었으며(Fig. 1-B) 뇌신경기능 및 운동과 감각기능 검사에서 국소 신경학적 결손은 관찰되지 않았다. 검사실 검사에서는 말초혈액 백혈구 13,970/mm3, C-반응단백질 34.58 mg/dL, 프로트롬빈시간-국제표준화비율 1.53으로 상승하였고 28,000/mm3의 혈소판 감소가 동반되었으며 혈뇨가 확인되었다. 뇌척수액 검사에서는 연한 황색으로 투명하였고 개방압력 210 mmH2O, 백혈구 310/mm3 (다형핵백혈구 85%), 적혈구 100/mm3, 포도당 3 mg/dL 및 아데노신 아미노기제거효소(adenosine deaminase, ADA) 51.2 IU/L였다. 뇌자기공명영상(magnetic resonance image, MRI) 검사에서 조영증강 T1강조 시 뇌 전체에 다발성으로 분포한 좁쌀조영증강 병터들을 관찰할 수 있었다(Fig. 1-C). 안초음파에서 확인된 양안의 내인눈속염에 대해서 양안 유리체강 내 항생제 주사 및 우안 유리체 절제를 하였으며 간농양에 대해서는 피부경유배액술을 시행하였다. 혈액 세균배양 검사에서 반복하여 폐렴막대균이 동정되었으며 뇌척수액 및 배액된 농양에서는 균이 분리되지 않았고 실 검사는 하지 않았다. 입원 4일째부터 감수성이 확인된 시프로플록사신 및 3세대 세팔로스포린인 세프타지딤(6 g/day)으로 변경한 후 4주간 유지하였다. 2주 후 시행한 뇌척수액 추적 검사에서는 백혈구 6/mm3 및 ADA 9.2 IU/L로 호전되었고 추적 뇌MRI에서도 기존의 파종뇌 병터의 크기 및 신호강도가 감소하였다. 복부CT 추적 검사에서는 기존에 보였던 간농양은 소실되었다. 약 2개월간의 입원 치료 이후 환자는 의식이 명료하고 사지 쇠약 없이 독립 보행이 가능하였으나 양측의 맨눈시력은 사물의 윤곽을 인지하는 정도로 저하된 상태로 퇴원하였으며 이후 재발 없이 외래에서 경과 관찰 중이다.
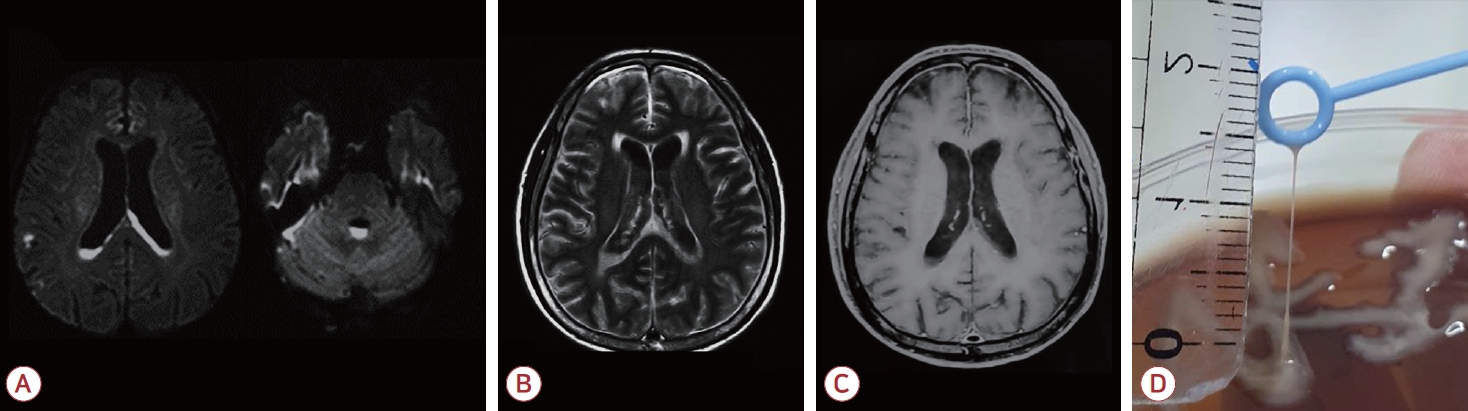
과거력에서 11년 전 알코올간경화증을 진단받은 63세 남자가 2일 전부터 발생한 두통, 고열 및 의식의 저하로 응급실에 방문하였다. 체온은 37.4℃였고 혈압 130/75 mmHg, 맥박 130회/분 및 호흡 26회/분이었다. 신경계진찰에서 의식이 혼미한 상태로 자발적으로 눈을 뜨고 있으나 명령을 수행할 수 없었으며 목경축 및 케르니크(Kernig)징후 양성의 수막자극 징후가 확인되었다. 각막반사, 인형눈반사를 포함한 뇌신경 검사 및 운동과 감각기능 검사에서 편측화 징후나 국소 신경학적 결손은 확인되지 않았으며 깊은힘줄반사는 정상이었다. 검사실 검사에서는 말초혈액백혈구 15,380/mm3, C-반응단백질 10.78 mg/dL, 아스파트산아미노기전달효소(aspartate transaminase) 207 IU/L 및 알라닌아미노기전달효소(alanine transaminase) 77 IU/L로 증가하였다. 뇌척수액 검사에서 개방압력은 270 mmH2O로 색상이 탁하였으며 백혈구는 54,400/mm3 (다형핵백혈구 90%), 적혈구 4,800/mm3, 단백질 1,745.7 mg/dL, ADA 72.7 IU/L로 상승하였고 포도당이 2 mg/dL로 뇌척수액에서 미생물이 동정되지 않았으나 세균수막염을 의심하여 세프트리악손(4 g /day), 반코마이신(2 g/day), 암피실린(8 g /day) 및 덱사메타손(20 mg/day) 투여를 시작하였다. 양쪽의 가쪽뇌실 및 제4뇌실에 MRI 확산강조영상의 신호 증가를 관찰할 수 있었으며(Fig. 2-A) 조영증강 T1강조영상 및 액체감쇠역전회복영상에서 전반적인 뇌수막 조영증강과 뇌실막의 이상신호를 확인할 수 있었다(Fig. 2-B, C). 이외에 간, 신장, 안구 등에서 전이 병터는 관찰되지 않았다. 혈액 배양에서 폐렴막대균이 확인되어 입원 3일째에 덱사메타손을 중단하고 감수성을 보인 세프트리악손 및 시프로플록사신(800 mg/day) 병합 정주로 변경하였으며 발열 등에서 임상 양상의 호전을 보였으나 입원 10일경부터 발열이 다시 악화되고 C-반응단백질도 상승하였다. 추적 배양 검사에서 ESBL-생성 폐렴막대균이 동정되었으며 10 mm 이상의 점착성 실이 형성되는 실 검사 양성 소견을 확인하여(Fig. 2-D) 감염내과와 상의 후 입원 12일째부터 세프트리악손을 중단하고 메로페넴(2 g/day)을 추가하였으나 환자의 신경계 상태는 호전되지 않았고 입원 28일째에 패혈증으로 사망하였다.
hvKp의 초기 보고에서는 암피실린에 대한 자연저항(natural resistance) 외에는 대부분의 현재 사용 중인 항생제들에 대해 획득저항(acquired resistance)이 없었으므로[1,2] hvKp 연관 중추신경계 감염 치료 시 혈액뇌장벽 투과력이 높은 3세대 세팔로스포린계 항생제가 일차적으로 선택되었다[3-6]. 그러나 2014년경 중국에서 ESBL-생성 및 카바페넴분해효소(carbapenemase)-생성 hvKp가 동정된 이후 동아시아 및 유럽 등을 중심으로 항생제 내성 hvKp의 보고가 점차 증가하고 있다[6-8]. 2016년 Zhang 등[7]은 중국 내 10개의 의료기관에서 수집된 총 230건의 폐렴막대균 감염 증례에서 11건(4.8%)의 ESBL-생성 hvKp를 확인하였으며 과거 스테로이드 치료력 및 중성구 감소(neutropenia) 등의 면역 저하 관련 임상적 특성들이 내성 유무와 유의한 관련성을 보였다. 스위스에서는 2023년 Hallal Ferreira Raro 등[8]이 279건의 다제 내성(multidrug-resistant) 폐렴막대균 균주 중 13건(4.6%)의 다제 내성 hvKp를 확인하였고 우리나라에서는 2019년 Hyun 등[9]이 414건의 폐렴막대균에 의한 요로 감염, 호흡기 및 복강 내 감염의 균주에서 15건(3.6%)의 ESBL-생성 hvKp를 확인한 바 있다. hvKp의 항생제 내성 기전은 대체로 4가지로 분류되는데 ESBL 또는 카바페넴분해효소 등에 의한 항생제의 불활성화, 유출펌프 과발현에 의한 배출, 항생제 표적 변이, 구멍단백질(porin) 조정에 의한 침투성 감소 등이 있으며 이러한 내성 관련 유전자들의 일부는 세균 간에 이동이 가능한 플라스미드(mobile plasmid)에 의해 운반될 수 있다[1,2]. ESBL생성 hvKp 감염의 치료를 위해서는 카바페넴 계열 제제를 고려할 수 있으나 카바페넴분해효소까지 생성하는 다제 내성 hvKp의 경우 항생제의 선택이 제한적이며 콜리스틴 또는 티게사이클린 등의 항생제가 대안으로 제시되고 있다[2,6,10].
본 증례의 첫 번째 정상 면역 환자의 경우 대뇌 좁쌀 양상의 뇌농양, 간농양, 내인눈속염 및 폐렴막대균 균혈증이 동반되어 임상적으로 hvKp에 의한 침습증후군으로 판단하였다. 이후 간농양에 대한 피부경유 배액 및 3세대 세팔로스포린 제제 투여를 통해 감염을 조절할 수 있었다. 그러나 만성 간질환의 과거력이 있었던 두 번째 환자에서는 우선 3세대 세팔로스포린 제제을 투여하면서 실 검사로 hvKp 여부를 확인하였고 추적 검사상 ESBL-생성이 확인됨에 따라 카바페넴 계열 항생제로 변경하였으나 임상 양상을 호전시키지 못하였다. 국내에서는 폐렴막대균에 의한 뇌수막염, 뇌농양, 뇌실염 등의 증례가 수차례 보고된 바 있으나 중추신경계를 원발성으로 침범한 항생제 내성 hvKp가 실 검사 등을 통해 미생물학적으로 진단된 바는 아직 없다[3-5,9]. hvKp의 항생제 내성은 최근 그 빈도가 증가하고 있으며 불량한 예후를 보이므로 빠른 검출 및 진단이 중요하며[1,6,10] 특히 면역 저하와 관련된 위험인자들을 동반한 환자의 폐렴막대균 중추신경계 감염 치료 시 항생제 내성의 가능성을 고려해야 한다.
REFERENCES
1. Choby JE, Howard-Anderson J, Weiss DS. Hypervirulent Klebsiella pneumoniae - clinical and molecular perspectives. J Intern Med 2020;287:283-300.


2. Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae. Clin Microbiol Rev 2019;32:e00001-e00019.



3. Kim GS, Lee JG, Choi SA, Lim SR. A case of Klebsiella pneuomoniae liver abscess complicated with brain abscess and endophthalmitis. J Korean Neurol Assoc 2005;23:578-580.
4. Hyun JI, Kim YJ, Jeon YH, Kim SI, Park YJ, Kang MW, et al. A case of ventriculitis associated with renal abscess caused by serotype K1 Klebsiella pneumoniae. Infect Chemother 2014;46:120-124.



5. Byun EY, Lee MJ, Kim JA, Park MK, Kim BN, Lee J, et al. Early MRI findings in a patient with Klebsiella pneumoniae cerebritis. J Korean Neurol Assoc 2010;28:129-131.
6. Lee CR, Lee JH, Park KS, Jeon JH, Kim YB, Cha CJ, et al. Antimicrobial resistance of hypervirulent Klebsiella pneumoniae: epidemiology, hypervirulence-associated determinants, and resistance mechanisms. Front Cell Infect Microbiol 2017;7:483.



7. Zhang Y, Zhao C, Wang Q, Wang X, Chen H, Li H, et al. High prevalence of hypervirulent Klebsiella pneumoniae infection in China: geographic distribution, clinical characteristics, and antimicrobial resistance. Antimicrob Agents Chemother 2016;60:6115-6120.



8. Hallal Ferreira Raro O, Nordmann P, Dominguez Pino M, Findlay J, Poirel L. Emergence of carbapenemase-producing hypervirulent Klebsiella pneumoniae in Switzerland. Antimicrob Agents Chemother 2023;67:e0142422.

Figure 1.
(A) Photograph of left eye of patient 1, showing eye lid swelling, chemosis and conjunctival injection. (B) Abdominal computed tomography shows a large multiloculated liver abscess in the left hepatic lobe. (C) Gadolinium-enhanced T1-weighted axial image of the patient 1 reveals innumerable disseminated focal lesions scattered over the cerebral hemispheres and cerebellum.
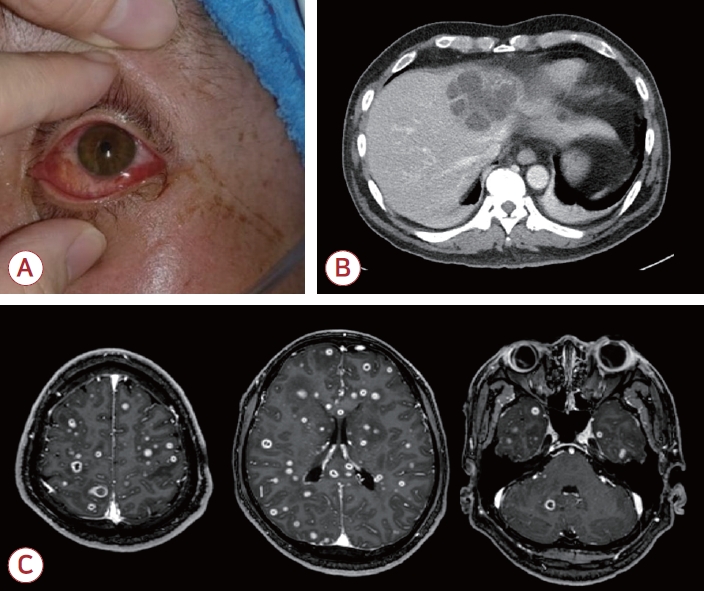
Figure 2.
(A) Axial diffusion weighted imaging of patient 2 shows hyperintense signals in both bilateral ventricles and forth ventricle. (B) T2-weighted contrast-enhanced axial brain image demonstrates elevated signals along both lateral ventricular walls with diffuse meningeal enhancement. (C) Post-contrast axal T1-weighted sequence shows meningeal enhancement with low signal intensities in both lateral ventricles. (D) Formation of a viscous string (>10 mm) from stretching of the Klebsiella pneumoniae colonies isolated from the culture sample of patient 2.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,289 View
- 31 Download
- Related articles
-
Ventriculitis Associated with Liver Abscess Caused by Klebsiella Pneumoniae2020 August;38(3)
Central Nervous System Infections: Practical Application of the Antimicrobial Agents2004 ;22(2)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



