| J Korean Neurol Assoc > Volume 38(4); 2020 > Article |
|
Abstract
Background
Post-cardiac arrest syndrome (PCAS) is one of the critical conditions which can result in a more serious brain injury. Early and accurate prognostication is crucial for deciding the patient’s therapeutic plan and setting the treatment goal. This study aimed to establish the prognostication values of quantitative electroencephalography (QEEG) in PCAS patients.
Methods
We recruited 183 PCAS patients treated with therapeutic hypothermia. Electroencephalography (EEG) data within 72 hours after cardiac arrest (CA) and clinical data were collected. QEEG analysis including power spectral density (PSD) and connectivity analysis of default mode network (DMN) with imaginary coherence were performed.
Results
There were significantly different patterns of PSD between neurologic good and poor outcome groups; absolute and relative power of the alpha 2 and beta 1 frequency (10-15 Hz) bands were increased in all brain regions of good outcome group. However, the relative power of the delta band and higher frequency bands over fast alpha (beta 3 and gamma bands over 20 Hz) were poor outcome markers. We found out that connectivity of DMN were significantly decreased in the poor outcome group compared with the good outcome group.
Conclusions
These findings suggest that QEEG analysis could quantify and automate the interpretation of EEG. Furthermore, they can improve the prognostic values for neurologic outcomes relatively accurately and objectively in PCAS patients treated with hypothermia compared with traditional visual grading.
심정지후증후군(post-cardiac arrest syndrome, PCAS)은 높은 사망률과 심각한 뇌손상을 초래하는 대표적인 질환이다. 조기 제세동 및 목격자 심폐소생술의 증가, 목표체온요법(targeted temperature management, TTM) 등의 치료와 조기 대처의 발전에도 불구하고 심정지 후 환자의 생존율은 미국에서 10.6%, 한국에서 10.1%로 보고되고 있고, 이 중 좋은 신경계 예후를 보이는 비율은 미국에서 8.3%, 한국에서도 6.1%에 불과하다[1]. 따라서 대부분의 심정지 후 생존 환자는 장기간의 집중치료실(intensive care unit, ICU)에 입원하게 되며 이로 인한 경제적 부담을 가지게 된다. 또한 뇌허혈과 재관류로 인한 뇌손상에 따른 심각한 신경계장애를 지닌 채로 살아가게 된다[2]. 반대로 심정지 후 환자에서 회복 가능성이 있는 환자를 나쁜 예후가 예측된다는 이유만으로 연명치료중단을 즉각적으로 결정하는 것 또한 윤리적 문제로 이어질 수 있다. 이러한 환자에서 좋은 신경계 예후만이 아니라 의식 회복을 예측할 수 있는 알고리즘을 개발하는 것은 매우 중요한 일이며 이를 빠르고 보다 정확하게 예측할 수 있다면 더욱 좋을 것이다. 그러나 심정지 후 자발순환회복(recovery of spontaneous circulation, ROSC)된 환자의 생존 여부와 향후 기능적 예후를 예측하는 것은 매우 복잡하며, 목표체온요법 적용과 이로 인한 집중 치료 중의 진정제 사용은 이를 더 어렵게 한다[3].
심정지 후 환자의 예후에 사용되는 평가법으로는 신경계진찰, 뇌파검사(electroencephalography, EEG), 뇌 컴퓨터단층촬영(computed tomography, CT), 뇌 자기공명영상(magnetic resonance imaging, MRI)과 같은 뇌 영상과 혈액검사가 있다[4]. 그러나 각 검사는 일정 이상의 위양성률(false positive rate)이 있으며, 최적의 민감도(sensitivity)를 보이는 순간이 다르고, 기관마다 가능한 검사의 차이가 있다. 특히, 심정지후증후군 환자의 임상적 뇌파분석에서 뇌전증모양방전(epileptiform discharge)이나 배경파억제(background suppression) 같은 악성 뇌파 패턴(malignant EEG pattern)을 확인하게 되는데 주로 육안 판독에 의존하게 된다[5]. 그러나 이 방법은 시간도 많이 걸리고, 판독능력을 배양하기 위해 장기적인 교육을 필요로 한다. 또한 뇌파의 육안 중증도 구분은 아직까지 다양한 뇌파의 양상을 해석하고 외부 자극에 대한 뇌파의 반응성의 소실 여부를 판단하는 보편적이고 객관적인 분류지침이 없다는 한계가 있다. 2010년 이후 전 세계적으로 심정지 후 환자의 치료에서 목표체온을 32-34℃로 조절하는 목표체온요법은 표준치료지침으로 널리 시행되고 있다[6]. 이러한 치료를 위한 마취제를 이용한 진정 및 기계적 인공호흡기, 전자기기, 근육 떨림으로 인한 잡음은 뇌파 해석에 많은 영향을 미쳐 그 유용성을 저하시킨다. 이에 따라 때때로 악성 뇌파 패턴의 높은 위양성비율로 인해 예후 결정 혹은 치료 결정에 어려움이 따른다. 실제 임상환경에서는 더 정확한 예후지표가 필요하다.
최근 엔트로피(entropy) 기반 분석, 돌발파억제(burst suppression) 측정, 정보지수(information quantity) 측정 및 이중분광지수(bispectral index, BIS)와 같은 결합 측정을 사용하여 신경계 예후를 예측하는 많은 정량적 뇌파연구가 동물 심정지 모델과 몇몇의 임상연구들에서 시행되었다. 그러나 매우 낮은 민감도로 인해 임상적으로 수용이 불가하며 타 기관에서 실현 불가하거나 검증되지 않아 정량적 뇌파에는 최적의 표준지표가 없다[7]. 따라서 목표체온 치료로 인해 발생되는 뇌파의 유용성의 저하를 극복하고 육안 판독의 한계점들을 극복하기 위해 보다 객관적이며 약물 진정 및 근이완제 등의 영향을 비교적 덜 받는 신경계 예후를 반영하는 지표를 발굴하여 그 실제적 유용성을 확인하는 것은 매우 중요하다.
내정상태회로(default mode network, DMN)는 뇌의 기저 상태를 특정짓는 뇌의 주된 네트워크로 제한받지 않는 자발적 인지 또는 자극과 무관한 생각들과 관련이 있다고 여겨진다[8]. 주로 휴식기의 깨어있는 상태와 관련 있는 network나 최근에 코마 환자의 회복과정에서 중요한 특성으로 DMN의 역할에 대한 관심이 증가하고 있다[9]. 식물인간 상태, 뇌사, 외상으로 인한 뇌손상으로 인한 의식저하 환자들의 여러 기능자기공명영상(functional MRI, fMRI) 연구에서 DMN의 연결성이 심각하게 저하되었다고 보고되었다[10-15]. 또한 의식이 호전되는 환자에서 의식이 호전되지 못하는 환자에 비하여 DMN의 연결성이 더 잘 보존되어 있음을 확인하였다. 이에 본 연구에서는 심정지 후 의식저하를 보이는 환자에서 72시간 내에 시행하게 되는 뇌파검사의 정량적 분석을 통한 DMN의 연결성 변화를 확인하여 신경계 예후와의 관련성을 확인하고자 하였다.
이 연구의 목적은 자발순환회복 후 72시간 이내의 뇌파를 이용한 파워스펙트럼밀도(PSD)분석 및 내정상태회로(DMN)의 연결성 분석이 초기 정량적 뇌파분석지표로서 심정지후증후군 환자의 신경계 예후예측에 도움이 되는지 확인하고자 하는 데 있다.
이 연구는 심정지 후 환자 레지스트리(registry)와 자발순환회복 후 72시간내 시행한 뇌파를 사용한 후향적 연구이다. 이 연구는 성균관대학교 의과대학 부속 삼성창원병원의 임상시험 심사위원회의 승인을 받았다(IRB No: 2017-04-002-002). 이 연구는 심정지 후 환자 레지스트리와 통계 및 임상 특징을 포함한 전자의무기록(electronic medical records, EMR)을 기반으로 자료를 수집하였다.
2012년 3월부터 2019년 2월까지 삼성창원병원에 내원한 심정지 후 환자로 등록된 환자들을 대상으로 하였다. 목표체온요법을 받은 18세 이상의 모든 심정지후증후군 환자의 데이터를 수집하였다. 다만 환자 중 1) 목표체온요법을 받지 않은 환자, 2) 자발순환 회복 후 72시간내 뇌파를 시행하지 않은 환자, 3) 개인정보보호 등을 이유로 EMR 자료 수집이 불가능한 환자, 4) 신경계 예후가 록되지 않은 환자, 5) 뇌파가 판독이 어려울 정도로 잡파가 많은 환자는 제외하였다.
모든 환자는 심정지후증후군의 표준 치료법에 따라 치료되었다. 현재 보편적으로 사용되는 미국심장협회(American Heart Association, AHA) 가이드라인에 따라 목표체온요법을 시행하였다. 목표체온인 34℃에 도달하기 위해 하이드로겔 패드(ArcticSun; Medivance Corp., Louisville, CO, USA)나 냉각 매트리스(Medi-Therm, Gaymar; Gaymar Industries Inc., Orchard Park, NY, USA), 4℃ 냉각 식염수를 통한 방광세척의 통상적 보조적 방법을 사용하여 체온 하강을 유도하였다. 목표체온에 도달 후 24시간 동안 33-35℃ 범위로 체온을 유지하고, 유지 기간 이후에는 시간당 0.15℃로 36.5℃로 유지하였다. 목표체온요법을 실시하는 동안 진정과 떨림의 방지를 위해 목표체온요법 시작과 동시에 지속적 레미펜타닐(remifentanil) 정맥 주입(0.1-0.2 mcg/kg/min), 지속적 미다졸람(midazolam) 정맥 주입(0.04-0.2 mg/kg/hr), 간헐적 시스아트라쿠륨(cisatracurium) 정맥 투여(0.5-3 mcg/kg/min)를 이용하였다. 목표체온요법 시행 24시간 뒤부터 천천히 온도를 증량하여 정상체온에 도달시키는데 이 때 remifentanil, midazolam, cisatracurium도 점차 감량하였고 목표체온요법이 끝나는 48-72시간 내에 진정약물은 중단하게 된다. 중심체온은 식도 소식자를 이용하여 지속적으로 감시하였다. 임상적인 경련이나 간대성 근경련이 있는 환자에서는 뇌파 상 뇌전증모양방전 여부에 관계없이 레비티라세탐(levetiracetam), 발프로산(valproic acid) 등 주사제제가 있는 항경련제를 정맥 주사하여 치료하였다.
다음 데이터들은 후향적으로 검토되었다: 환자 연령, 성별, 쓰러질 당시의 목격자 존재 유무, 첫 심전도(electrocardiogram, ECG) 결과, 심정지의 원인, 심정지의 위치, 병원내 심폐소생술시간, 글래스고혼수척도(Glasgow coma scale, GCS), 순환정지시간, 자발순환 회복에서 뇌파 및 뇌 CT까지 걸린 시간, 기록된 각 환자의 심정지 원인이 Utstein법에 기반하여 분류되었다. 퇴원시 글래스고 피츠버그 Cerebral Performance Category (CPC) 점수를 사용하여 신경계 예후를 평가하였으며 이는 다음과 같다: 1(회복), 2(중등도장애), 3(심한 장애), 4(식물인간 상태), 5(뇌사) [16]. 신경계 예후는 좋은 신경계 예후(CPC 1,2)와 나쁜 신경계 예후(CPC 3-5)로 이분화하였다. 또한 모든 뇌파 기록은 2명의 인증된 신경과 전문의에 의해 악성 뇌파 패턴이 판독되었다. 악성 뇌파 패턴이란 나쁜 예후를 보일 것으로 추측되는 뇌파로 이 연구에서는 배경파억제(background suppression)나 돌발파억제(burst suppression), 뇌전증모양방전(epileptiform discharge), 알파코마(alpha coma) 또는 세타코마(theta coma), 주기방전(periodic discharge)으로 정의하였다.
심정지 후 72시간 이내 뇌파 중 가장 대표적인 구간(5분)을 눈을 감은 휴식(resting) 상태의 뇌파를 분석에 포함시켰으며 참조 몽타주(reference montage)와 다음 19채널을 데이터분석에 사용하였다: FP1, FP2, F7, F3, Fz, F4, F8, T3, C3, Cz, C4, T4, T5, P3, Pz, P4, T6, O1, O2. 참조 전극(reference electrode)으로는 공통 평균 참조 전극(common average reference)을 사용하였다. 뇌파 데이터는 250 Hz의 표본추출비율(sampling rate)로 저장하였으며, 고주파수통과필터(high-pass filter)는 1 Hz로, 저주파수통과필터(low-pass filter)는 45 Hz로 설정하여 평균 기준으로 재계산하였다. 뇌파 잡파는 육안검사 및 advanced mixture independent component analysis (ICA)를 통해 제거하였다[17]. 잡파가 제거된 뇌파에서 EEGLAB [18]을 기반으로 spectopo 기능을 사용한 센서 레벨의 분석은 다음 8개의 스펙트럼으로 나누었다. 델타(1-3.99 Hz), 세타(4-7.99 Hz), 알파1 (8-9.99 Hz), 알파2 (10-11.99 Hz), 베타1 (12-14.99 Hz), 베타2 (15-19.99 Hz), 베타3 (20-29.99 Hz) 및 감마(30-44.99 Hz). 8-12 Hz의 주파수를 가지는 알파는 정상인의 경우 휴식기의 깨어 있는 상태에서 관찰되며 12-30 Hz의 주파수를 가지는 베타는 긴장기의 깨어 있는 상태에서 발견되므로 환자의 의식 수준과 연관이 있다고 알려져 있다. 이에 본 연구에서는 알파와 베타를 좀 더 세분화하여 의식과 인지기능 관련 연관성이 많은 주파수 영역대를 세분화하고자 하였다. 절대적 밴드(absolute band) 파워는 1초의 겹치는 창(window)을 가진 각각의 2초의 뇌파 데이터에 이산 푸리에 변환에 의해 계산되고, 로그(log) 스케일로 표현되었다. 상대적 밴드(relative band) 파워는 모든 주파수 대역에 걸친 총 전력에서 특정 주파수 전력의 분율로 계산되었다.
소스(source) 재구성은 Desikan & Kiliany atlas [19]에 기반한 68 region of interest (ROI)와 Colin 27 head model [20]을 사용하는 standardized Low Resolution Electromagnetic Topography (sLORETA) plugin [21]을 사용하여 시행되었다. 허수부 일관성(imaginary coherence, iCoh)은 특정 ROI 사이의 뇌의 상호작용을 연구하는데 볼륨전도(volume conduction)의 영향이 가장 적은 신뢰성이 높은 훌륭한 척도로서 본 연구에서 기능적 연결성의 척도로 계산되었다. iCoh는 일관성(coherence)의 허수 부분으로 다음과 같이 정의된다[22].
iCoh = im(Coh(f)) = im((S_xy (f))/{(S_xx (f) S_yy (f))}1/2)
여기서 Sxy(f)는 교차 파워 스펙트럼 밀도이고, Sxx(f)와 Syy(f)는 각 채널의 X와 Y에 대한 자동 파워 스펙트럼 밀도이다.
Advanced mixture ICA, 센서 레벨 기능 추출 및 소스 레벨 기능 추출을 사용한 모든 전처리단계는 iSyncBrain® (iMediSync, Seoul, Korea)에서 시행되었다.
좋은 신경계 예후군과 나쁜 신경계 예후군의 기본 임상 특성 차이 분석에서 연속형 자료(연령, 순환정지시간, 순환불충분시간, GCS, 동공 크기, neuron specific enolase)는 독립적인 t test를 사용하여 비교하였다: 데이터는 평균±표준편차로 표현하였다. 카이제곱 및 Fisher’s exact test를 사용하여 정량적 데이터(성별, 심정지시 목격자 심폐소생술 여부, 제세동기 사용 여부, 동공반사 여부, 경련 여부, 심정지의 원인, 뇌파의 육안적 분석 결과)를 평가하였다. 파워스팩트럼밀도(power spectral density, PSD)분석에서 각 주파수대역의 뇌파의 정량적 분석 결과에서 절대적 파워(absolute power)와 상대적 파워(relative power) 및 DMN 분석에서는 독립적인 t test 및 다중검정비교의 문제(multiple comparison problem, MCP)를 보정하기 위하여 사후분석(post hoc)을 false discovery rate (FDR)를 사용하여 분석하였고 corrected p 0.05을 적용하여 통계적 유의성을 나타내었다. DMN 시각화에서는 corrected p 0.05 이하의 값들 중에서 유의수준 상위 30개만 시각화하였다. 모든 분석은 사회과학을 위한 IBM 통계 패키지(SPSS ver. 22; IBM, Armonk, NY, USA)와 양면 p value <0.05와 FDR 시행 후 corrected p 0.05값을 고려하여 통계학적 유의성을 나타내었다.
심정지 후 환자 레지스트리(registry)에서 총 349명의 심정지후증후군 환자를 수집하였다. 이 중 목표체온요법을 받지 않은 34명, 72시간내 시행한 뇌파가 없는 93명, 뇌파가 심한 잡파 등으로 판독이 어려운 39명은 최종분석에서 제외되어 최종분석시 남은 환자는 총 183명이다(Fig. 1). 183명 중 퇴원시 53명의 환자에서 좋은 신경계 예후(CPC 1,2)를 보였고, 130명은 나쁜 신경계 예후(CPC 3-5)를 보였다(Table 1). 연구 참가자의 평균 연령은 54.30±15.27세였으며 환자의 67.2%가 남성이었다. 또한 CPC 1점(21, 11.48%), CPC 2점(32, 17.49%), CPC 3점(29, 15.85%), CPC 4점(35, 19.13%), CPC 5점(66, 36.07%)의 분포를 보였다. 좋은 신경계 예후군에서는 자발순환회복 시까지 짧은 심폐소생술(16.68±12.85 vs. 27.45±23.31, p<0.001)이 이루어졌고, 초기 심전도에서 제세동이 가능한 리듬(52.8% vs. 29.2%; p=0.003)을 보였으며 더 높은 글래스고혼수척도(GCS) (5.66±2.99 vs. 3.65±1.99; p<0.001)를 나타내고, 더 작은 동공의 크기(3.62±1.39 vs. 4.67±2.29, p<0.001)와 더 높은 빈도의 동공반사의 유지(41 [85.4%] vs. 48 [36.9%]; p<0.001)를 보였다(Table 1).
육안적 뇌파 판독에서는 (1) 배경파억제(background suppression) 소견은 좋은 신경계 예후군에서 27명(50.9%), 나쁜 신경계 예후군에서 98명(75.4%)에서 나타나고(p<0.001), (2) 돌발파억제(burst suppression)는 좋은 신경계 예후군에서 없었고, 나쁜 신경계 예후군에서 14명(10.8%)에서 나타났다(p=0.013). (3) 알파 또는 세타 코마는 좋은 신경계 예후군에서 15명(28.3%), 나쁜 신경계 예후군에서만 7명(5.4%)에서(p<0.001), (4) 주기방전(periodic discharge)은 좋은 신경계 예후군에서 없었고, 나쁜 신경계 예후군에서 11명(8.5%)에서 나타났다(p=0.029). 그리고 (5) 뇌전증모양방전(epileptiform discharge)은 좋은 신경계 예후군에서 2명(3.8%), 나쁜 신경계 예후군에서 24명(18.5%)에서 관찰되었다(p=0.010) (Table 2).
파워스펙트럼밀도(PSD)분석 결과와 신경계 예후 사이에 높은 연관성을 확인하였다. 먼저 뇌 전체 영역에서 각 밴드의 파워스펙트럼밀도의 합은 신경계 나쁜 예후군에서 세타 파워가 증가되어 있었고 신경계 예후가 좋은 군에서는 알파 밴드의 파워가 증가된 소견을 관찰할 수 있었다. 그러나 그 외의 주파수에서는 두 군 간의 차이가 없었다(Fig. 2). 좀 더 뇌 영역 간 주파수 대역의 차이를 세분화하여 자세히 관찰하기 위하여 5개 영역에 기초하여 보다 뇌 영역을 나누고 세분화된 주파수 대역별 절대 파워(absolute power)를 계산하였을 때에 좀 더 자세한 차이를 관찰할 수 있었는데 신경계 좋은 예후를 보이는 군은 전두부(frontal), 측두부(temporal), 후두부(occipital)에서 알파1 밴드의 절대 파워가 유의미하게 증가되어 있었고 알파2부터 베타1, 2 밴드까지는 5개 모든 뇌 영역에서 절대적 파워에서 차이가 관찰되었다(Table 3, Fig. 3). 상대적 파워(relative power)분석 결과에서는 두 군 간의 유의한 차이가 보다 광범위한 부위에서 관찰되었다(Table 4, Fig. 4). 좋은 신경계 예후 군에서 알파1, 2 밴드 및 베타1 밴드의 상대적 파워는 각 5개의 뇌 영역에서 모두 증가하였고, 베타2 밴드에서는 전두부(frontal), 중심부(central)와 두정부(parietal)의 영역에서만 유사한 결과가 관찰되었고 그 외 영역에서는 차이가 나타나지 않았다. 이와 반대로 나쁜 예후군에서는 델타 밴드에서 모든 뇌 영역에서 증가된 상대적 파워를 보였고 베타3 밴드에서 감마 밴드까지의, 즉 20 Hz 이상의 높은 주파수 대역의 상대적 파워가 각 5개의 뇌 영역에서 모두 크게 증가하였다. 두 개의 다른 주파수 대역 간 스펙트럼밀도의 파워 비율은 두 군 간에 통계학적으로 유의한 차이가 없었다.
내정상태회로(DMN)의 연결성분석에서는 신경계 좋은 예후군에서 나쁜 예후를 보이는 군보다 허수부 일관성(iCoh)값의 유의한 증가가 관찰되었다. 이러한 변화는 상 전두엽(superior frontal lobe), 전방 및 후방 대상피질(anterior and posterior cingulate), 상측두엽(superior temporal), 하두정엽피질(inferior parietal cortex), 해마곁이랑(para hippocampal gyrus)과 같은 전방 및 후방 영역의 DMN의 거의 모든 영역에서 광범위하게 관찰되었다. 알파1 밴드에서는 주로 후방 영역의 DMN의 영역들이 DMN의 중앙 노드를 형성하는 후방 대상피질(posterior cingulate cortec, PCC)과의 연결성이 증가되어 있었는데 양측 모두에서 연결성이 증가되어 있었고 주로 우측 측두엽과 해마곁이랑 및 내후각피질(entorhinal cortex) 등의 우측 변연계(limbic system)와 관련된 영역들과의 연결성이 증가되어 있었다. 반면 알파2 주파수 밴드에서는 좌우의 두정엽(frontal)과 좌우 전방 대상피질(anterior cingulate cortex, ACC) 사이의 연결성이 증가되어 있었고 역시 후방 영역에서도 PCC를 포함한 좌우 측두엽과 해마곁이랑 및 내후각피질(entorhinal cortex) 등의 변연계(limbic system)관련 영역들의 좌우 연결성이 증가된 것이 잘 관찰되었다. 상대적으로 전두엽 극(frontal pole), 상두정엽피질(superior parietal cortex), 같은 상방 영역의 허수부 일관성(iCoh)이 증가하지 않았다(Fig. 5).
이 연구의 결과는 초기 뇌파 기록을 기반으로 한 정량적 뇌파분석이 심정지후증후군 환자의 예후예측지표로 활용될 수 있는 가능성을 보여주었다.
본 연구에서도 상당수의 악성 뇌파 패턴을 보이는 환자들 중에서 좋은 신경계 예후를 보이는 것을 발견할 수 있었다. 일반적으로 심정지후증후군 환자에서 뇌파의 육안적 분석은 악성과 양성 같은 뇌파 양상의 이분법적 정의를 사용해왔다. 뇌파에서 허혈성손상 후의 뇌전증지속상태, 알파코마, 돌발성 혹은 전반적 억제가 존재할 때 악성으로 간주하였다. 전반적 서파 활동성, 전반적 알파-세타 주파수 및 뇌전증모양방전의 존재는 양성 또는 불분명한 것으로 간주하였다. 최근의 연구를 보면 심정지 후 12%의 생존자와 86%의 비생존자가 첫 3일간 악성 뇌파 양상을 보였다[23]. 자발순환회복 후 첫 24시간 동안의 악성 뇌파 소견은 나쁜 예후를 보이는 것으로 알려져 있으며 29-84%에 이르는 민감도와 0-8%에 이르는 위양성률을 보인다[24,25]. 본 연구에서도 뇌파의 육안적 중증도를 비교하였을 때 나쁜 예후 그룹에서 배경파억제, 돌발파억제, 주기방전, 뇌전증모양방전의 발생 빈도가 더 높았으며 알파 또는 세타 코마의 경우에는 좋은 예후군에서 발생 빈도가 통계적으로 유의하게 높았다. 즉 육안적 뇌파에 의존한 판단에 한계가 있음을 보여주었다.
2006년 American Academy of Neurology의 예후예측 알고리즘에서는 심정지 및 자발순환회복 후의 뇌파기록 시작 시기나 기록시간에 대한 권고사항을 제시하지 않고 있다[26]. 그러나 2014년 European Resuscitation Council and Society of Intensive Care Medicine의 가이드라인에 따르면 자발순환회복 72시간 이후 뇌파를 기록하는 것을 권고하였다[27]. 대조적으로 최근 업데이트된 가이드라인은 지속적인 뇌파 모니터링 또는 빈번한 간헐적인 뇌파의 시행시 “최대한 빠르게” 또는 “최소 자발순환회복 12-24시간내”를 제안하고 있다[28]. 이는 보다 빠른 시기에, 보다 정확하게 신경계 예후를 예측하기 원하는 임상적 필요의 증가를 반영한다고 볼 수 있다. 특히 우리나라의 경우 2016년 연명의료결정법 개정으로 2018년 2월부터 질환에 상관없이 회복 불가능한 임종에 임박한 모든 연령의 중환자로 확대 적용됨에 따라 환자의 조기에 정확한 신경계 예후예측에 대한 요구가 이전보다 더욱 증가하였다. 따라서 좋은 예후일 때 정량적 뇌파의 초기 표지자가 현재 임상 환경에서 매우 중요하다고 할 수 있다.
한 연구에서는 자발순환회복 후 12시간 뒤 유리한 뇌파 양상, 즉, 연속적이고 반응성이 있는 배경파를 보이는 경우 좋은 예후를 예측함에 있어 51%의 민감도를 보이지만 위양성률은 0-12%로 낮다고 보고하였다[29]. 그러나 또다른 연구에서는 양성 뇌파 양상만으로는 환자의 신경계 회복을 예측할 수 없다고 주장하였다[30]. 본 연구는 더 상세한 주파수 대역을 구분하여 각각의 뇌 영역에 대해 파워스펙트럼밀도(PSD)분석을 시행하였고, 이러한 결과는 국소 해부학적 특성을 잘 반영한 보다 구체적인 결과를 보여주었다. 절대적 파워의 및 상대적 파워의 분포는 두 군 간의 차이를 보여주는 유용한 정량적 뇌파의 지표로의 가능성을 보여 주었는데 절대적 파워는 좋은 예후군의 알파1, 2와 베타1, 2 주파수 대역에서 높았으며 전두부와 중심부에 주로 분포하고 있다. 상대적 파워는 좋은 예후군의 세타파와 알파1, 2 주파수 대역에서 그리고 베타1에서 크게 높았다. 그러나 좋은 예후군에서의 이러한 상대적 파워의 증가 양상은 베타2 이상의 즉, 20 Hz 이상의 높은 주파수 범위에서는 반전되는데 베타3와 감마 이상의 높은 주파수의 상대적 파워는 좋은 신경계 예후군에서 크게 감소하는 양상을 보이고, 오히려 나쁜 예후군에서는 증가하는 소견을 보였다. 이러한 발견은 인간을 대상으로 한 이전의 연구들에서는 더 빠르고, 세분화된 주파수 대역 별로 분석하지 않았기 때문에 아직까지 보고된 바가 없다. 본 연구를 통해 새롭게 확인된 것으로 이전 연구에서는 보고되지 않은 새로운 보고이다. 그러나 동물 연구 중에서는 일치되는 보고가 있었는데 급격한 무수축성 심정지를 발생시켜 무산소 뇌손상이 유발된 설치류에서는 뇌파에서 감마 활동의 급격한 증가와 함께 이 주파수 대역의 기능적이고 효율적인 연결성 강화가 보고되었다[31].
이 연구에서 DMN의 허수부 일관성(iCoh)은 정량적 뇌파의 기능적 연결성의 변수로서 계산되었고, 신경계 좋은 예후군에서 나쁜 예후를 보이는 군에 비하여 전방 및 후방 부위의 DMN의 연결성의 차이가 발견되었다. DMN의 iCoh의 2D diagram이 그림으로 표현될 때 두 군 사이의 연결성의 차이가 관찰되었다(Fig. 5). 이는 기존 연구 결과들[10-15]에서 의식이 회복된 코마 환자에서는 DMN가 잘 유지되어 있었고, 의식회복이 되지 않은 코마 환자나 식물 상태(vegetative stat)의 환자에서 DMN이 손상된 것을 보고한 fMRI 연구들과 허혈성 뇌손상에서 뇌의 다른 영역 간의 기능적 연결성(functional connectivity)의 저하를 뇌파의 일관성(coherence)이 감소된 것을 통해 확인한 기존의 연구 결과들과 일치하는 결과라고 할 수 있다. 특히 알파 대역에서 유의미한 결과가 가장 잘 관찰되는 것은 이전 연구들에서 fMRI의 혈류산소수준(blood oxygen level dependent, BOLD)과 뇌파의 알파 대역 간의 연관성이 가장 잘 보였던 점과 연관성이 있을 수 있으며 DMN의 기존의 뇌파연구들에서 주로 알파 이상의 주파수에서 가장 잘 내정상태회로의 변화가 잘 반영되는 특성과 연관이 있을 수 있다[32]. 한편 신경계 예후가 나쁜 군에서 일부 DMN의 연결성의 증가가 델타와 베타2에서 극소수 영역에서 관찰되었으나 이외의 주파 대역에서는 두 군 간의 차이가 관찰되지 않았다(Supplementary Fig.).
본 연구는 의식과 연관된 네트워크인 DMN의 비정상적인 기능이 허혈성 뇌손상 신경계 예후를 예측하는 지표로의 활용 가능성을 보여주었다. 이는 심정지 후 환자의 신경학적 예후를 결정하는 첫 단계인 의식 회복의 지연을 가져오게 됨으로 나쁜 신경계 예후와 밀접한 연관성을 가지고 있을 가능성이 있다. 또한 심정지 후 생존 환자들에서 자주 관찰되는 기억력장애와의 연관성도 생각해 볼 수 있겠다.
본 연구는 처음으로 72시간 이내의 뇌파를 활용하여 허수부 일관성(iCoh)을 계산하여 DMN의 연결성을 분석함으로써 신경계 예후의 특성과 의식의 회복을 예측하는 데 이러한 분석이 평가에 도움이 될 수 있음을 처음으로 확인한 연구이다.
그러나 이 연구가 가지는 몇 가지 한계점이 있는데 목표체온요법을 실시하는 동안 진정과 떨림의 방지를 위해 지속적 remifentanil 정맥 주입, 지속적 midazolam 정맥 주입이 있었고, 이 기간 동안 뇌파가 측정되어 뇌파에서 remifentanil 및 midazolam의 영향을 배제할 수 없다는 점이다. 그러나 기존의 연구들 중 심정지 후 저체온요법을 시행한 소아 환자들의 지속적 뇌파연구에서 기능적 연결성(functional connectivity)을 일관성(coherence)으로 분석한 연구 결과에서 저체온요법이 일관성(coherence)에 영향을 미치지 않는다고 보고하였다[14].
요약하자면 이 연구는 심정지후증후군 환자의 보다 신속하고 정확한 신경계 예후 평가를 돕기 위하여 초기 뇌파를 활용하여 정량적 뇌파의 조기지표로 활용할 수 있는 인자들을 발굴하여 그 유용성을 확인하기 위해 시행되었으며 주된 발견은 다음과 같다. 1) 정량적 뇌파분석에서 파워스펙트럼밀도(PSD)분석은 뇌파 해석을 객관적으로 시행할 수 있고 신경계 예후를 예측하는 데 도움을 줄 수 있다. 또한 2) 허수부 일관성(iCoh)을 사용한 내정상태회로(DMN)의 연결성 변화는 허혈성 뇌손상에서 의식 회복을 포함한 신경계예후와 장기적 인지장애를 설명하는 데 의미 있는 발견이다. 이 연구는 정량적 뇌파분석을 사용하여 심정지후증후군(PCAS) 환자에서 신경계 예후를 예측함에 있어 허수부 일관성(iCoh)을 사용한 내상태회로(DMN)분석의 유용성을 보여주는 첫 연구로서의 의미가 있다.
REFERENCES
1. Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, et al. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation 2015;131:e29-e322.


2. Kim YH, Lee JH, Hong CK, Cho KW, Yeo JH, Kang MJ, et al. Feasibility of optic nerve sheath diameter measured on initial brain computed tomography as an early neurologic outcome predictor after cardiac arrest. Acad Emerg Med 2014;21:1121-1128.


3. Young GB. Clinical practice. Neurologic prognosis after cardiac arrest. N Engl J Med 2009;361:605-611.


4. Golan E, Barrett K, Alali AS, Duggal A, Jichici D, Pinto R, et al. Predicting neurologic outcome after targeted temperature management for cardiac arrest: systematic review and meta-analysis. Crit Care Med 2014;42:1919-1930.


5. Lodder SS, van Putten MJ. Quantification of the adult EEG background pattern. Clin Neurophysiol 2013;124:228-237.


6. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002;346:549-556.

7. Asgari S, Moshirvaziri H, Scalzo F, Ramezan-Arab N. Quantitative measures of EEG for prediction of outcome in cardiac arrest subjects treated with hypothermia: a literature review. J Clin Monit Comput 2018;32:977-992.


8. Buckner RL, Andrews-Hanna JR, Schacter DL. The brain's default network: anatomy, function, and relevance to disease. Ann N Y Acad Sci 2008;1124:1-38.


9. McKiernan KA, D'Angelo BR, Kaufman JN, Binder JR. Interrupting the "stream of consciousness": an fMRI investigation. Neuroimage 2006;29:1185-1191.


10. Norton L, Hutchison RM, Young GB, Lee DH, Sharpe MD, Mirsattari SM. Disruptions of functional connectivity in the default mode network of comatose patients. Neurology 2012;78:175-181.


11. Cauda F, Micon BM, Sacco K, Duca S, D'Agata F, Geminiani G, et al. Disrupted intrinsic functional connectivity in the vegetative state. J Neurol Neurosurg Psychiatry 2009;80:429-431.


12. Vanhaudenhuyse A, Noirhomme Q, Tshibanda LJ, Bruno MA, Boveroux P, Schnakers C, et al. Default network connectivity reflects the level of consciousness in non-communicative brain-damaged patients. Brain 2010;133:161-171.


13. Boly M, Tshibanda L, Vanhaudenhuyse A, Noirhomme Q, Schnakers C, Ledoux D, et al. Functional connectivity in the default network during resting state is preserved in a vegetative but not in a brain dead patient. Hum Brain Mapp 2009;30:2393-2400.



14. McLaren J, Holmes GL, Berg MT. Functional connectivity in term neonates with hypoxic-ischemic encephalopathy undergoing therapeutic hypothermia. Pediatr Neurol 2019;74-79.

15. Beudel M, Tjepkema-Cloostermans MC, Boersma JH, van Putten MJAM. Small-world characteristics of EEG patterns in post-anoxic encephalopathy. Front Neurol 2014;5:97.
17. Delorme A, Palmer J, Onton J, Oostenveld R, Makeig S. Independent EEG sources are dipolar. PLoS One 2012;7:e30135.



18. Delorme A, Makeig S. EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis. J Neurosci Methods 2004;134:9-21.


19. Desikan RS, Ségonne F, Fischl B, Quinn BT, Dickerson BC, Blacker D, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage 2006;31:968-980.


20. Holmes CJ, Hoge R, Collins L, Woods R, Toga AW, Evans AC. Enhancement of MR images using registration for signal averaging. J Comput Assist Tomogr 1998;22:324-333.


21. Pascual-Marqui RD. Standardized low-resolution brain electromagnetic tomography (sLORETA): technical details. Methods Find Exp Clin Pharmacol 2002;24 Suppl D:5-12.

22. Nolte G, Bai O, Wheaton L, Mari Z, Vorbach S, Hallett M. Identifying true brain interaction from EEG data using the imaginary part of coherency. Clin Neurophysiol 2004;115:2292-2307.


23. Fugate JE, Wijdicks EF, Mandrekar J, Claassen DO, Manno EM, White RD, et al. Predictors of neurologic outcome in hypothermia after cardiac arrest. Ann Neurol 2010;68:907-914.


24. Sivaraju A, Gilmore EJ, Wira CR, Stevens A, Rampal N, Moeller JJ, et al. Prognostication of post-cardiac arrest coma: early clinical and electroencephalographic predictors of outcome. Intensive Care Med 2015;41:1264-1272.


25. Hofmeijer J, Beernink TM, Bosch FH, Beishuizen A, Tjepkema-Cloostermans MC, van Putten MJ. Early EEG contributes to multimodal outcome prediction of postanoxic coma. Neurology 2015;85:137-143.



26. Wijdicks EF, Hijdra A, Young GB, Bassetti CL, Wiebe S; Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2006;67:203-210.


27. Sandroni C, Cariou A, Cavallaro F, Cronberg T, Friberg H, Hoedemaekers C, et al. Prognostication in comatose survivors of cardiac arrest: an advisory statement from the European Resuscitation Council and the European Society of Intensive Care Medicine. Resuscitation 2014;85:1779-1789.


28. Taccone FS, Baar I, De Deyne C, Druwe P, Legros B, Meyfroidt G, et al. Neuroprognostication after adult cardiac arrest treated with targeted temperature management: task force for Belgian recommendations. Acta Neurol Belg 2017;117:3-15.


29. Sondag L, Ruijter BJ, Tjepkema-Cloostermans MC, Beishuizen A, Bosch FH, van Til JA, et al. Early EEG for outcome prediction of postanoxic coma: prospective cohort study with cost-minimization analysis. Crit Care 2017;21:111.



30. Rothstein TL, Thomas EM, Sumi SM. Predicting outcome in hypoxic-ischemic coma. A prospective clinical and electrophysiologic study. Electroencephalogr Clin Neurophysiol 1991;79:101-107.

Figure 1.
Study flow. TTM; targeted temperature management, EEG; electroencephalography, QEEG; quantitative electroencephalography, PSD; power spectral density.
Figure 2.
The comparison of PSD in each frequency band between patients groups with favorable (good) and poor (poor) neurologic outcomes. The PSD regarding each frequency band were calculated and integrated in whole brain area PSD of alpha frequency band is increased in good neurological outcome group compared with poor outcome group. PSD; power spectral density.
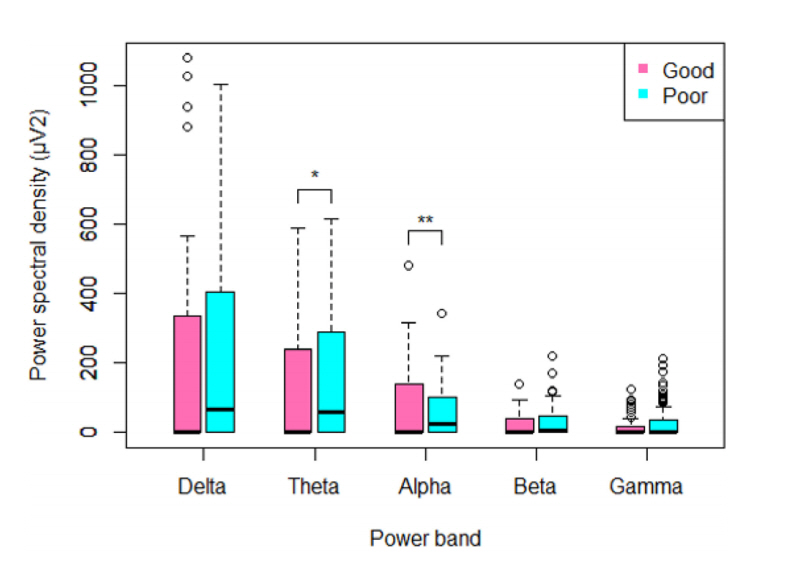
Figure 3.
Topographical maps of absolute power in PSD in patients groups with poor (poor) and favorable (good) neurologic outcomes. The absolute spectral power from alpha 1, 2, beta 1 and 2 are increased in good outcome group (C-F). (A) Delta band. (B) Theta band. (C) Alpha 1 band. (D) Alpha 2 band. (E) Beta 1 band. (F) Beta 2 band. (G) Beta 3 band. (H) Gamma. PSD; power spectral density.
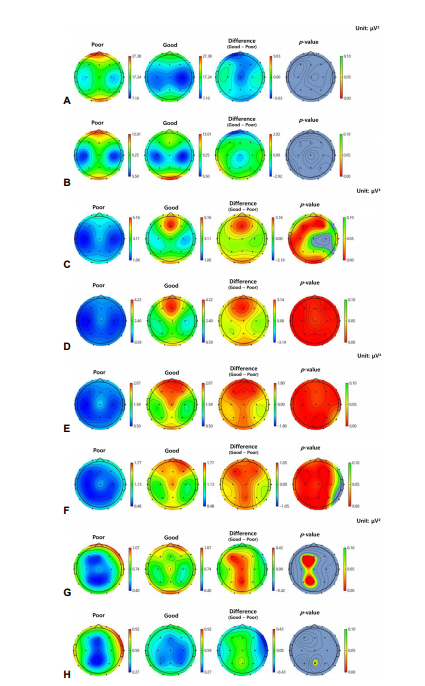
Figure 4.
Topographical maps of relative power in PSD in patients groups with poor (poor) and favorable (good) neurologic outcomes. The relative spectral power from alpha 1, 2, beta 1 and 2 are increased in good outcome group (B-F). Moreover, the relative spectral power from delta, beta 3 and gamma are increased in poor outcome group (A, G, H). (A) Delta band. (B) Theta band. (C) Alpha 1 band. (D) Alpha 2 band. (E) Beta 1 band. (F) Beta 2 band. (G) Beta 3 band. (H) Gamma. PSD; power spectral density.
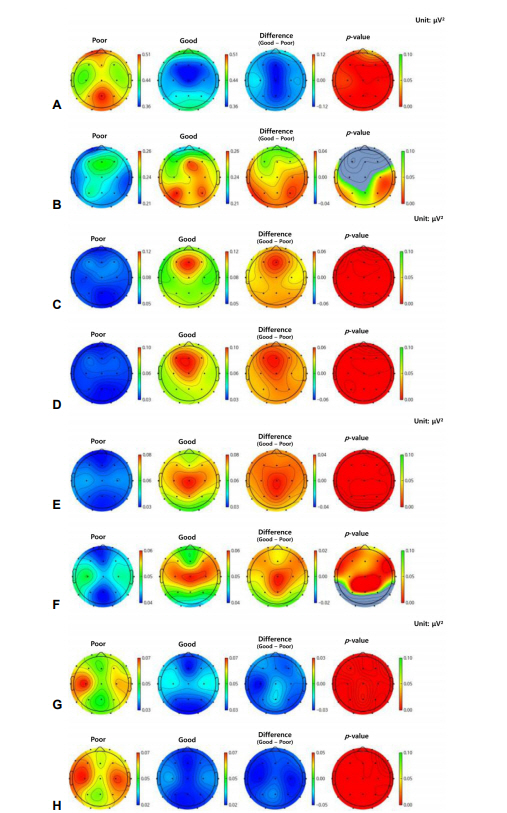
Figure 5.
Difference of iCoh of DMN in patients groups with poor (poor) and favorable (good) neurologic outcomes. (A, B) There are significant increase of iCoh in good neurologic outcome group on alpha 1-2 bands. The line represents the differences of iCoh of DMN between two groups. The color bar showed the p-value range and the color of the line represent the p-value. The color of the box of ROIs means the average power of the iCoh. The top thirty of p-value were displayed. (A) Alpha 1 frequency (8-9.99 Hz) in DMN. (B) Alpha 2 frequency (10-11.99 Hz) in DMN. iCoh; imaginary coherence, DMN; default mode network.
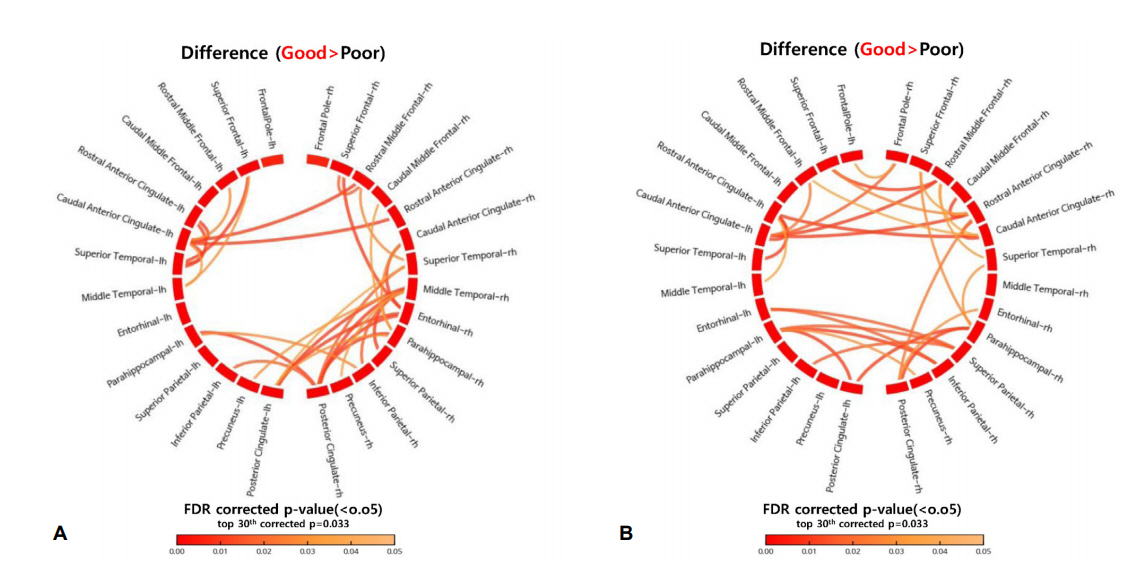
Table 1.
Demographic and baseline characteristics
| Characteristic | Total (n=183) | Good (n=53) | Poor (n=130) | p-value |
|---|---|---|---|---|
| Age (years) | 54.30±15.27 | 50.25±14.52 | 55.95±15.33 | 0.022c |
| Male | 123 (67.2) | 36 (67.9) | 87 (66.9) | 0.896 |
| Bystander CPR | 121 (66.5) | 39 (73.6) | 82 (63.1) | 0.193 |
| No flow timea (minutes) | 4.13±6.94 | 4.14±7.22 | 4.13±6.84 | 0.992 |
| Low flow timeb (minutes) | 24.28±21.32 | 16.68±12.85 | 27.45±23.31 | <0.001d |
| Defibrillation, yes | 89 (48.6) | 37 (69.8) | 52 (40.0) | <0.001d |
| Shockable rhythm | 66 (36.1) | 28 (52.8) | 38 (29.2) | 0.003d |
| GCS | 4.23±2.49 | 5.66±2.99 | 3.65±1.99 | <0.001d |
| Pupil light reflex | 89 (53.3) | 41 (85.4) | 48 (36.9) | <0.001d |
| Pupil size (mm) | 4.37±2.13 | 3.62±1.39 | 4.67±2.29 | <0.001d |
| Seizure, yes | 59 (32.2) | 8 (15.1) | 51 (39.2) | 0.002c |
| NSE | 163.60±298.22 | 66.68±213.03 | 203.11±318.98 | <0.001d |
| CAG | 97 (52.3) | 38 (71.7) | 59 (45.4) | <0.001d |
| EEG acquisition time (hours) | 36.97±17.80 | 38.67±16.88 | 35.19±18.26 | 0.152 |
Table 2.
Visual grading
| Characteristic | Total (n=183) | Good (n=53) | Poor (n=130) | p-value |
|---|---|---|---|---|
| Background suppression | 125 (68.3) | 27 (50.9) | 98 (75.4) | <0.001a |
| Periodic discharge | 11 (6.0) | 0 (0.0) | 11 (8.5) | 0.029b |
| Alpha/theta coma | 22 (12.0) | 15 (28.3) | 7 (5.4) | <0.001a |
| Burst suppression | 14 (7.7) | 0 (0.0) | 14 (10.8) | 0.013b |
| Epileptiform discharge | 26 (14.2) | 2 (3.8) | 24 (18.5) | 0.010b |
Table 3.
Absolute power (μV2) of each frequency band in five brain areas
| Good (n=53) | Poor (n=130) | p-value | |
|---|---|---|---|
| Delta band (1-3.99 Hz) | |||
| Frontal | 14.18±17.70 | 20.53±45.38 | 0.240 |
| Central | 8.60±11.63 | 13.68±35.52 | 0.224 |
| Temporal | 11.69±14.84 | 15.81±34.27 | 0.318 |
| Parietal | 11.31±13.53 | 16.24±39.52 | 0.290 |
| Occipital | 18.20±21.59 | 24.66±59.46 | 0.359 |
| Theta band (4-7.99 Hz) | |||
| Frontal | 9.32±11.58 | 10.51±23.27 | 0.676 |
| Central | 6.33±6.83 | 7.11±16.47 | 0.695 |
| Temporal | 8.66±11.50 | 7.87±17.92 | 0.731 |
| Parietal | 8.23±10.32 | 8.77±23.18 | 0.848 |
| Occipital | 12.78±17.48 | 11.80±28.96 | 0.789 |
| Alpha 1 band (8-9.99 Hz) | |||
| Frontal | 3.73±5.11 | 1.96±4.37 | 0.010a |
| Central | 2.42±3.21 | 1.39±3.93 | 0.055 |
| Temporal | 2.87±3.49 | 1.60±3.97 | 0.023a |
| Parietal | 2.72±3.54 | 1.55±4.44 | 0.051 |
| Occipital | 4.54±5.92 | 2.16±5.61 | 0.005a |
| Alpha 2 band (10-11.99 Hz) | |||
| Frontal | 3.25±6.00 | 1.03±2.22 | 0.002a |
| Central | 2.28±3.87 | 0.81±2.42 | 0.003a |
| Temporal | 2.31±3.66 | 0.90±2.19 | 0.003a |
| Parietal | 2.28±3.53 | 0.82±2.40 | 0.002a |
| Occipital | 3.46±5.47 | 1.12±2.93 | <0.001b |
| Beta 1 band (12-14.99Hz) | |||
| Frontal | 2.41±4.76 | 0.82±1.79 | 0.006a |
| Central | 1.86±3.03 | 0.68±2.09 | 0.003a |
| Temporal | 1.89±3.23 | 0.84±1.99 | 0.005a |
| Parietal | 1.82±2.74 | 0.63±1.74 | <0.001b |
| Occipital | 2.32±3.61 | 0.92±2.33 | 0.003a |
| Beta 2 band (15-19.99 Hz) | |||
| Frontal | 1.58±1.80 | 0.75±1.67 | <0.001b |
| Central | 1.28±1.42 | 0.58±1.54 | 0.002a |
| Temporal | 1.34±1.38 | 0.83±1.93 | 0.048a |
| Parietal | 1.25±1.42 | 0.53±1.26 | <0.001b |
| Occipital | 1.51±1.50 | 0.80±1.88 | 0.005a |
| Beta 3 band (20-29.99 Hz) | |||
| Frontal | 0.90±0.75 | 0.80±1.86 | 0.633 |
| Central | 0.74±0.65 | 0.53±1.20 | 0.164 |
| Temporal | 0.90±0.94 | 0.92±2.23 | 0.946 |
| Parietal | 0.72±0.63 | 0.46±0.93 | 0.032a |
| Occipital | 1.03±1.03 | 0.81±1.85 | 0.339 |
| Gamma (30-45 Hz) | |||
| Frontal | 0.49±0.46 | 0.66±1.36 | 0.211 |
| Central | 0.36±0.29 | 0.45±1.03 | 0.458 |
| Temporal | 0.55±0.71 | 0.83±2.01 | 0.245 |
| Parietal | 0.36±0.27 | 0.36±0.80 | 0.972 |
| Occipital | 0.57±0.58 | 0.69±1.63 | 0.539 |
Table 4.
Relative power of each frequency band in five brain areas
| Good (n=53) | Poor (n=130) | p-value | |
|---|---|---|---|
| Delta band (1-3.99 Hz) | |||
| Frontal | 39.75±20.51 | 48.22±16.34 | 0.003a |
| Central | 37.12±18.86 | 46.25±15.86 | <0.001b |
| Temporal | 39.39±18.87 | 47.30±17.62 | 0.003a |
| Parietal | 39.81±19.11 | 49.68±16.72 | <0.001b |
| Occipital | 41.84±19.28 | 49.65±17.30 | 0.004a |
| Theta band (4-7.99 Hz) | |||
| Frontal | 24.21±11.89 | 22.74±9.60 | 0.343 |
| Central | 25.08±11.22 | 22.63±9.23 | 0.096 |
| Temporal | 25.44±11.69 | 21.95±9.00 | 0.019a |
| Parietal | 25.84±12.06 | 22.68±9.26 | 0.039a |
| Occipital | 25.60±13.53 | 22.19±9.98 | 0.043a |
| Alpha 1 band (8-9.99 Hz) | |||
| Frontal | 9.82±6.97 | 5.59±4.06 | <0.001b |
| Central | 9.50±6.05 | 5.66±3.42 | <0.001b |
| Temporal | 9.43±6.28 | 5.56±3.75 | <0.001b |
| Parietal | 9.39±6.12 | 5.24±3.71 | <0.001b |
| Occipital | 9.94±7.47 | 5.30±4.11 | <0.001b |
| Alpha 2 band (10-11.99 Hz) | |||
| Frontal | 8.29±6.80 | 3.74±2.63 | <0.001b |
| Central | 8.36±6.37 | 3.85±2.25 | <0.001b |
| Temporal | 7.58±5.77 | 3.70±2.24 | <0.001b |
| Parietal | 7.73±6.26 | 3.53±2.38 | <0.001b |
| Occipital | 7.60±6.20 | 3.47±2.57 | <0.001b |
| Beta 1 band (12-14.99 Hz) | |||
| Frontal | 6.68±5.41 | 3.52±2.03 | <0.001b |
| Central | 7.43±5.18 | 3.91±2.20 | <0.001b |
| Temporal | 6.48±4.77 | 3.84±2.22 | <0.001b |
| Parietal | 6.70±5.04 | 3.52±2.24 | <0.001b |
| Occipital | 5.66±4.48 | 3.44±2.11 | <0.001b |
| Beta 2 band (15-19.99 Hz) | |||
| Frontal | 5.39±4.17 | 4.11±2.90 | 0.002a |
| Central | 6.00±4.04 | 4.52±2.86 | 0.006a |
| Temporal | 5.29±3.65 | 4.54±3.22 | 0.131 |
| Parietal | 5.11±3.55 | 4.00±2.87 | 0.017a |
| Occipital | 4.23±2.98 | 4.03±2.98 | 0.642 |
| Beta 3 band (20-29.99 Hz) | |||
| Frontal | 3.65±2.79 | 5.76±5.33 | <0.001b |
| Central | 4.06±2.67 | 6.29±5.41 | <0.001b |
| Temporal | 3.89±2.84 | 6.31±5.82 | <0.001b |
| Parietal | 3.41±2.31 | 5.44±5.08 | <0.001b |
| Occipital | 3.14±2.32 | 5.68±5.30 | <0.001b |
| Gamma (30-45 Hz) | |||
| Frontal | 2.22±2.09 | 6.32±7.11 | <0.001b |
| Central | 2.44±2.24 | 6.89±7.61 | <0.001b |
| Temporal | 2.51±2.53 | 6.81±7.40 | <0.001b |
| Parietal | 2.02±1.81 | 5.91±6.64 | <0.001b |
| Occipital | 2.00±2.15 | 6.25±7.12 | <0.001b |
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 3,407 View
- 135 Download
- Related articles
-
Myelitis Presenting Anti-Yo Antibody in a Patient with Prostatic Adenocarcinoma2020 November;38(4)
Neurological Aspects of the Patient with Spasmodic Dysphonia1996 ;14(4)
Neurologic Manifestations in Patients with Hypereosinophilia1995 ;13(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Supplement1
Supplement1 Print
Print



