| J Korean Neurol Assoc > Volume 41(1); 2023 > Article |
|
뇌들보팽대에 발생하는 세포독성병터(cytotoxic lesions of the corpus callosum, CLOCC)는 뇌자기공명영상(magnetic resonance imaging, MRI)에서 급성기에 뇌들보팽대의 중앙에 국소난형으로 나타나며, 원인 교정 후 MRI를 추적하면 병터가 소실되는 것이 특징이다. 병터의 원인으로 감염, 항경련제복용, 대사장애, 뇌혈관질환 등에서 보고되었으나 병태생리는 명확하게 알려져 있지 않다. 임상양상은 발작, 착란, 섬망과 같은 가벼운 중추신경계 장애를 보이고 일반적으로 신경계증상이 시작된 후 한 달 이내에 후유증 없이 회복된다[1]. 저나트륨혈증으로 인해 뇌들보팽대에 CLOCC가 발생한 증례가 해외에서 보고된 바 있으나[2], 국내에서 보고된 경우는 없다. 저자들은 저나트륨혈증으로 발생한 뇌들보팽대병터 증례를 경험하여 보고한다.
35세 여자가 발작이 발생하여 응급실을 방문하였다. 몸이 왼쪽으로 돌아가면서 전신에 강직이 1분 정도 지속되었다. 발작이 멈춘 뒤 5분 정도 멍하게 있다가 의식이 호전되었다. 통풍 이외의 다른 과거력은 없으며, 발작도 이번이 처음이었다. 최근 과다한 업무로 스트레스가 많았고 수면 시간도 하루 4시간 이하로 부족한 상태였다. 체중 감량을 위해 다이어트 약을 복용 중이었고, 체중은 3개월 동안 10 kg 감소하였다. 그 외 복용 중인 다른 약은 없었다.
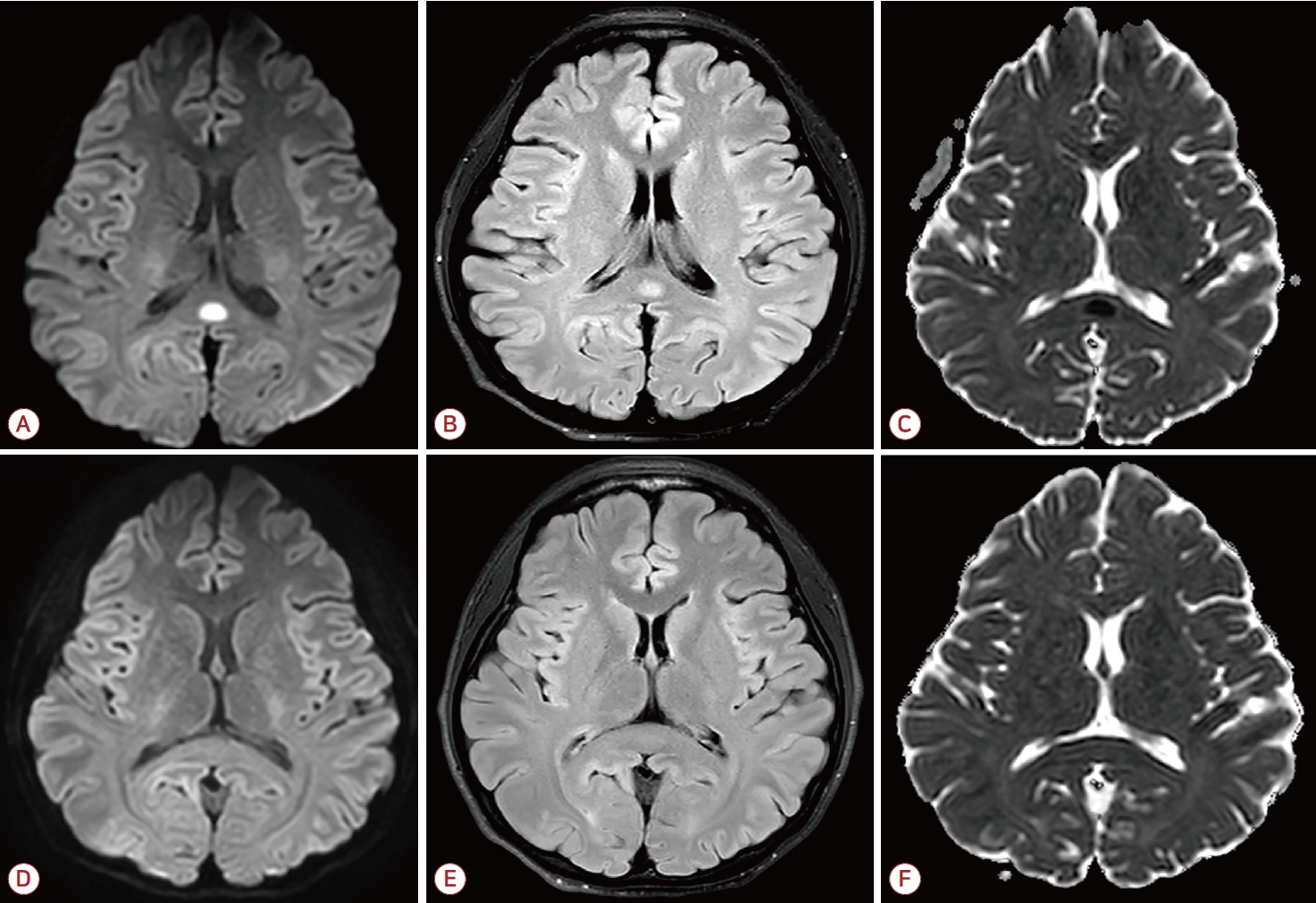
신체진찰에서 구강이 건조하고 피부긴장도가 감소해 있었다. 혈액검사에서 전해질 이상이 확인되었다. 혈청 나트륨과 칼륨이 각각 122.6 mmol/L, 2.0 mmol/L로 감소되어 있었고, 혈청 삼투압도 251 mOsm/kg로 감소되어 있었다. 소변 검사에서 삼투압은 64 mOsm/kg로 감소되어 있었고, 나트륨 농도 23.9 mmol/L, 칼륨 농도 2.4 mmol/L였다. 뇌 MRI는 확산강조영상(diffusion weighted imaging, DWI)과 액체감쇠역전회복영상(fluid attenuated inversion recovery, FLAIR)에서 뇌들보팽대에 고강도신호가 관찰되었다. 겉보기 확산계수지도(apparent diffusion coefficient map, ADC)는 같은 부위에 저강도신호를 보였다(Fig. A-C). 뇌파검사에서 뇌전증모양방전은 없었고, 뇌 전반에 걸쳐 서파가 관찰되었다. 뇌들보팽대병터가 중추신경계 감염으로 생긴 것인지를 확인하기 위해 뇌척수액검사를 시행하였으나 정상이었다. 뇌 MRI에서 관찰되는 뇌들보팽대병터가 저나트륨혈증으로 발생한 가역 병터로 생각되어 전해질 이상을 교정하고 4일 뒤 퇴원하였다. 다이어트 약을 복용하지 않도록 교육하였고, 이후 발작은 재발하지 않았다. 한 달 뒤 시행한 뇌 MRI에서 뇌들보팽대병터는 완전히 소실되었다(Fig. D-F).
본 증례에서는 저나트륨혈증으 로 인해 뇌들보팽대에 CLOCC가 발생하였다. 저자들은 체중 감량을 위해 복용한 다이어트 약이 저나트륨혈증을 유발하였을 것으로 생각한다. 혈액검사에서 저나트륨혈증과 저칼륨혈증이 함께 확인되었고, 혈청 삼투압도 감소해 있었다. 신체검사에서 구강건조와 피부긴장도 감소가 관찰되어 혈량 저하 상태가 의심되었다. 또한 소변 삼투압이 감소되어 있고 소변 나트륨 농도가 23.9 mmol/L로 확인되어 신장성 소실(renal loss)에 의한 저혈량 저나트륨혈증으로 판단하였다. 환자가 복용한 다이어트 약의 성분은 알 수 없었으나 다이어트 약에 이뇨제가 흔히 포함되어 있고 신장성 소실에 의한 저혈량저나트륨혈증이 이뇨제로 인해 발생하는 경우가 많은 점을 고려하였을 때 환자의 저나트륨혈증이 다이어트약에 포함된 이뇨제로 인해 발생하였을 가능성이 높다고 판단하였다.
뇌들보팽대의 CLOCC는 뇌전증 환자에서 종종 관찰되며 뇌전증 약의 중단과 관련되어 발생하는 경우가 가장 흔하다. 특히 카바마제핀(carbamazepine), 페니토인(phenytoin), 라모트리진(lamotrigine)의 중단으로 발생한 경우가 많은 것으로 보고된다. 이 외에도 감염뇌염, 저혈당증이나 고나트륨 혈증과 같은 대사질환, 고소뇌부종(high altitude cerebral edema), 항암 치료와 관련되어 발생한다[1]. 임상 증상은 비특이적이고 다양하게 나타난다. 발열이나 두통이 흔하게 나타나고, 인지장애, 행동 변화, 혼동, 발작, 의식 저하를 보일 수 있다[1]. 뇌 MRI에서 뇌들보팽대의 중앙 부분에 타원 모양의 병변을 보이는데, 특징적으로 T2강조영상, FLAIR, DWI에서 가역적인 고신호강도를 보이고, ADC에서 저신호강도를 보인다. T1강조영상에서는 고신호강도나 등신호강도를 보이고, 대부분의 경우 조영증강은 동반하지 않는다[3]. 대부분은 특별한 치료를 요하지 않으며 원인질환을 교정하면 임상 호전을 보인다. DWI와 FLAIR에서 관찰되는 가역적인 고신호강도는 2주 이내에 병변이 완전히 사라지거나 뚜렷한 감소를 보인다[1,3].
뇌들보팽대에 CLOCC가 발생하는 정확한 기전은 밝혀지지 않았고, 병터를 유발하는 원인에 따라 차이가 있을 수 있다. 뇌MRI의 DWI에서 고신호강도, ADC에서 저신호강도로 보이는 것은 세포독성부종(cytotoxic edema)과 관련된다. 저나트륨혈증 상태에서는 세포외기질의 글루탐산염 농도가 높아지고 이로 인해 세포독성부종이 발생한다[4,5]. 뇌들보팽대에는 뇌들보의 다른 부위에 비해 글루탐산염을 흡수하는 별아교세포(astrocyte)의 밀도가 높아 세포독성부종이 발생할 가능성이 높다[5,6]. 이에 더해 아쿠아포린(aquaporin)4수용체가 활성화 되면 별아교세포 내로 물이 이동하여 세포독성부종을 유발하는데 뇌들보팽대에는 아쿠아포린(aquaporin)4수용체의 밀도가 높아 뇌부종의 발생에 더욱 취약하게 되며, 뇌들보팽대에만 병변이 발생할 수 있다[4,6].
다양한 원인으로 인해 뇌들보팽대에 CLOCC가 발생할 수 있으나 본 증례에서는 저나트륨혈증으로 인해 유발되었을 것으로 생각한다. Takanashi 등7이 저나트륨혈증으로 뇌들보팽대에 CLOCC가 발생한 30명을 대상으로 측정한 혈청 나트륨의 농도는 131±4.1 mmol/L였다. 그리고 혈청 나트륨 농도 120-128 mmol/L에서 뇌들보팽대에 CLOCC가 발생한 보고도 있다[2]. 이러한 결과들을 볼 때 경도의 저나트륨혈증에서부터 뇌량들보에 CLOCC를 유발할 수 있는 것으로 생각된다. 발작도 뇌들보팽대에 CLOCC를 유발할 수 있으나 이전에 뇌전증을 진단받은 환자에서 발작 후 관찰되거나 뇌전증 약 감량과 관련되어 발생한 경우가 많다[1]. 본 증례의 경우 첫 발작이고 이전에 뇌전증 약을 복용한 병력이 없어 발작으로 인해 뇌들보팽대에 CLOCC가 발생하였을 가능성은 낮아 보인다. 그 외 알려진 원인들은 병력과 임상 소견, 혈액검사와 뇌척수액검사 등으로 배제하였다. 본 증례처럼 저나트륨혈증이 뇌들보팽대병터를 유발할 수 있으므로 뇌들보팽대병터의 원인 중 하나로 반드시 고려되어야 한다.
REFERENCES
3. Yuan J, Yang S, Wang S, Qin W, Yang L, Hu W. Mild encephalitis/ encephalopathy with reversible splenial lesion (MERS) in adults-a case report and literature review. BMC Neurol 2017;17:103.



4. Shi Z, Zhang W, Lu Y, Lu Y, Xu L, Fang Q, et al. Aquaporin 4-mediated glutamate-induced astrocyte swelling is partially mediated through metabotropic glutamate receptor 5 activation. Front Cell Neurosci 2017;11:116.



5. Belov Kirdajova D, Kriska J, Tureckova J, Anderova M. Ischemiatriggered glutamate excitotoxicity from the perspective of glial cells. Front Cell Neurosci 2020;14:51.



Figure.
Serial brain MRI of the patient. (A-C) The initial brain MRI. (A) Diffusion-weighted imaging, (B) fluid attenuated inversion recovery showed high signal intensity and (C) apparent diffusion coefficient map showed low signal intensity in the splenium of the corpus callosum. (D-F) The lesion disappeared in the brain MRI performed one month later. MRI; magnetic resonance imaging.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 182 View
- 5 Download
- Related articles
-
Reversible Lesion in Splenium of Corpus Callosum Following COVID-19 Vaccination2022 May;40(2)
Asymptomatic Agenesis of the Corpus Callosum Combined with Porencephalic Cyst2020 November;38(4)
Hypoxic Brain Damage with Restricted Diffusion in the Splenium of Corpus Callosum2016 November;34(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



