| J Korean Neurol Assoc > Volume 40(2); 2022 > Article |
|
Abstract
Immune checkpoint inhibitors may be associated with various adverse events, including encephalitis. Here, we report a case of encephalopathy associated with pembrolizumab therapy. A 60-year-old male diagnosed with cholangiocarcinoma with peritoneal seeding presented altered mentality and cognitive function after using pembrolizumab. Electroencephalogram showed mild diffuse cerebral dysfunction. Cerebrospinal fluid (CSF) study showed no evidence of infection or autoimmune disease and no paraneoplastic antibody was detected from CSF and serum. After high-dose methylprednisolone intravenous infusion, patient’s mentality was fully recovered.
면역관문억제제(immune checkpoint inhibitor)는 새로운 계열의 항암제로 종양에 대해 면역자극을 유발하여 항암 효과를 나타낸다. 면역관문억제제는 T세포 억제에 관여하는 면역관문단백질(immune checkpoint protein)의 활성을 차단함으로써, T세포를 활성화시켜 암세포를 공격하는 약제이다. 대표적인 면역관문억제제는 세포독성T림프구관련단백질4 (cytotoxic T-lymphocyte-associated protein 4, CTLA-4), 세포예정사단백질1 (programmed cell death protein 1, PD-1), 예정사리간드1 (programmed death-ligand 1)을 인식하는 항체를 사용한다[1]. 면역관문억제제는 기존의 항암제에 비해 부작용이 적고, 장기간 효과가 지속되는 특징을 가진다. 그러나 면역관문억제제 사용 후에는 부작용으로 길랭-바레증후군, 중증근무력증 등이 보고되었으며, 드물게는 횡단척수염, 자가면역뇌염이 보고되었다[2]. 저자들은 PD-1을 억제하는 면역관문억제제인 pembrolizumab 사용 후 발생한 자가면역뇌염을 스테로이드 치료로 호전된 증례를 경험하여 이에 보고하는 바이다.
60세 남자가 우측 옆구리 통증으로 병원을 방문하여, 간내 담관암종(cholangiocarcinoma)의 복막전이를 진단받고 2019년 7월 3일부터 gemcitabine 1,830 mg과 cisplatin 45.75 mg을 투약하기 시작하였으며, 11차 항암까지 진행하였다가 2020년 4월 14일 pembrolizumab 200 mg/일 투약을 시작하였다. 이후부터 보호자가 보기에 이전보다 인지기능이 다소 떨어져 보였으나 일상생활하는 데 어려움이 있는 정도는 아니었다. 2020년 5월 6일 두 번째 pembrolizumab 200 mg/일을 투약하였으며, 이틀 뒤인 2020년 5월 8일부터 보호자의 쉬운 말은 알아들으나 긴 문장은 알아듣지 못하고, 소변통에 대변을 보거나 의사가 본인을 때리려고 한다는 등 이치에 맞지 않는 행동과 말을 하는 등의 현저한 인지기능저하를 보이기 시작하였다. 그 외에는 국소신경계증상은 보이지 않았다. 이에 대한 평가와 치료를 위해 2020년 5월 13일 소화기내과로 입원하였으며, 병원 입원 후 3일째 신경과로 협의 진료가 의뢰되었다. 의뢰 당일 시행한 한국형간이정신상태검사(Korean mini-mental state examination, K-MMSE)는 30점 만점에 10점으로 시간, 장소에 대한 지남력저하, 계산능력저하 및 기억회상, 명령시행, 시공간구성 능력저하가 확인되었다. 또한 1단계의 간단한 명령수행은 가능하나 3단계 명령수행에는 어려움이 있고 심할 때에는 간단한 일상 대화도 이해하지 못하는 모습을 보였다.
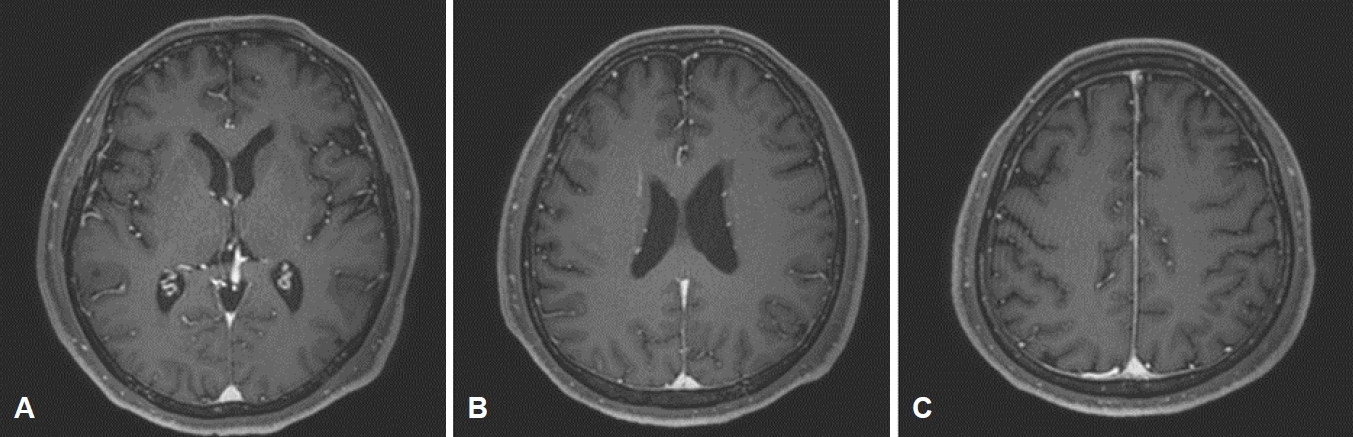
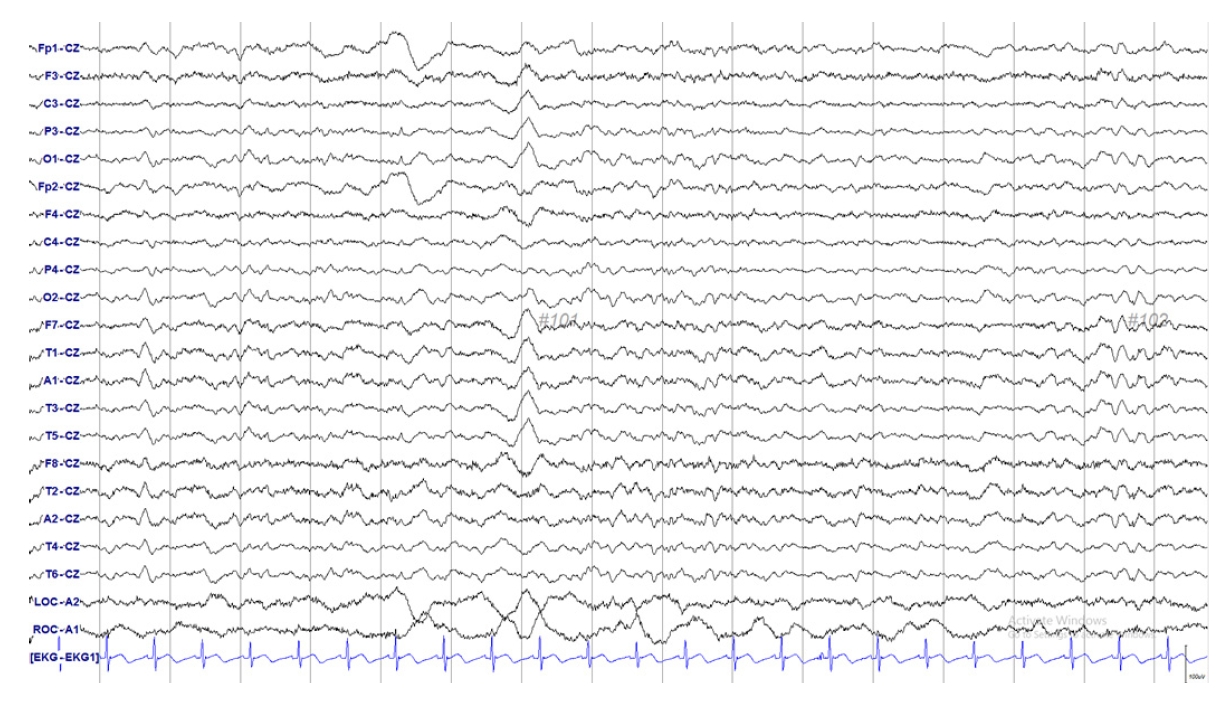
입원 당시 환자는 발열은 없었으며 가슴 X선과 소변검사에서 이상이 확인되지 않았고, 일반혈액검사에서 백혈구는 20,200/mm3 (중성구 80.5%, 림프구 8.4%, 단핵구 9.4%, 호산구 1.2%, 호염구 0.5%)로 증가가 관찰되었으나, 백혈구증가는 환자에서 2020년 3월 17일부터 지속적으로 관찰되었고, 세균검사에서 가래, 소변 및 혈액에서 동정된 세균은 없었고, 감염이 의심되는 증상도 없었다. 적혈구는 3.28×106/mm3, 혈색소는 9.1 g/dL로 이전 검사와 큰 차이가 없었다. 일반화학검사에서는 칼슘 11.6 mg/dL, 암모니아 45 μg/dL, 포도당 83 mg/dL, 소듐 139 mmol/dL, 포타슘 3.7 mmol/dL로 칼슘 수치는 정상 수치보다 1 mg/dL 높았으나 다음날 검사에서는 10.5 mg/dL로 정상이었다. 평가를 위해 2020년 5월 11일 외래에서 시행한 뇌 자기공명영상(magnetic resonance imaging, MRI)에서는 정상이었으며(Fig. 1), 입원 7일 후, 증상 발생 10일 후에 시행한 뇌파검사는 전반적인 배경리듬의 서파(slow background rhythm)가 관찰되었다(Fig. 2).
입원 4일째인 2020년 5월 15일 뇌척수액검사에서 개방압력은 155 mmCSF, 백혈구 3/mm3 (교정 백혈구 2/mm3), 적혈구 1,330/μL, 단백질 39.6 mg/dL, 포도당 47 mg/dL (혈청 포도당 88 mg/dL)이 관찰되었다. 신경계감염을 평가하기 위한 뇌척수액의 세균과 진균 배양검사, 크립토코쿠스(Cryptococcus)항원검사, 매독혈청검사(venereal disease research laboratory test), 거대세포바이러스(cytomegalovirus), 단순포진바이러스(herpes simplex virus, HSV), 수두대상포진바이러스(varicella zoster virus, VZV) IgM 항체검사, 1형 단순포진바이러스(HSV type 1), 2형 단순포진바이러스(HSV type 2), VZV, 폐렴사슬알균(Streptococcus pneumoniae), b형 인플루엔자균(Haemophilus influenzae type b), 나이세리아수막염균(Neisseria meningitidis), B군 사슬알균(group B streptococcus), 리스테리아모노사이토게네스(Listeria monocytogenes) 중합효소사슬반응(polymerase chain reaction, PCR)검사는 음성이었다. 마이코박테륨(Mycobacterium) 도말검사, 결핵균(Mycobacterium tuberculosis) PCR검사와 마이코박테륨(Mycobacterium) 배양검사, 마이코플라즈마(Mycoplasma) IgM 항체 역가(titer) 1:40 이하로 음성이었다. 뇌척수액 아데노신 아미노제거효소(adenosine deaminase)는 1.9 IU/L로 정상이었다. 신생물딸림항체검사인 항Hu, 항Yo, 항CV2, 항glial nuclear, 항amphiphysin, 항Ma2/Ta, 항Titin, 항Rec항체는 음성이었다. 자가면역 뇌염 평가를 위한 항N-methyl-D-aspartate receptors, leucine-rich glioma-inactivated 1, 항cotactin-associated protein 2, 항α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid, 항dipeptidyl-peptidase-like protein, 항감마아미노뷰티르산(gamma-aminobutyric acid) 수용체 항체검사에서도 모두 음성이었다.
이에 환자는 아급성으로 증상이 발생하고 pembrolizumab 투여 후 발생한 시간적 관계성으로 미루어 보아 pembrolizumab에 의한 자가면역뇌염이 의심되어, 입원 4일째인 2020년 5월 16일부터 5일간 메틸프레드니솔론(methylprednisolone)을 1 g/일로 정맥 투여를 시작하였고, 이후 경구로 스테로이드제인 프레드니솔론(prednisolone)을 60 mg/일로 시작하여 2주마다 10 mg씩 감량하여 투약하였다. 입원 6일째인 5월 18일부터는 이전과 같이 3단계 명령 수행이 가능한 모습이 확인되었으며, 입원 10일째인 5월 22일 시행한 K-MMSE는 30점 만점에 19점으로 계산능력저하, 기억회상저하를 보였으나 전반적인 인지기능이 호전되었다. 입원 18일째인 5월 30일에는 발병 이전과 비슷한 정도로 인지기능이 회복되었으며, 일상 대화가 가능하고 국소신경계이상이 없는 상태로 10개월 동안 본원에서 추적 관찰한 것을 확인하였다.
면역관문억제제인 pembrolizumab의 사용 후 다양한 면역관련 유해사례들(immune-related adverse events)이 보고되었다. 면역관련유해사례 중에서 신경계 증상으로는 다른 면역관문억제제와 유사하게 둘레뇌염(limbic encephalitis), 급성뇌병증(acute encephalopathy), 탈수초다발신경뿌리병(demyelinating polyradiculopathy)이 보고되었으며, 자가면역뇌염도 pembrolizumab 사용 이후 발생하는 드문 부작용이다[3-5]. 기존의 보고에서 전 세계적으로 약 10예의 자가면역뇌염이 보고되었다. 면역관문억제제 사용 후 발생한 자가면역뇌염에서 가장 흔한 증상은 인지기능저하, 기억력저하, 보행장애 등이 나타난다. 대부분 면역관문억제제 투여 후 4개월 이내에 약 60-80%에서 신경계 면역관련 유해사례가 나타나나, 투여 12개월 후에 인지기능저하가 나타난 증례도 보고되었다[5,6]. 이렇듯 다양하면서도 비특이적인 증상으로 인해, pembrolizumab 사용과 관련된 자가면역뇌염은 진단이 어려울 수도 있다.
자가면역뇌염은 임상특성과 검사 결과에 따라 확정(confirmed), 추정(probable) 그리고 가능(possible) 자가면역뇌염으로 분류한다. 확정 자가면역변연뇌염은 아급성의 기억력저하, 경련 또는 정신과적인 증상, MRI에서 양측 내측두엽의 이상, 뇌척수액검사의 이상 또는 뇌파에서 측두부 경련파가 있으며, 다른 원인을 배제한 경우에 진단된다[7]. 추정 자가면역뇌염은 아급성의 기억력저하, 경련 또는 정신과적인 증상과 함께, MRI에서 자가면역뇌염을 시사하고, 뇌척수액의 이상 그리고 뇌생검에서 뇌염 의심의 3가지 중 2가지 이상을 만족하고, 다른 원인을 배제한 경우에 진단된다. 가능 자가면역뇌염은 아급성의 기억력저하 또는 의식저하와 함께, 새로운 신경계이상, 기존의 질환으로 설명되지 않는 뇌전증, 뇌척수액이상 그리고 뇌염을 시사하는 MRI 등 4가지 중 2가지 이상을 만족하면서 다른 질환을 배제할 경우 진단할 수 있다. 환자는 3개월 내에 빠르게 진행하는 의식저하를 보이면서, 새로운 신경계이상을 보이고 있어 가능 자가면역뇌염에 해당하여, 자가면역뇌염 가능성이 있다고 할 수 있다.
본 환자의 경우 신생물딸림신경계증후군(paraneoplastic neurologic syndrome, PNS)에 의한 증상 발생 가능성도 고려할 수 있으나, 신생물딸림신경계증후군 위험을 평가하는 신생물딸림신경계증후군관리점수(PNS-Care Score)가 4점으로 인지기능저하와 종양이 있다는 것 이외에는 신생물딸림신경계증후군을 시사하는 요소가 명확하지 않았다[8]. 아울러 담관암종은 PNS의 발생률이 낮은 점, 스테로이드 투여 후 치료 효과가 우수하고, 장기간 효과를 보인 점도 담관암종관련 신생물딸림신경계증후군보다는 pembrolizumab 사용 후 발생한 자가면역뇌염이 더 합당한 것으로 판단된다.
면역관문억제제에 의한 신경계 면역관련 유해사례의 기전은 확실하지 않으나, 면역세포의 과다활동으로 인한 면역내성의 붕괴로 인해 면역관문억제제가 자가면역질환 악화를 유발되는 것에 의한 것으로 추정되며, PD-1, CTLA-4 면역관문억제제에 의한 항원 생성이 자극되는 것이 원인이 되는 것으로 생각된다[7].
본 증례에서는 환자의 뇌척수액세포검사(CSF cytology)로 연수막파종(leptomeningeal seeding) 여부를 확인하지 않은 제한점이 있다. 연수막파종은 뇌수막에 암세포가 전이되며 다양한 신경증상을 나타내는데 흔히 동반되는 증상으로는 두통, 의식저하, 외안근마비, 복시, 뇌전증, 수두증, 하지근력저하 등이 있다. 연수막파종도 전신 스테로이드 치료에 일부 효과가 있으나 오래 지속되지 않는다. 본 환자의 원발암인 담관암종은 연수막파종을 잘 유발하지 않으며, 환자에서 연수막파종의 흔한 증상인 두통, 하지근력마비, 외안근마비 등의 증상이 관찰되지 않았다. 또한 조영증강 뇌 자기공명영상에서 연수막파종의 증거가 관찰되지 않았고, 뇌척수액검사가 정상이며, 스테로이드 효과가 장기간 지속되는 점으로 보아 연수막파종의 가능성은 크지 않다고 할 수 있다. 그러나 본 환자와 같이 진행된 종양 환자에서는 신경계이상이 나타나는 경우에는 연수막파종의 가능성이 있으므로 향후에는 뇌척수액세포검사를 시행하는 것이 적절할 것으로 생각된다[9].
본 환자에서는 엡스타인-바바이러스(Epstein-Barr virus, EBV)에 대한 검사를 진행하지 않았다. EBV는 뇌염의 드문 원인 병원체로, EBV뇌염은 두통, 경련, 발열이 66%, 48%, 18%에서 발생하며, 뇌척수액검사에서 백혈구 증가가 81%에서 보고되었다. MRI 이상이 71%에서 나타나며, 주로 뇌줄기, 소뇌, 시상, 바닥핵, 시신경에서 병변이 관찰된다. 아울러 HSV, 마이코플라즈마(Mycoplasma) 등의 다른 병원체와 같이 감염되는 경우가 흔하다[10]. 본 환자에서는 두통, 경련, 발열이 나타나지 않았으며, MRI와 뇌척수액검사도 정상이었다. 신경계증상도 인지기능저하 이외에는 뇌줄기, 소뇌, 시상, 바닥핵, 시신경의 이상을 시사하는 증상도 없었다. 따라서 환자는 EBV뇌염의 가능성은 적다고 할 수 있다. 그러나 향후 뇌염의 평가에서는 EBV에 의한 가능성을 평가하기 위해, EBV에 대한 검사를 진행하여야 할 것이다.
효과적이면서 지속적인 치료 효과로 인해 항암 치료에서 면역관문억제제 사용은 증가할 것으로 예상되며, 이에 따라 자가면역뇌염을 포함한 신경계 면역관련 유해사례도 늘어날 것으로 예상된다. 이에 저자들은 면역관문억제제인 pembrolizumab 사용 후 발생한 자가면역뇌염의 가능성이 있는 환자가 스테로이드 치료 후 호전되어 이에 보고하는 바이다.
REFERENCES
1. Darvin P, Toor SM, Sasidharan Nair V, Elkord E. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med 2018;50:1-11.

2. Cuzzubbo S, Javeri F, Tissier M, Roumi A, Barlog C, Doridam J, et al. Neurological adverse events associated with immune checkpoint inhibitors: review of the literature. Eur J Cancer 2017;73:1-8.


3. Feng S, Coward J, McCaffrey E, Coucher J, Kalokerinos P, O'Byrne K. Pembrolizumab-induced encephalopathy: a review of neurological toxicities with immune checkpoint inhibitors. J Thorac Oncol 2017;12:1626-1635.


4. Schneider S, Potthast S, Komminoth P, Schwegler G, Bohm S. PD-1 checkpoint inhibitor associated autoimmune encephalitis. Case Rep Oncol 2017;10:473-478.



5. Spain L, Walls G, Julve M, O'Meara K, Schmid T, Kalaitzaki E, et al. Neurotoxicity from immune-checkpoint inhibition in the treatment of melanoma: a single centre experience and review of the literature. Ann Oncol 2017;28:377-385.


6. Zimmer L, Goldinger SM, Hofmann L, Loquai C, Ugurel S, Thomas I, et al. Neurological, respiratory, musculoskeletal, cardiac and ocular side-effects of anti-PD-1 therapy. Eur J Cancer 2016;60:210-225.


7. Graus F, Titulaer MJ, Balu R, Benseler S, Bien CG, Cellucci T, et al. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol 2016;15:391-404.



8. Graus F, Vogrig A, Muniz-Castrillo S, Antoine JG, Desestret V, Dubey D, et al. Updated diagnostic criteria for paraneoplastic neurologic syndromes. Neurol Neuroimmunol Neuroinflamm 2021;8:e1014.



Figure 1.
(A-C) Brain magnetic resonance imaging (MRI) of the patient. T1 Gadolinium enhanced MRI showed no evidence of brain metastasis or enhancing lesion. No other ischemic lesion, hemorrhage, hydrocephalus, mass or atrophic change is noted in cerebral hemisphere, cerebellum, brainstem and ventricle.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,166 View
- 67 Download
- Related articles
-
Acute Necrotizing Encephalopathy Associated with COVID-192024 February;42(1)
Multiple Cerebral infarction Associated with Heat Stroke2022 February;40(1)
Anti-LGI-1 Encephalitis with Worsening Symptoms Associated with Hyponatremia2020 November;38(4)
Anti-LGI1 Antibody Limbic Encephalitis Associated with Hepatocellular Carcinoma2020 November;38(4)
Autoimmune Encephalitis Associated with Thymoma2019 February;37(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print