| J Korean Neurol Assoc > Volume 42(4); 2024 > Article |
|
Abstract
Background
Patients with ischemic stroke may experience early neurological deterioration (END) during the acute phase. This study aimed to identify association between asymptomatic vascular stenosis and END in single subcortical infarction patients.
Methods
The study included 562 patients admitted within 48 hours of symptom onset between January 2015 and August 2022. END was defined as a decrease of ≥1 point in the National Institutes of Health stroke scale (NIHSS) motor score or ≥2 points in the total NIHSS score within the first 48 hours after stroke onset. Clinical characteristics, including age, sex, smoking habits, underlying vascular risk factors, initial NIHSS score, trial of Org 10172 in acute stroke treatment classification, laboratory parameters, and presence of vascular stenosis or occlusion, were analyzed to identify predictors of END.
Results
END occurred in 115 patients (20%) with single subcortical infarction. Age (odds ratio [OR], 1.0; p=0.011), female sex (OR, 1.7; p=0.042), location of cerebral infarction at corona radiata (OR, 3.0; p=0.023), systolic blood pressure (OR, 1.0; p=0.011) and presence of asymptomatic vascular stenosis (OR, 2.2; p=0.019) were independently associated with END in multivariable logistic regression.
뇌경색은 고령에서 장애를 일으키는 가장 중요한 원인 중 하나이다[1,2]. 뇌혈관의 폐색으로 뇌손상이 발생하면 초기에 뇌병변의 확장, 부종 및 재발에 의해 증상이 더욱 악화될 수 있는데 이를 조기 신경계 악화라고 한다[3,4]. 일반적으로 조기 신경계 악화는 증상 발생 이후 72시간 또는 7일 이내 증상의 악화나 재발을 의미한다[4]. 조기 신경계 악화는 전체 허혈뇌졸중 환자에서 20-40%까지 발생하는 것으로 보고되고 있으며 조기 신경계 악화가 발생하면 기능적인 예후의 악화와 연관될 수 있다고 알려져 있다[5-7].
피질하경색 및 열공뇌경색은 큰혈관죽상경화증이나 심장성색전증에 의해 발생하는 뇌경색보다 상대적으로 증상이 경미하며 기능적인 예후가 좋다고 알려져 있다[8]. 피질하경색 및 열공뇌경색에서도 운동신경을 포함하는 피질척수로가 침범되면 운동 약화가 발생할 수 있다[9]. 피질척수로가 침범된다면 피질하경색이 뇌경색의 크기와 무관하게 장기적으로 운동 약화로 인한 기능장애를 유발할 수 있으며 발생 당시 운동 약화가 없었더라도 병변의 확장이나 부종 등으로 피질척수로를 침범하게 되면 조기 신경계 악화를 유발할 수 있다[10].
조기 신경계 악화가 발생하는 원인은 다양하고 이를 예측하기 위한 많은 연구들이 있어 왔다. 특히 근위부 혈관의 협착 혹은 폐색이 조기 신경계 악화와 연관되어 있음이 보고되었다[4,11]. 그 외에 고령, 당뇨와 같은 임상 변수가 조기 신경계 악화와 연관되어 있음이 보고되었다[12]. 단일피질하경색에서 20-43%까지 조기 신경계 악화가 발생한다[11,13,14]. 단일피질하경색의 조기 신경계 악화와 관련된 뇌영상 소견에 대한 연구들이 있으며 병변의 크기, 위치 그리고 모동맥과 뇌경색의 병변의 위치 관계가 조기 신경계 악화와 연관이 있음이 보고되었다[11,15]. 이외에도 백혈구와 림프구의 비율 등과 같은 임상 변수가 조기 신경계 악화와 연관이 있다[16,17]. 그러나 단일피질하경색 환자들에서 무증상 혈관 협착과 조기 신경계 악화와의 연관성을 보고한 논문은 많지 않다. 이에 저자들은 국내 환자들을 대상으로 피질하경색 환자들에서 다양한 임상 변수와 뇌영상 소견을 분석함으로써 무증상 혈관 협착이 조기 신경계 악화에 미치는 영향을 연구하고자 하였다.
본 연구는 전향적으로 수집된 뇌졸중 등록 체계(registry)에 입력된 자료를 이용한 후향적 분석 연구이며 전남대학교병원 생명의학연구윤리심의위원회의 승인을 받았다(IRB No. CNUH-2023-242). 이 연구는 전자의무기록을 기반으로 자료를 수집하였으며 본 뇌졸중 등록 체계에 환자 등록 시 모든 환자에서 서면 동의를 취득하였다.
본 연구는 2015년 1월부터 2022년 8월까지 전남대학교병원에 급성기 뇌경색으로 입원한 환자들을 대상으로 하였다. 연구의 포함 기준 및 제외 기준은 다음과 같다(Fig. 1). 1) 18세 이상, 2) 증상 발생 이후 48시간 이내에 입원한 환자, 3) 단일뇌경색 병변을 가지며 병변은 기저핵 그리고/혹은 대뇌부챗살이거나 내포의 뒷다리 부분에 위치, 4) 초기 NIH뇌졸중척도(National Institutes of Health stroke scale, NIHSS)가 0점에서 4점 사이였다. 제외 기준은 1) 정맥내혈전용해술 혹은 기계적혈전제거술을 시행받은 환자, 2) 뇌경색의 병인이 심인성인 환자, 3) 후순환계에 병변이 있는 환자, 4) 금기증으로 인해 뇌자기공명영상(magnetic resonance imaging, MRI)을 시행하지 않은 환자였다. 입원한 모든 환자는 뇌졸중 진료 지침 및 원내 프로토콜에 따라 최선의 약물 치료를 시행하였다.
환자들의 정보는 전향적으로 입력한 뇌졸중 등록 체계에서 환자들의 나이, 성별, 흡연력, 처음 내원 시의 NIHSS, 입원 시 발생한 뇌경색의 the trial of Org 10172 in acute stroke treatment (TOAST) 분류 및 응급실 내원 당시의 수축기/이완기혈압 및 혈당에 대한 정보를 후향적으로 수집하였다[18]. 또한 환자의 기저질환에 대한 정보 중 고혈압, 당뇨병, 이상지질혈증의 유무에 대한 정보를 수집하였다. 그리고 내원 당일 혹은 다음날에 검사한 환자의 저밀도지단백콜레스테롤, 중성지방, 당화혈색소에 대한 정보를 수집하였다. TOAST 분류는 MRI-based algorithm for acute ischemic stroke subtype classification에 따라서 분류하였다[19].
뇌경색은 응급실 내원 당일 확산강조영상을 통해서 진단하였다. 또한 time of flight (TOF) magnetic resonance angiography (MRA)를 통해서 혈관 협착의 유무를 확인하였고 협착이 존재하면 혈관 협착의 위치에 대한 정보를 수집하였다. 뇌경색의 병변과 연관되는 것으로 판단되는 혈관의 협착을 증상 혈관 협착으로 정의하였으며 그 외 병변과 무관한 병변의 반대측 내경동맥을 포함하여 두개내혈관의 협착이 있는 경우를 무증상 혈관 협착으로 정의하였다(Fig. 2). 혈관 협착의 정도는 warfarin-aspirin symptomatic intracranial disease study trial을 기반으로 평가하였으나 혈관 협착의 정도와 무관하게 근위부 증상 혈관 협착으로 평가하였다[15,16,20-22]. 재원 도중 환자의 신경계 증상이 악화된 경우에는 바로 확산강조영상을 시행하였으나 이에 대한 자료는 수집하지 않았다.
연구에 포함된 환자들을 신경계 증상 악화군과 비악화군으로 분류하여 임상적인 특성을 분석하였다. 범주형 변수의 비교에는 카이제곱검정(chi-square test)을 이용하였고 연속형 변수의 비교에는 스튜던트 티-검정(Student’s t-test)을 Shapiro-Wilk test를 통해 데이터의 정규성 검정 이후 이용하였다. 조기 신경계 악화와 연관된 요소를 분석하기 위해 로지스틱 회귀 분석을 이용하여 이변량 분석 및 다변수 분석을 시행하였다. 다변수 분석에 이용한 보정변수는 이변량 분석에서 통계적 유의 수준이 0.2 미만인 변수로 결정하였다. 보정변수는 나이, 성별, 흡연력, 고혈압, 당뇨, TOAST 분류, 내원 당시의 수축기혈압 및 뇌경색의 병변이다.
혈관 협착 및 폐색의 존재가 조기 신경계 악화와 관련되는지 확인하기 위하여 환자군을 혈관의 협착 혹은 폐색의 유무에 따라 분류하였다. 또한 증상 협착과 무증상 협착의 조기 신경계 악화와의 관련성을 확인하기 위하여 혈관의 협착 및 폐색을 증상 혈관 협착 혹은 폐색만 존재, 무증상 혈관 협착 혹은 폐색만 존재, 증상과 무증상 혈관 협착 혹은 폐색이 동시에 존재하는 군으로 분류하여 분석을 진행하였다. 통계적 유의 수준은 양측 검정하 p<0.05로 하였고 통계 분석에는 Stata/SE 16.1 (StataCorp LLC, College Station, TX, USA)을 사용하였다.
등록된 환자는 총 562명이었으며 조기 신경계 악화는 115명(20%)에서 발생하였다. 등록된 모든 환자는 48시간 동안 관찰이 이루어졌으며 48시간 이내 퇴원 혹은 사망한 환자는 없었다. 조기 신경계 비악화군과 악화군의 일반적인 특성은 Table 1에 제시하였다. 조기 신경계 비악화군과 악화군의 평균 연령은 각각 65.5±13.1세, 70.9±11.4세였다(p<0.001). 성별은 남성이 49명(42.6%), 여성이 66명(57.4%)으로 유의한 차이가 있었다(p<0.001). 또한 비흡연자 및 금연 이후 5년 이상 지난 환자의 비율이 신경계 악화군에서 유의하게 더 높았다(p=0.014). 혈압, 당뇨, 이상지질혈증과 같은 환자의 기저질환, 초기 NIHSS, 저밀도 지단백콜레스테롤, 중성지방, 수축기/이완기혈압, 혈당, 당화혈색소 그리고 뇌경색 병변의 위치는 두 그룹 간에 통계학적으로 유의한 차이가 없었다(Table 1).
조기 신경계 악화에 대한 이변량 분석에서는 나이(odds ratio [OR] [95% confidence interval (CI)], 1.0 [1.0-1.1]) 및 여성 (OR [95% CI], 2.1 [1.4-3.2])이 조기 신경계 악화와 연관이 있었다. 금연 이후 5년 이내인 환자가(OR [95% CI], 0.4 [0.2-0.8]) 조기 신경계 악화의 연관성이 유의하게 낮았다. 병변의 위치 중 대뇌부챗살(OR [95% CI], 2.3 [1.2-7.4])이 통계적으로 유의하게 조기 신경계 악화와 관련되어 있었다(Table 2).
다변수 분석에서는 나이(OR [95% CI], 1.0 [1.0-1.0]), 여성(OR [95% CI], 1.7 [1.0-2.9]), 응급실 내원 당시의 수축기혈압(OR [95% CI], 1.0 [1.0-1.0]) 뇌경색의 병변이 대뇌부챗살에 위치한 경우(OR [95% CI], 3.0 [1.1-7.9])가 신경계 악화에 독립적으로 영향을 주는 변수로 남았다(Table 3).
신경계 악화군에서 혈관 협착이 없음은 44명(38.3%), 증상 협착 혹은 폐색은 20명(17.4%), 무증상 협착 혹은 폐색은 22명(19.1%), 증상과 무증상 협착 혹은 폐색이 동시에 존재하는 경우는 29명(25.2%)이었다. 신경계 악화군에서 비악화군에 비해 무증상 혈관 협착 혹은 폐색 및 증상과 무증상 협착 혹은 폐색이 존재하는 환자의 수가 더 많았다(p=0.002) (Table 4).
조기 신경계 악화와 혈관 협착의 관련성은 이변량 분석에서 무증상 협착 혹은 폐색(OR [95% CI], 2.6 [1.4-4.7]) 및 증상, 무증상 협착 혹은 폐색이 동시에 존재하는 경우(OR [95% CI], 2.2 [1.3-3.8])가 조기 신경계 악화와 관련성을 보였다. 하지만 다변수 분석에서는 무증상 혈관 협착 혹은 폐색이 조기 신경계 악화의 위험을 증가시키는 요인이었으나(OR [95% CI], 2.2 [1.1-4.0]) 증상, 무증상 혈관 협착 혹은 폐색이 동시에 존재하는 환자는 통계적으로 유의하지 않았다(OR [95% CI], 1.5 [0.8-2.9]) (Table 5).
본 연구는 국내 환자를 대상으로 여러 임상 변수 및 뇌영상 소견 그리고 무증상 혈관 협착이 단일피질하경색 환자에서 조기 신경계 악화와 연관이 있는지 알아보고자 하였다. 본 연구의 주안점은 첫째, 나이 및 성별(여성) 그리고 뇌경색의 병변이 대뇌부챗살인 경우에 단일피질하경색 환자에서 조기 신경계 악화와 연관이 있다. 둘째, 단일피질하경색 환자에서 혈관 협착의 경우 무증상 혈관 협착이 조기 신경계 악화와 독립적으로 영향을 미치는 위험 요인이다. 셋째, 본 연구에서 증상 혈관 협착은 조기 신경계 악화와 유의한 차이를 보이지 않았다는 것이다.
이전의 연구에서 근위부의 증상 혈관 협착이 조기 신경계 악화와 연관이 있음이 보고되었다[11,26]. 다만 본 연구에서는 근위부 증상 혈관 협착과 조기 신경계 악화의 통계적 유의성이 보이지 않았다. 이는 등록된 환자 간의 뇌경색의 병인이 다르기 때문인 것으로 생각된다[15]. 이전의 연구에서 모동맥의 협착이 있는 경우 관통동맥 입구의 가지죽종이 뇌경색의 발생에 영향을 미친다고 보고되었으며 이러한 가지죽종의 변화가 조기 신경계 악화에 영향을 미친다[16]. 모동맥의 협착이 없는 경우 관통동맥의 지질유리질화로 인해 뇌경색이 발생하는 것으로 보고되었다[16,27]. 지질유리질화는 만성적이며 안정적인 특징을 가져 상대적으로 조기 신경계 악화가 덜 발생한다고 알려져 있다[15,28]. 본 연구에서는 뇌경색의 병인과 무관하게 뇌경색 병변의 위치에 따라 환자를 등록하였기에 증상 혈관 협착이 조기 신경계 악화에 미치는 영향이 기존 보고들과 달랐던 것으로 생각된다. 또한 본 연구에서 MRA를 통해 혈관 협착을 진단하였는데 기존의 연구에서 MRA를 통해 중대뇌동맥의 가지죽종질환을 진단하는 것에 한계가 있음이 보고된 바 있다[29-31]. 따라서 실제로 중대뇌동맥의 협착이 있는 환자가 진단된 환자보다 더 많을 수 있어 증상 혈관 협착의 영향이 과소평가되었을 가능성이 있다.
또한 기존의 연구에서 고혈압, 당뇨병력과 같은 기저질환이 조기 신경계 악화와 연관이 있음이 밝혀졌으나 본 연구에서는 통계적 유의성을 보이지 않았다[16,32]. 이전 보고에서 뇌경색의 병인에 따라서 영향을 미치는 기저 요인이 다름이 밝혀졌으며 또한 뇌경색의 병인에 따라서 조기 신경계 악화에 영향을 미치는 요인 역시 다르다고 알려져 있다[33,34]. 이로 인해 환자들의 뇌경색 병인의 차이로 인해 이러한 기저질환이 조기 신경계 악화와 통계적 유의성을 보이지 않은 것으로 생각된다.
본 연구에서 무증상 혈관 협착이 조기 신경계 악화와 독립적으로 영향을 미치는 위험 요인으로, 통계적으로 유의성을 보였다. 이는 기존의 연구 결과들과 유사한 점을 보인다[16,27]. 두개내 혈관의 협착은 대뇌의 소혈관질환과 연관이 있음이 알려져 있다[35-39]. 또한 소혈관질환의 정도가 단일피질하경색 환자에서 조기 신경계 악화와의 연관성이 보고된 바 있다[14,40-42]. 따라서 무증상 혈관 협착 혹은 폐색이 있는 환자군은 혈관 협착이 없는 환자군에 비해서 전반적인 소혈관질환 및 동맥경화의 정도가 높을 것으로 생각되며 이로 인해 허혈 부위가 급성기 뇌경색의 진행에 취약할 수 있다[14]. 이는 통계적 유의성은 보이지 않으나 본 논문에서 증상과 무증상 혈관 협착 혹은 폐색이 동시에 존재하는 환자군도 조기 신경계 악화에 취약한 경향성을 보인 것이 뒷받침한다.
본 연구에서는 몇 가지 제한점이 있다. 첫째, 연구가 후향적이다. 둘째, 뇌경색의 병인이 통제되지 않았다. 셋째, 혈관 협착의 개수 및 정도 그리고 무증상 혈관 협착의 위치에 대한 정보를 수집 및 분석하지 않았다. 넷째, 증상 및 무증상 혈관 협착의 정도에 따른 조기 신경계 악화와의 연관성을 분석하지 않았다. 다섯째, 조기 신경계 악화 이후의 확산강조영상을 시행하였으나 이에 대하여 수집 및 분석하지 않았다. 추후 뇌경색의 병인을 통일하고 이에 따라 무증상 혈관 협착 위치, 개수 및 정도 등을 포함하여 전향적인 연구를 한다면 본 연구 결과를 좀 더 정확하게 검증할 수 있을 것이다.
결론적으로 단일피질하경색 환자에서 조기 신경계 악화를 예측할 수 있는 임상 지표는 나이, 여성 그리고 뇌경색의 병변이 대뇌부챗살인 경우와 무증상 혈관 협착이었다. 따라서 이러한 특징을 가진 환자에서 신경계 악화의 가능성을 예상하고 대비함으로써 환자의 장기적인 예후를 개선시킬 수 있을 것이다.
REFERENCES
1. Zhou M, Wang H, Zeng X, Yin P, Zhu J, Chen W, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2019;394:1145-1158.



2. Siegler JE, Martin-Schild S. Early neurological deterioration (END) after stroke: the END depends on the definition. Int J Stroke 2011;6:211-212.


3. Thanvi B, Treadwell S, Robinson T. Early neurological deterioration in acute ischaemic stroke: predictors, mechanisms and management. Postgrad Med J 2008;84:412-417.


4. Tei H, Uchiyama S, Ohara K, Kobayashi M, Uchiyama Y, Fukuzawa M. Deteriorating ischemic stroke in 4 clinical categories classified by the Oxfordshire Community Stroke Project. Stroke 2000;31:2049-2054.


5. Vynckier J, Maamari B, Grunder L, Goeldlin MB, Meinel TR, Kaesmacher J, et al. Early neurologic deterioration in lacunar stroke: clinical and imaging predictors and association with long-term outcome. Neurology 2021;97:e1437-e1446.

6. Rankin J. Cerebral vascular accidents in patients over the age of 60. II. Prognosis. Scott Med J 1957;2:200-215.


7. Liu P, Liu S, Feng N, Wang Y, Gao Y, Wu J. Association between neurological deterioration and outcomes in patients with stroke. Ann Transl Med 2020;8:4.



10. Del Bene A, Palumbo V, Lamassa M, Saia V, Piccardi B, Inzitari D. Progressive lacunar stroke: review of mechanisms, prognostic features, and putative treatments. Int J Stroke 2012;7:321-329.


11. Jeong HG, Kim BJ, Yang MH, Han MK, Bae HJ. Neuroimaging markers for early neurologic deterioration in single small subcortical infarction. Stroke 2015;46:687-691.


12. Seners P, Turc G, Oppenheim C, Baron JC. Incidence, causes and predictors of neurological deterioration occurring within 24 h following acute ischaemic stroke: a systematic review with pathophysiological implications. J Neurol Neurosurg Psychiatry 2015;86:87-94.


13. Kim JP, Kim SJ, Lee JJ, Cha JH, Bang OY, Chung CS, et al. Diffusion-perfusion mismatch in single subcortical infarction: a predictor of early neurological deterioration and poor functional outcome. Eur Neurol 2015;73:353-359.


14. Jiang J, Huang X, Zhang Y, Deng W, Shen F, Liu J. Total MRI burden of cerebral vessel disease correlates with the progression in patients with acute single small subcortical strokes. Brain Behav 2019;9:e01173.



15. Nam KW, Kwon HM, Lee YS. Different predictive factors for early neurological deterioration based on the location of single subcortical infarction: early prognosis in single subcortical infarction. Stroke 2021;52:3191-3198.


16. Yang Y, He Y, Han W, Xu J, Cai Z, Zhao T, et al. Clinical factors associated with functional outcomes in patients with single subcortical infarction with neurological deterioration. Front Neurol 2023;14:1129503.



17. Fang L, Wang Y, Zhang H, Jiang L, Jin X, Gu Y, et al. The neutrophil-to-lymphocyte ratio is an important indicator correlated to early neurological deterioration in single subcortical infarct patients with diabetes. Front Neurol 2022;13:940691.



18. Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment. Stroke 1993;24:35-41.


19. Ko Y, Lee S, Chung JW, Han MK, Park JM, Kang K, et al. MRI-based algorithm for acute ischemic stroke subtype classification. J Stroke 2014;16:161-172.



20. Nah HW, Kang DW, Kwon SU, Kim JS. Diversity of single small subcortical infarctions according to infarct location and parent artery disease: analysis of indicators for small vessel disease and atherosclerosis. Stroke 2010;41:2822-2827.


21. Samuels OB, Joseph GJ, Lynn MJ, Smith HA, Chimowitz MI. A standardized method for measuring intracranial arterial stenosis. AJNR Am J Neuroradiol 2000;21:643-646.


22. Chimowitz MI, Kokkinos J, Strong J, Brown MB, Levine SR, Silliman S, et al. The warfarin-aspirin symptomatic intracranial disease study. Neurology 1995;45:1488-1493.


23. Liu H, Liu K, Zhang K, Zong C, Yang H, Li Y, et al. Early neurological deterioration in patients with acute ischemic stroke: a prospective multicenter cohort study. Ther Adv Neurol Disord 2023;16:17562864221147743.



24. Weimar C, Mieck T, Buchthal J, Ehrenfeld CE, Schmid E, Diener HC. Neurologic worsening during the acute phase of ischemic stroke. Arch Neurol 2005;62:393-397.


25. DeGraba TJ, Hallenbeck JM, Pettigrew KD, Dutka AJ, Kelly BJ. Progression in acute stroke: value of the initial NIH stroke scale score on patient stratification in future trials. Stroke 1999;30:1208-1212.


26. Petrone L, Nannoni S, Del Bene A, Palumbo V, Inzitari D. Branch atheromatous disease: a clinically meaningful, yet unproven concept. Cerebrovasc Dis 2016;41:87-95.


27. Han XJ. Relationship between lesion patterns of single small infarct and early neurological deterioration in the perforating territory. Eur Rev Med Pharmacol Sci 2017;21:3642-3648.

28. Wardlaw JM, Smith EE, Biessels GJ, Cordonnier C, Fazekas F, Frayne R, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol 2013;12:822-838.



29. Yamamoto Y, Ohara T, Hamanaka M, Hosomi A, Tamura A, Akiguchi I. Characteristics of intracranial branch atheromatous disease and its association with progressive motor deficits. J Neurol Sci 2011;304:78-82.


30. Nakase T, Yoshioka S, Sasaki M, Suzuki A. Clinical evaluation of lacunar infarction and branch atheromatous disease. J Stroke Cerebrovasc Dis 2013;22:406-412.


31. Song YM. Predictors for early neurological deterioration in lacunar infarction. J Korean Neurol Assoc 2015;33:272-277.

32. Jin D, Yang J, Zhu H, Wu Y, Liu H, Wang Q, et al. Risk factors for early neurologic deterioration in single small subcortical infarction without carrier artery stenosis: predictors at the early stage. BMC Neurol 2023;23:83.



33. Yamamoto H, Bogousslavsky J, van Melle G. Different predictors of neurological worsening in different causes of stroke. Arch Neurol 1998;55:481-486.


34. Lv P, Jin H, Liu Y, Cui W, Peng Q, Liu R, et al. Comparison of risk factor between lacunar stroke and large artery atherosclerosis stroke: a cross-sectional study in China. PLoS One 2016;11:e0149605.



35. Kwon HM, Lynn MJ, Turan TN, Derdeyn CP, Fiorella D, Lane BF, et al. Frequency, risk factors, and outcome of coexistent small vessel disease and intracranial arterial stenosis: results from the stenting and aggressive medical management for preventing recurrent stroke in intracranial stenosis (SAMMPRIS) trial. JAMA Neurol 2016;73:36-42.



36. Zhai FF, Yan S, Li ML, Han F, Wang Q, Zhou LX, et al. Intracranial arterial dolichoectasia and stenosis: risk factors and relation to cerebral small vessel disease. Stroke 2018;49:1135-1140.


37. Zhai FF, Yang M, Wei Y, Wang M, Gui Y, Han F, et al. Carotid atherosclerosis, dilation, and stiffness relate to cerebral small vessel disease. Neurology 2020;94:e1811-e1819.


38. Khan U, Porteous L, Hassan A, Markus HS. Risk factor profile of cerebral small vessel disease and its subtypes. J Neurol Neurosurg Psychiatry 2007;78:702-706.



39. Del Brutto OH, Mera RM, Del Brutto VJ, Hill JP, Torpey AP, Peralta LD, et al. Cerebral small vessel disease score and atherosclerosis burden - a population study in community-dwelling older adults. Clin Neurol Neurosurg 2020;194:105795.


40. Feng C, Tan Y, Wu YF, Xu Y, Hua T, Huang J, et al. Leukoaraiosis correlates with the neurologic deterioration after small subcortical infarction. J Stroke Cerebrovasc Dis 2014;23:1513-1518.


Figure 1.
Selection of study population. CNUH; Chonnam National University Hospital, n; number, NIHSS; National Institutes of Health stroke scale.
Figure 2.
Representative cases of patients. (A) Infarction at left BG and CR with END. (B) Asymptomatic stenosis (white arraow) at right posterior cerebral artery. (C) Infarction at right basal ganglia and corona radiata with END. (D) Symptomatic stenosis (white arrow) at right middle cerebral artery. (E) Infarction at left BG and CR without END. (F) Symptomatic stenosis (white arrow) at left middle cerebral artery on MRA. BG; basal ganglia, CR; corona radiata, END; early neurological deterioration, MRA; magnetic resonance angiography.
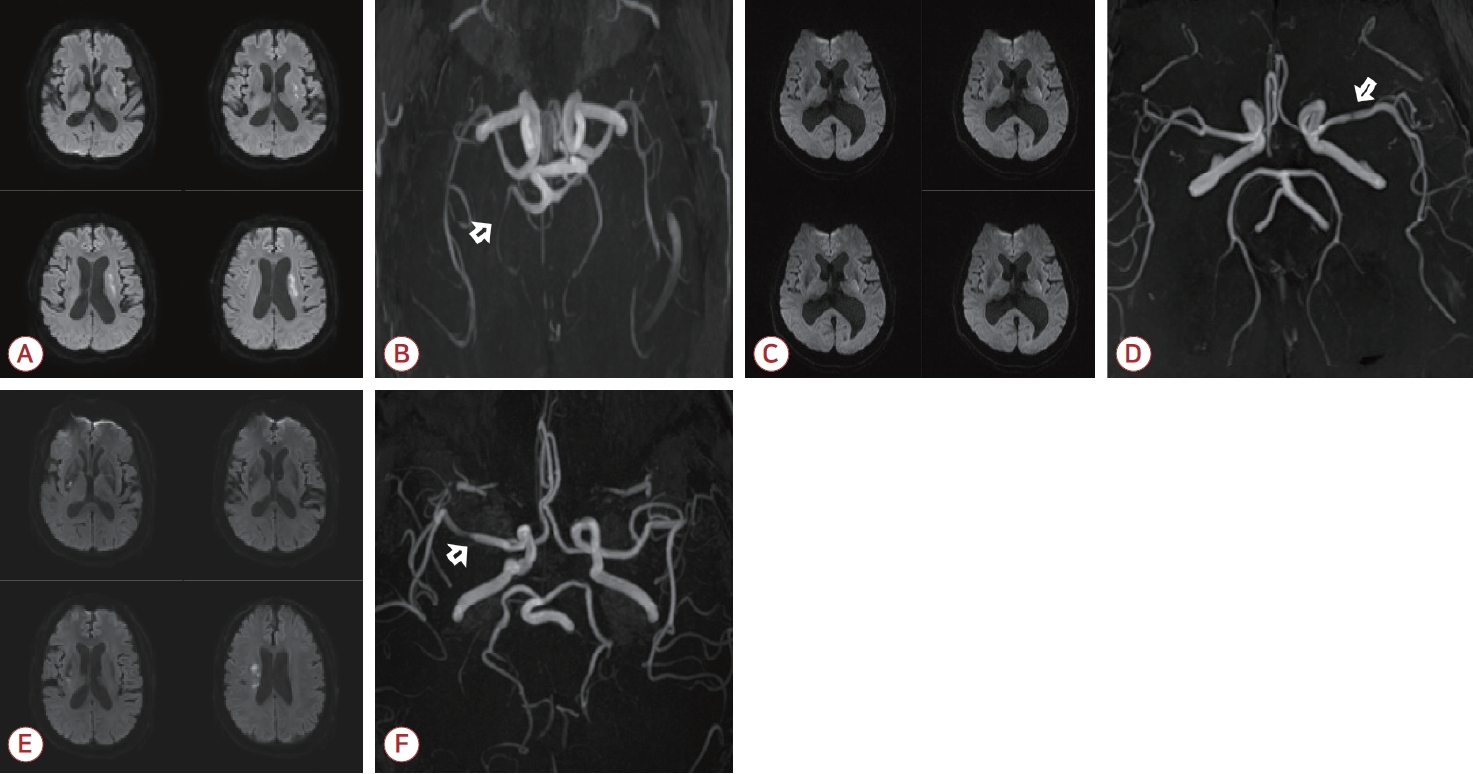
Table 1.
Clinical characteristics in patiens with END and without END
| Characteristic | Non-END (n=447) | END (n=115) | p-valuea |
|---|---|---|---|
| Age (years) | 65.5±13.1 | 70.9±11.4 | <0.001b |
| Sex | <0.001b | ||
| Female | 174 (38.9) | 66 (57.4) | |
| Smoking habitual | 0.014b | ||
| Never smoker | 292 (65.3) | 87 (75.7) | |
| Ex-smoker (quit less than 5 years) | 117 (26.2) | 15 (13.0) | |
| Ex-smoker (quit more than 5 years) | 25 (5.6) | 10 (8.7) | |
| Current smoker | 13 (2.9) | 3 (2.6) | |
| Hypertension | 241 (53.9) | 70 (60.9) | 0.181 |
| Diabetes mellitus | 95 (21.2) | 31 (27.0) | 0.191 |
| Dyslipidemia | 112 (25.1) | 25 (21.7) | 0.460 |
| Initial NIHSS score | 1.9±1.4 | 1.7±1.3 | 0.263 |
| TOAST classification | 0.190 | ||
| Large artery atherosclerosis | 116 (25.9) | 37 (32.2) | |
| Small vessel occlusion | 256 (57.3) | 55 (47.8) | |
| Other determined | 1 (0.2) | 0 (0.0) | |
| Undetermined | 74 (16.6) | 23 (20.0) | |
| LDL-C | 117.1±36.6 | 120.2±37.8 | 0.429 |
| Triglyceride | 125.7±70.7 | 119.6±78.0 | 0.446 |
| Systolic blood pressure | 144.1±25.7 | 148.2±28.2 | 0.135 |
| Diastolic blood pressure | 84.9±14.3 | 84.0±16.3 | 0.639 |
| Random blood sugar | 140.7±73.8 | 135.7±48.9 | 0.382 |
| HgbA1c | 6.4±4.5 | 6.2±1.2 | 0.379 |
| Infarction site | 0.091 | ||
| Posterior limb of internal capsule | 84 (18.8) | 13 (11.3) | |
| Basal ganglia | 236 (52.8) | 59 (51.3) | |
| Corona radiata | 24 (5.4) | 11 (9.6) | |
| Both BG and CR | 103 (23.0) | 32 (27.8) |
Values are presented as mean±standard deviation or number (%).
END; early neurological deterioration, NIHSS; National Institutes of Health stroke scale, TOAST; trial of ORG 10172 in acute stroke treatment, LDL-C; low density lipoprotein cholesterol, HgbA1c; glycated hemoglobin, BG; basal ganglia, CR; corona radiata.
Table 2.
Univariate logistic regression analysis for early neurological deterioration
|
Unadjusted |
||
|---|---|---|
| OR (95% CI) | p-valuea | |
| Age | 1.0 (1.0-1.1) | <0.001b |
| Sex | <0.001b | |
| Female | 2.1 (1.4-3.2) | |
| Smoking habitual | 0.027b | |
| Never smoker | 1 (reference) | |
| Ex-smoker (quit less than 5 years) | 0.4 (0.2-0.8) | |
| Ex-smoker (quit more than 5 years) | 1.3 (0.6-2.9) | |
| Current smoker | 0.8 (0.2-2.9) | |
| Hypertension | 1.3 (0.9-2.0) | 0.182 |
| Diabetes mellitus | 1.4 (0.9-2.2) | 0.192 |
| Dyslipidemia | 0.8 (0.5-1.4) | 0.460 |
| Initial NIHSS score | 0.9 (0.8-1.1) | 0.263 |
| TOAST classification | 0.192 | |
| Large artery atherosclerosis | 1.5 (0.9-2.4) | |
| Small vessel occlusion | 1 (reference) | |
| Other determined | N/A | |
| Undetermined | 1.4 (0.8-2.5) | |
| LDL-C | 1.0 (1.0-1.0) | 0.429 |
| Triglyceride | 1.0 (1.0-1.0) | 0.446 |
| Systolic blood pressure | 1.0 (1.0-1.0) | 0.136 |
| Diastolic blood pressure | 1.0 (1.0-1.0) | 0.638 |
| Random blood sugar | 1.0 (1.0-1.0) | 0.489 |
| HgbA1c | 1.0 (0.9-1.1) | 0.647 |
| Infarction site | 0.098 | |
| Posterior limb of internal capsule | 1 (reference) | |
| Basal ganglia | 1.6 (0.8-3.0) | |
| Corona radiata | 2.3 (1.2-7.4) | |
| Both BG and CR | 2.0 (1.0-4.1) | |
Table 3.
Multivariable logistic regression analysis for early neurological deterioration
|
Adjusteda |
||
|---|---|---|
| OR (95% CI) | p-valueb | |
| Age | 1.0 (1.0-1.0) | 0.011c |
| Sex | 0.042c | |
| Female | 1.7 (1.0-2.9) | |
| HTN | 1.0 (0.6-1.5) | 0.850 |
| DM | 1.4 (0.8-2.3) | 0.193 |
| Smoking habitual | 0.150 | |
| Never smoker | 1 (reference) | |
| Ex-smoker (quit less than 5 years) | 0.7 (0.4-1.4) | |
| Ex-smoker (quit more than 5 years) | 2.1 (0.9-4.9) | |
| Current smoker | 1.2 (0.3-4.7) | |
| TOAST | 0.735 | |
| Large artery artherosclerosis | 1.2 (0.7-2.0) | |
| Small vessel occlusion | 1 (reference) | |
| Other determined | N/A | |
| Undetermined | 1.3 (0.7-2.3) | |
| Systolic blood pressure | 1.0 (1.0-1.0) | 0.011c |
| Infarction location | 0.088 | |
| Posterior limb of internal capsule | 1 (reference) | |
| Basal ganglia | 1.6 (0.8-3.1) | |
| Corona radiata | 3.0 (1.1-7.9) | |
| Both BG and CR | 1.9 (0.9-4.0) | |
OR; odds ratio, CI; confidence interval, HTN; hypertension, DM; diabetes mellitus, TOAST; trial of ORG 10172 in acute stroke treatment, N/A; not applicable, BG; basal ganglia, CR; corona radiata.
Table 4.
Vascular stenosis in patients with END and without END
| No stenosis | Only symptomatic stenosis or occlusion | Only asymptomatic stenosis or occlusion | Both symptomatic and asymptomatic stenosis or occlusion | p-valuea | |
|---|---|---|---|---|---|
| Vascular stenosis | 0.002b | ||||
| Non-END (n=447) | 242 (54.1) | 86 (19.2) | 47 (10.5) | 72 (16.1) | |
| END (n=115) | 44 (38.3) | 20 (17.4) | 22 (19.1) | 29 (25.2) |
Table 5.
logistic regression model for the vascular stenosis
|
Unadjusted |
Adjusteda |
|||
|---|---|---|---|---|
| OR (95% CI) | p-valueb | OR (95% CI) | p-valueb | |
| Vascular stenosis | 0.003c | 0.051 | ||
| No stenosis | 1 (reference) | 1 (reference) | ||
| Only symptomatic stenosis | 1.3 (0.7-2.3) | 1.0 (0.5-1.9) | ||
| Only asymptomatic stenosis | 2.6 (1.4-4.7) | 2.2 (1.1-4.0) | ||
| Both symptomatic and asymptomatic stenosis | 2.2 (1.3-3.8) | 1.5 (0.8-2.9) | ||
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,911 View
- 43 Download
- Related articles
-
Predictors for Early Neurological Deterioration in Lacunar Infarction2015 November;33(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



