정상압수두증의 병태생리
Pathophysiology of Normal Pressure Hydrocephalus
Article information
Trans Abstract
The current perspective for the pathophysiology of normal pressure hydrocephalus is focusing on stiffness of the central nervous tissue, especially on a type of cerebrovascular disorder. Rigid intracranial vessels and tissues derived by either vascular risk factors or aging may lead into impaired dynamics of the cerebrospinal fluid such as increased pulsatility and decreased absorption of the cerebrospinal fluid. Enlarged ventricle may result in a decrease of blood perfusion in brain parenchyma, and in turn global hypoxia and neuro-inflammation along with a breakdown of the blood-brain-barrier. Deterioration of the glymphatic pathway, the crucial disposal pathway of the waste product of the brain, also might contribute to the irreversible injury of the nervous tissue by deposition of abnormal toxic proteins including amyloid beta. Of note, the pathophysiology of the normal pressure hydrocephalus is moving to a type of cerebrovascular disorder instead of the etiology of idiopathic.
서 론
정상압수두증은 비교적 흔한 신경퇴행질환으로 70세 이상 인구 군 10만 명당 매년 약 120명의 발생률이 알려져 있으며[1] 보행장애, 배뇨장애, 인지 저하의 3대 증상을 특징으로 한다. 일반적으로 초기에는 보행장애가 흔하고 인지 저하는 비교적 나중에 발현하는 편이며[2] 고령 남성에서는 전립샘비대증으로 오인되어 수두증에 의한 배뇨장애가 제때 확인되지 못하기도 한다. 정상압수두증의 가장 특징적인 소견은 뇌실의 확장이 존재하지만 뇌압이 상승되지 않은 정상 범위라는 점이다. 그동안 여러 연구가 있어 왔지만 아직 이에 대해서 완전한 이해는 이루어지지 않았다. 뇌척수액 생성과 흡수 사이 압력의 불균형은 초기에 일시적인 것으로 사료되며 시간의 흐름에 따라 새로운 평형이 이루어지기에 증상 발현 시점의 압력은 정상 범위인 것으로 추정되고 현재로서는 뚜렷한 선행 질환이 없는 특발성(idiopathic)으로 여겨진다. 뇌영상의 특징적 소견은 뇌실의 확장, 뇌실 주변의 백질변성, 실비우스틈새(Sylvian fissure) 확장, 거미막밑공간과 두정(vertex) 부위 피질고랑 압박을 특징으로 하는 disproportionately enlarged subarachnoid-space hydrocephalus (DESH) 징후 등이 알려져 있다[3]. 정상압수두증에 대한 약물 치료는 아세타졸아미드 등 몇 가지 약제들이 시도되었고 유의미한 근거를 보여주기도 하였지만[4] 임상에서 표준 치료로 이용될 만한 근거와 효과를 보여주지는 못하였으며 뇌실복강(ventriculo-peritoneal) 또는 요추복강(lumbo-peritoneal) 션트 등 수술 치료가 현재로서는 가장 효과적인 해결 방법이다. 수술 후 효과는 60-80% 환자에서 증상 호전을 보이고[5] 보행장애의 개선이 주를 이루며 간혹 인지 저하나 배뇨장애 역시 호전되는 경우도 있다[6]. 션트 수술에 대한 반응은 환자 개인마다 다양하여 일괄적으로 판단하기는 어렵고 효과가 있더라도 지속성이 다른 원인에 의한 수두증보다 길지는 않은 것으로 알려져 있어[7] 완전한 해결보다는 현실적인 치료라고 보는 것이 합당하겠다. 또한 수술만으로 완전한 증상의 호전이나 해소가 되지 않는 점은 뇌실 팽창 외에 다른 기전의 존재 가능성 역시 시사한다. 하지만 비가역적인 진행을 보이는 대다수의 퇴행질환을 고려하였을 때 정상압수두증은 적절한 수술 치료를 통해 증상을 호전시킬 수 있다는 가역적인 측면이 있기에 환자 치료에 있어 적극적으로 고려되어야 한다는 점은 분명하다.
본 논문에서는 그동안 정상압수두증의 병태생리를 설명하기 위해 알려진 다양한 임상시험, 실험 연구 결과를 정리하여 이에 대한 이해를 돕고자 한다. 특히 최근 연구 결과들을 바탕으로 뇌혈관의 경직 변화에 초점을 맞춰 설명하고자 한다.
본 문
정상압수두증에 대한 본격적인 주목은 Hakim과 Adams [8]가 1965년에 세 가지 증후를 정리하며 시작되었으며 그들은 뇌실 확장에 의한 백질 내 섬유들의 압박에 의한 증상 발생을 추정하였다. 하지만 백질의 어느 특정 부분이 증상 관련 역할을 하는지 알려진 바가 없고 뇌실 확장의 정도와 증상 정도가 서로 상관관계를 보이지 않는 경우도 많아 이것만으로 증상을 설명하기는 어렵다[9]. 또한 이차수두증(폐쇄수두증 등)이나 생리적인 수두증(hydrocephalus ex vacuo 등)의 경우 정상압수두증의 세 가지 징후가 관찰되지 않는 경우도 많다. 일부 연구 결과들은 기저핵을 포함한 피질-기저핵-시상-피질 경로(cortico-basal ganglia-thalamo-cortical pathway)의 도파민 관련 손상을 제기하였고[10] 전두엽-선조체 경로(fronto-striatal pathway) 손상으로 전두엽기능 저하가 주된 원인이라고 설명하기도 하였다[11]. 현재로서는 증상을 설명할 만한 단일 해부학적 구조물(anatomical correlate)은 알려진 바가 없으며 기존 연구 결과를 종합해 보면 단일 구조물보다는 여러 기능적 네트워크를 침범하는 병태생리 기전을 생각하여야 할 것이다.
1. 비정상 뇌척수액 역동학(abnormal cerebrospinal fluid dynamics)
정상 조건에서 뇌척수액은 크게 덩이흐름(bulk flow)과 박동흐름(pulsatile flow)으로 나뉘어진다. 덩이흐름은 뇌실 내 맥락막얼기(choroid plexus)에서 꾸준하게 생성되는 뇌척수액에 의한 자연스럽고 지속적인 흐름이다. 말 그대로 꾸준한 뇌척수액 생산에 의한 뇌척수액 자체 용적 증가로 발생하는 자연스러운 흐름으로 가쪽뇌실에서 제3뇌실, 제4뇌실을 거쳐 거미막밑 공간의 과립(arachnoid granulation)을 통해 정맥굴로 흡수된다. 반면 박동흐름은 심장 박동에 의한 뇌내동맥의 박동으로 유발되며 대뇌수도관(cerebral aqueduct)에서 가장 잘 나타난다. 영화자기공명영상(cine magnetic resonance imaging)을 통해서 흐름공백(flow void) 형태로 관찰할 수 있으며 심장의 수축기(systole) 때 뇌척수액은 제3뇌실에서 제4뇌실로 흐르며 이완기(diastole) 때는 반대 방향으로 흐르게 된다[12].
비정상 뇌척수액 역동학은 상기 과정 중 특정 과정에 문제가 발생하여 뇌실의 확장이 발생하는 것으로 사료된다. 특히 뇌척수액 박동의 증가와 뇌척수액 흡수의 감소가 주된 기전으로 제기되었다[13].
1) 뇌척수액 박동의 증가(increased cerebrospinal fluid pulsatility)
뇌자기공명영상에서 대뇌수도관의 흐름공백 관찰을 통해 정상압수두증에서 뇌척수액 박동이 증가되었을 것이라는 가설은 이미 오래 전부터 제기되었다[14]. 최근에는 위상차-뇌자기공명영상(phase contrast brain magnetic resonance imaging)을 통해 추적자(tracer)의 주입 없이 심장 박동에 따른 뇌척수액의 이동량 측정이 가능해졌다[15]. 대뇌수도관 일회 박출량(aqueduct stroke volume, ASV)이란 심장 수축기와 이완기 사이의 대뇌수도관을 통한 뇌척수액의 평균적인 관류량을 계산한 지표이다. ASV는 여러 연구에서 정상압수두증 군에서 정상군에 비해 증가해 있었으며[16,17] 인지기능 저하 환자들 사이에서는 알츠하이머치매나 경도인지장애와 달리 정상압수두증에서만 증가해 있기도 하였다[18]. 정상압수두증 환자를 20개월까지 추적 관찰하였을 때 증상이 진행된 군은 비진행군과 비교해서 ASV가 지속적으로 증가하였으며[18] ASV가 더 높은 군에서 션트 수술의 반응이 더 좋은 것으로 보고되었다. 기타 뇌척수액 이동 속도, 제3뇌실과 제4뇌실 사이 압력차, 뇌척수액 회전 등[19] 뇌척수액 박동을 나타내는 다른 지표들도 정상압수두증에서 증가된 결과들이 일관되게 보고되어 뇌척수액 박동 증가는 정상압수두증 병태생리의 가장 중요한 기전으로 생각된다[17,20].
이러한 뇌척수액 박동 증가의 원인은 동맥경화와 뇌 내 탄성(intracranial compliance) 감소가 주요 두 가지 요인으로 사료된다. 심장 박동에 의한 뇌내동맥 박동은 모세혈관에 의한 부드러운 완충 작용을 거쳐 뇌실질과 뇌척수액 계통에 전달되어야 하는데[21] 고령화 및 여러 혈관질환으로 동맥경화가 발생하면 동맥압이 더 강하게 전달되고 모세혈관 완충도 감소하게 되어 결과적으로 뇌척수액이 강한 심장 박동을 직접적으로 전달받게 된다[22]. 또한 고령화 및 퇴행질환 등 여러 다양한 경우로 뇌조직 자체의 경화로 뇌 내 탄성도가 감소하게 되고[23,24] 이것 역시 심장 박동압이 감쇄 없이 뇌척수액으로 강하게 전달되는 주요 이유가 된다. 뇌척수액 박동의 과한 증가는 때로 뇌척수액의 역류를 유발하기도 한다. 정상압수두증에서 대뇌수도관 전후 압력 차이가 존재함을 관찰하였고 제4뇌실의 압력이 높아 오히려 뇌척수액이 역류하는 소견이 관찰되기도 하였다[25,26]. 과도하게 증가된 뇌척수액 내 박동압이 오히려 이러한 반대 흐름을 유발하는 것으로 추정되며 역으로 형성된 흐름은 가쪽뇌실까지 영향을 주어 뇌실의 확장을 가속화하고 뇌실막층(ependymal layer)에도 손상을 주어 병태생리에 기여할 것으로 사료된다[27]. 실제 수술 후 이러한 흐름이 원래대로 정상화되는 것도 확인된 바 있다[26].
2) 뇌척수액 배액 감소(reduced cerebrospinal fluid drainage)
뇌척수액 배액 감소는 박동 증가 외에 수두증 발생의 중요한 요인이며 원인 탐구에 있어서 간과되어서는 안 된다. 정상압수두증 환자의 뇌척수액 배액에 대한 저항압(resistance to cerebrospinal fluid outflow)은 증가되어 있는 것으로 알려져 있는데[28] 69명의 연구 대상자를 조사한 전향적 연구에서는[29] 약 83%의 환자에서 12 mmHg/mL/min 이상으로 상승되어 있었던 반면 정상인은 10 mmHg/mL/min을 거의 넘지 않는 것으로 보고되었다. 기존 문헌 보고를 통해 현재 12 mmHg/mL/min을 기준 저항압으로 받아들이고 있다[30].
뇌척수액은 거미막밑공간에서 거미막과립을 통해 정맥굴로 흡수가 일어난다. 이에 정맥을 통한 뇌척수액 흐름을 비교한 연구들도 있었는데 정상압수두증 환자 20명을 대상으로 한 연구[31]에서 정맥을 통한 뇌척수액 배액량이 정상인에 비해 유의미하게 감소한 것을 관찰하였으며 대략 위시상정맥굴(superior sagittal sinus) 압력이 3-4 mmHg 이상 증가하면 거미막과립을 통한 뇌척수액 배액은 중단되는 것으로 알려져 있다[32]. 이러한 현상의 원인은 정맥압이 상승되는 조건에서 유발되는 것으로 추정된다. 목동맥압이 역류하는 경우도 보고되었고 정맥굴 협착도 관찰되는 등 여러 가지 유발 조건이 가능하다[33]. 특히 노화에 의한 혈관 및 조직의 경화와 이에 따른 이차 정맥압 상승이 가장 유력한 인자로 여겨진다[19]. 결과적으로 배액되지 못한 뇌척수액은 한정된 두개골 내에서 뇌실의 팽창과 뇌실질의 압박을 유발하며 이는 뇌조직의 탄성을 더욱 감소시켜 뇌척수액 박동성을 가중시키는 악순환을 유발하게 된다.
2. 뇌혈관인자
상기 서술한 것처럼 뇌혈관의 경화는 결국 뇌척수액 역동학에 부정적인 영향을 미치기 때문에 뇌혈관질환은 정상압수두증과 밀접한 관련성을 갖는 것으로 추정된다. 약 43,000명의 인구 코호트를 기반으로 한 노르웨이 연구는 440명의 정상압수두증 환자에서 더 높은 고혈압, 당뇨, 뇌경색, 협심증의 발생률을 관찰하였으며[34] 다른 인구집단 기반 대규모 연구에서도 정상압수두증 환자의 고혈압, 당뇨, 비만 등 혈관질환의 교차비(odds ratio)를 약 2-5배 수준으로 높은 것으로 보고하여 정상압수두증과 뇌혈관질환들 사이 관련성을 시사한다[35,36]. 또한 수두증에서 흔하게 관찰되는 백질변성 및 뇌실 주변 병변 역시 근본 병태생리는 소혈관질환이기 때문에 뇌혈관질환의 근거를 더욱 뒷받침한다.
3. 글림파틱 경로 이상(glymphatic pathway impairment)
글림파틱 경로(glymphatic pathway)란 비교적 최근에 발견된 glial와 lymphatic의 합성어로 뇌척수액이 뇌혈관 주변(para-arterial and para-venous)과 뇌실질 내 사이질공간(interstitial space)으로 확산되어 형성되는 림프관 계통을 일컫는다. 이는 뇌척수액의 덩이흐름과 뇌동맥의 박동에 의해 유발되며 혈액뇌장벽을 구성하는 별아교세포의 세포막에 존재하는 아쿠아포린-4 통로를 경유하여 이동한다[37]. 뇌실질 사이질공간으로 확산된 뇌척수액은 림프계를 통해 전신 순환으로 유입되어 정맥계로 들어가며 중추신경계의 대사 산물, 노폐물을 배출하는 데 큰 역할을 한다. 글림파틱 경로는 적절한 동맥압, 아쿠아포린-4 기능 유지, 충분한 수면에 의해서 정상 작동한다(Fig. 1).
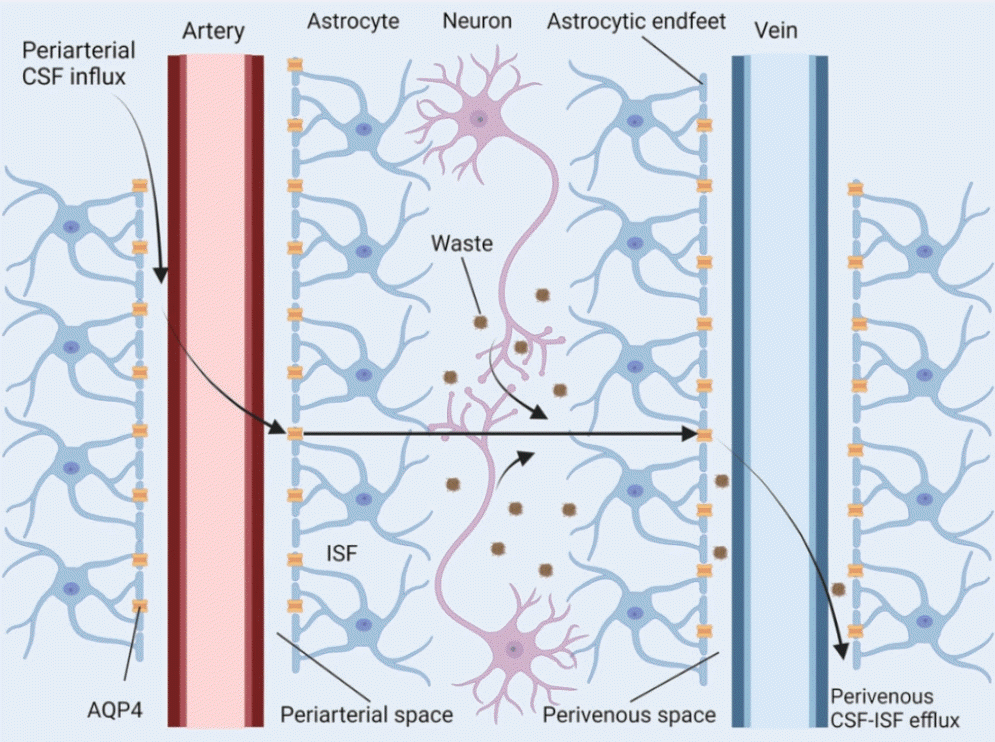
Flow of glymphatic pathway. Cerebrospinal fluid in subarachnoid space which is driven by the arterial pulsation in the brain move into the interstitial space of the brain parenchyma via the aquaporin-4 channels embeded in astrocyte end feet. Disturbance of the flow may result in impairment of the clearance of waste product and excess fluid in the brain tissue, which may contribute to the pathogenesis of normal pressure hydrocephalus. Reused from Szlufik et al.60 CSF; cerebrospinal fluid, ISF; interstitial fluid, AQP4; aquaporin-4.
뇌자기공명영상의 조영제인 gadobutrol을 뇌척수강 내로 투여하여 24시간 동안 8차례에 걸쳐 연속적으로 촬영한 연구에서는 정상압수두증 환자의 거미막하공간에서 배출이 지연되고 뇌실질의 조영증강은 증가되어 있는 결과를 통해 정상압수두증 환자의 뇌척수액 내 조영제 배출이 지연되는 것을 보여주었으며[27] 이는 글림파틱 경로의 이상을 뒷받침하는 근거가 된다. 병태생리는 다양하게 추정해 볼 수 있는데 우선 뇌 내 팽창된 뇌척수액이 뇌 표면 관통동맥(penetrating artery)을 압박하여 동맥 박동을 억제함으로써 글림파틱 경로를 통한 뇌척수액 이동의 원동력이 감소될 수 있다[38]. 두 번째는 혈관 자체의 경직으로 뇌동맥의 박동이 약해져 뇌척수액 공간에 충분히 전달되지 못하여 뇌척수액의 사이질공간으로 확산을 유발하는 동력이 감소할 수 있다. 세 번째는 아쿠아포린-4 통로 자체가 정상압수두증에서 감소된 경우도 보고되었다[39]. 마지막은 수면질환으로 정상압수두증 환자에서 수면장애의 발병률이 높고 일부 연구에서는 대상자 90% 이상에서 폐쇄수면무호흡증이 관찰되기도 하였다[40]. 글림파틱 경로가 수면 시간에 특히 활성화되어 뇌 내 노폐물을 배출시키는 점을 고려할 때 수면장애는 이의 활성을 억제하고 정상압수두증에서 더 깊은 병적인 상태로 진행하는 시발점이 될 수 있다. 아밀로이드나 타우 등 병적 단백질의 축적을 유발할 수 있고 신경염증 반응을 매개하여 조직 손상 및 신경아교증(gliosis)을 유발하여 비가역적인 뇌 손상을 유발할 수도 있다. 정상압수두증에서 드물지 않게 알츠하이며 병리 소견이 관찰되는 것은 이러한 점을 뒷받침하며 이외에 노화[41], 고혈압[42], 당뇨[43]에서도 글림파틱 경로 이상이 확인되기도 하였다.
4. 이차 변화들
1) 뇌 관류 저하(decreased cerebral blood perfusion) 및 대사 변화(alterations of metabolism)
비정상 뇌척수액 역동학에 의한 뇌실의 확장은 뇌실질에 물리적이고 기계적인 압력을 가하여 뇌의 관류를 감소시키고 궁극적으로 저산소 상태를 유발한다. 이는 컴퓨터단층촬영, 자기공명영상, 단일양자방출전산화단층촬영술 등 여러 뇌영상을 이용한 연구에서 피질과 백질, 기저핵 등 광범위한 뇌 영역에서 관류 저하가 확인되었으며[44] 정상압수두증의 3대 증상을 비교적 잘 설명한다. 또한 뇌척수액 배액 후 뇌 전반적으로 관류가 개선된 결과들[45]도 보고되어 이를 뒷받침한다. 하지만 대부분의 연구에서 뇌 관류 저하 정도와 임상 증상이 상관관계를 보이지는 않았으며 션트 수술 반응과 관련해서도 유의미한 관련성을 보이지 않은 경우가 많아 직접적인 근거로 받아들이기에는 제한적이다[46,47].
저관류-저산소 상태는 뇌 내 여러 대사 과정에도 문제를 유발한다. 정상압수두증 환자의 양전자방출단층촬영은 특히 기저핵의 포도당 대사가 현저히 저하되어 있음을 보고하였는데[48] 이는 보행장애 등 운동 증상의 병태생리를 뒷받침한다. 젖산(lactate)은 무산소 대사(anaerobic metabolism)의 최종 산물로 저관류-저산소 상태를 평가하는 주요 지표로 알려져 있다. 정상압수두증 환자의 뇌척수액에서 젖산 증가가 보고된 바 있으며 젖산이 낮은 환자들이 기억력 재인 검사에서 더 나은 수행을 보이기도 하였다[49]. 뇌 내 특정 대사산물의 변화가 정상압수두증에서 관찰되기도 하였는데 자기공명분광법(magnetic resonance spectroscopy)을 통한 연구는 N-아세틸아스파르트산(N-acetylaspartate, NAA)이 시상에서 유의미하게 감소되었다고 보고하였으며 NAA/크레아틴(creatine) 비율이 간이 인지기능 검사 결과와 관련성이 있음을 관찰하기도 하였다[50].
2) 신경염증 및 신경아교증(neuro-inflammation and neuronal gliosis)
비정상적인 뇌 내 관류 및 대사는 신경염증 반응을 유발하고 이는 비가역적인 신경아교증으로까지 진행되어 뇌 손상을 유발할 수 있다. 정상압수두증에서는 신경염증 매개 물질인 사이토카인, 케모카인 등이 매우 다양하게 관찰된다. Tumor necrosis factor-α (TNF-α), interleukin (IL)-6, IL-8, IL-10, monocyte chemoattractant protein-1, transforming growth factor-β (TGF-β1) 등 다양하며 이 중 TNF-α에 대한 연구 보고가 가장 많다. TNF-α는 정상압수두증 환자에서 증가하는데 션트 수술 후 감소하는 것이 관찰된 바 있으며[51] TNF-α 수치와 임상 증상이 서로 선형 상관관계를 보이기도 하였다[52]. 또한 TNF-α는 수초집(myelin sheath)의 손상을 대표하는 설파티드(sulfatide)와 상관관계를 보이기도 하여 백질변성이 신경염증과 관련될 수 있음을 추정하는 근거를 보여주기도 하였다. TGF-β1은 세포 손상에 대한 염증 및 섬유화 반응을 나타내는 지표로 뇌출혈 후 수두증 및 거미막밑 섬유화를 반영하는 것으로 알려져 있고 정상압수두증에서도 역시 증가가 보고되었다[53]. 기타 다양한 염증인자에 대한 산발적인 연구 결과가 있으며 이러한 염증인자와 수두증의 직접적인 병인 기전에 대해서는 아직 정확히 정립되지는 않았다.
아교세포섬유산성단백질(glial fibrillary acidic protein, GFAP)은 신경아교증을 반영할 때 가장 흔하게 쓰이는 지표이다. 정상압수두증 환자는 뇌실질에서 GFAP 염색 영역이 매우 높게 확인되었으며[54] 뇌척수액에서도 정상인에 비해서 GFAP 수치가 상승되어 있었다[55]. 신경아교증에 의한 조직의 변화는 궁극적으로 뇌실질의 경직을 증가시키고 뇌 탄성도를 감소시켜 뇌척수액 박동 증가 및 배액장애에 기여하게 된다.
3) 혈액뇌장벽 손상(blood-brain-barrier injury)
뇌는 외부 물질로부터 가장 안전하게 보호되어야 하기에 혈관과 뇌세포 사이에 치밀하게 이음(tight junction)을 형성하는데 이를 혈액뇌장벽이라 일컫는다. 사실 혈액뇌장벽 손상은 여러 신경계질환에서 비교적 보편적으로 관찰되는 현상이기 때문에 질병 특이 소견이라 부를 수는 없지만 정상압수두증에서도 혈액뇌장벽 손상을 보여주는 연구 결과들이 분명히 보고되었다. Eide와 Hansson [56]은 혈액뇌장벽 유출을 나타내는 지표인 피브리노겐의 혈관 밖 유출을 전두엽 생검 조직에서 연구하였는데 정상압수두증 환자는 45명 전체에서 유출이 관찰된 반면 기타 신경계질환 환자는 14명 중 4명으로 현저히 적었다. 정상압수두증 환자는 피브리노겐이 축적된 영역도 훨씬 넓었고 신경아교증의 양을 나타내는 지표인 GFAP와 양적 상관관계를 보였다. 또한 피브리노겐 유출이 많을수록 아쿠아포린-4 발현도 줄어드는 역상관관계도 관찰되어 혈액뇌장벽과 글림파틱 경로의 문제가 연관될 수 있음을 보여주었다. 또한 혈액뇌장벽의 구성 요소인 주변세포(pericyte)의 감소 및 모세혈관 기저세포의 비후 등 손상 소견이 정상압수두증 환자 병리 검체에서 관찰되었다[56]. 주변세포는 신경아교세포의 일종으로 혈액뇌장벽의 핵심 구성 요소 중 하나이고 물질의 유입, 유지, 투과도를 조절하며 손상 시 뇌조직 내로 물, 저분자, 고분자 등 다양한 물질들이 유입되는 것으로 알려져 있다.
4) 백질변성(white matter degeneration)
백질변성은 정상압수두증에서 비교적 흔하게 관찰되며 팽창된 뇌실이 뇌신경세포의 축삭다발인 백질을 압박하고 뻗침(stretch)을 유발하여 발생하는 것으로 사료된다. 뇌실 팽창이 겉질척수로(corticospinal tract)를 압박하여 보행장애 등 이상운동을 유발할 수 있으며 겉질척수로의 엉치다발(sacral fiber)을 침범하면 배뇨장애를 발생시킬 수 있다. 물론 수두증외 뇌혈관질환 등 기타 신경계질환으로 백질변성은 충분히 가능하고 그 양상도 다양하며 정상압수두증 환자라도 백질변성이 동반되지 않은 경우도 비교적 흔하기에 뇌실 팽창만으로 백질변성을 설명할 수는 없으며 이에 해석에 주의를 요한다.
정상압수두증 환자의 백질변성 연구는 주로 뇌영상 분석을 바탕으로 이루어졌으며 T2나 액체감쇠역전회복(fluid attenuated inversion recovery) 영상에서 육안으로 관찰 가능하고 특정 소프트웨어 등을 통해 양적 분석이 가능하다. 확산텐서영상(diffusion tensor imaging)을 이용한 연구는 물 분자의 방향성이 잘 보존되어 있는지를 측정하여 백질의 신경다발 안정 정도를 판단한다. 분획비등방성(fractional anisotropy, FA)은 물분자 확산의 비등방성 정도를 수치화한 것으로 백질의 통합성(integrity)을 나타내며 평균 확산도(mean diffusivity, MD)는 세포외공간에 자유수(free water) 확산 증가를 의미하고 백질의 부종을 나타내는 지표이다. 일반적으로 정상압수두증에서 백질의 FA는 감소하고 MD는 증가하는 것으로 알려져 있으며[57] Kanno 등[57]이 20명의 정상압수두증 환자를 알츠하이머치매, 파킨슨병 환자와 비교했을 때 전두엽과 두정엽의 낮은 FA 수치는 인지 저하와, 속섬유막의 앞다리(anterior limb of internal capsule)와 뇌량(corpus callosum)의 낮은 FA 수치는 보행 이상과 강한 상관관계를 보였다. 11명의 정상압수두증 환자를 대상으로 한 다른 연구에서는 백질변성이 뇌량과 겉질척수로에서 유의미하게 손상된 것을 보고하였고 이는 뇌실과 일차적으로 맞닿는 해부학적 부위의 손상을 시사하는 것으로 뇌실 팽창이 백질변성에 직접적으로 기여할 수 있음을 시사하는 근거가 되겠다[58].
병리학적으로도 연구 근거가 보고되었는데 신경잔섬유경쇄(neurofilament light chain)는 축삭의 구조를 유지하는 단백질이고 수초기초단백질(myelin basic protein)은 수초를 구성하는 대표적인 단백질인데 정상압수두증 환자의 뇌척수액에서는 상기 두 물질이 모두 상승해 있어 백질의 손상이 있음을 나타내었으며 뇌실 주변 백질변성 정도 및 임상 증상과 양적 상관관계를 보이기도 하였다[59].
결 론
비정상 뇌척수액 역동학을 정상화시키는 것이 정상압수두증의 궁극적 치료의 가장 핵심이다. 과도한 뇌척수액을 원활하게 배액 가능하도록 하는 것은 뇌척수액 박동을 감소시키고 감소한 뇌척수액 흡수를 상쇄할 수 있는 효율적인 치료 방향이 될 것이다. 이를 위해 ASV, 뇌척수액 저항압 등 수술 전 지표들의 측정이 조금 더 통일된 방법으로 표준화되어야 한다. 뇌척수액의 감압은 뇌실질에 대한 뇌혈류 및 관류량을 회복시켜 신경세포의 정상적인 기능을 복귀시켜 줄 수 있으며 글림파틱 경로 손상에 의한 병적인 단백질 축적과 신경염증 반응, 혈액뇌장벽 손상 등 이차적인 뇌 손상 진행을 억제하거나 원래대로 회복시켜 줄 수 있을 것이다(Fig. 2). 따라서 수술 치료가 불가능한 고령 환자라도 증상이 저명하거나 진행한다면 간헐적인 뇌척수액 배액을 주기적으로 시행해 주는 것도 도움이 될 수 있을 것이다.
추후 연구의 초점은 뇌척수액 흐름의 어느 과정이 가장 주요한 문제인지를 확인하고 그동안 제기된 여러 이상 소견이 션트 수술 등을 통해 뇌척수액 감압 후 가역적으로 호전되는지를 확인하는 것이 될 것이다.
본 논문에서 기술한대로 정상압수두증의 원인은 꼭 특발성이지 않다. 뇌혈관과 뇌조직의 경직, 수면장애 등 뇌척수액의 박동성과 압력을 증가시킬 수 있는 선행 질환에 대한 근거가 점점 많이 확인되고 있으며 이에 대한 예방 및 치료가 병의 진행을 멈출 수 있을 것이라 기대된다. 정상압수두증의 병태생리에 대한 충분한 이해를 바탕으로 더 적극적인 원인인자 탐구와 치료에 임해야 하며 특히 본 질환은 증상이 가역적으로 회복 가능한 몇 안 되는 신경퇴행질환이기 때문에 임상의의 더 적극적인 관심과 진단 그리고 치료를 요한다.
