MFAP5유전자 변이를 가진 가족성 흉부대동맥류 및 박리 환자의 벼락두통과 다발성 두개 내 혈관협착
Multifocal Intracranial Stenosis and Thunderclap Headache in a Patient with Heterozygous MFAP5 Mutation for Familial Thoracic Aortic Aneurysm and Dissection
Article information
Trans Abstract
Recent investigations on familial thoracic aortic aneurysm and dissection (TAAD) identified several genetic variants. Meanwhile, intracranial vasculopathy in familial TAAD has been scarcely reported. We report a case of a young man with Marfanoid habitus and familial TAAD carrying MFAP5, c.472C>T variant. He presented with recurrent thunderclap headache and multifocal intracranial vasculopathy, which is predominantly suggestive of reversible cerebral vasoconstriction syndrome. While the role of MFAP5 in vasculopathy requires clarification, we propose its haploinsufficiency may contribute to both TAAD and intracranial stenosis, highlighting a potential risk of cerebrovascular disease in familial TAAD.
최근 흉부대동맥류 및 박리(thoracic aortic aneurysm and dissection, TAAD)의 유전적 소인에 대한 연구 결과들이 발표되면서 가족성 TAAD와 관련된 여러 유전자 변이가 알려진 바 있다. 한편 가족성 TAAD와 두개 내 혈관 병증 사이의 연관성에 대한 연구는 드물다. 따라서 가족성 TAAD 환자의 진료에서 뇌혈관질환의 위험에 대한 고려는 충분히 이루어지지 못할 수 있다. 저자들은 가족성 TAAD와 연관된 MFAP5 유전자 변이가 있으며 반복적인 벼락두통으로 내원한 젊은 나이의 환자에서 확인된 마르팡 체형(Marfanoid habitus)과 다발성 두개 내 동맥협착의 증례를 MFAP5유전자에 대한 문헌 고찰과 함께 보고한다.
증 례
37세 남자가 3일 전부터 반복되는 벼락두통으로 응급실에 왔다. 환자는 28세에 일차자발기흉으로 치료받은 병력이 있으며 당시 호흡곤란에 대해 시행한 검사에서 우연히 발견된 대동맥판협착 및 대동맥확장증이 진행하여 내원 2개월 전 대동맥판막치환술을 받고 와파린(warfarin)을 복용 중이었다.
내원 3일 전 환자는 뜨거운 차를 마신 직후 양쪽 후두부의 수치평가척도(numeric rating scale, NRS) 10점의 벼락두통을 경험하였고 이에 응급실에 내원하여 진통제 투약 후 수 시간 만에 두통이 호전되었다. 내원 2일 전 배뇨 중 유사한 양상의 두통이 NRS 10점으로 발생하였으며 경구 진통제 투약 수 시간 후 호전되었다. 내원 1일 전 아침 수면 중 잠에서 깰 정도로 심한 두통이 재발하여 환자는 다시 응급실에 내원하였다. 구역과 구토, 광과민과 소리과민 및 위약감이나 감각 이상 등 편두통의 동반 증상이나 신경학적 증상은 부인하였으며 5갑년의 흡연력으로 10년 전 금연한 상태였다. 환자의 신장은 187 cm, 체중은 79 kg였으며 초기 신경계진찰은 특이 사항이 없었다. 환자는 평소 고혈압이 없었으며 응급실 내원 당시 활력징후는 혈압 170/94 mmHg, 맥박 56회/분, 호흡수 18회/분, 체온 36.2℃였다.
환자의 초기 혈청 검사상 혈청 당화혈색소(HbA1c)는 5.0%, 저밀도 지질단백질은 111 mg/dL였고 국제표준화비율(international normalized ratio)은 2.43이었으며 환자는 와파린을 규칙적으로 복용 중이었다. 반복되는 벼락두통에 대해 뇌자기공명영상(magnetic resonance imaging, MRI)과 뇌자기공명혈관조영(magnetic resonance angiography, MRA)을 시행하였고 뇌MRI에서 우측 꼬리핵(caudate nucleus)의 작은 급성 뇌경색 병변이 확인되었으며 뇌MRA에서 양측 후대뇌동맥(posterior cerebral arteries, PCAs)의 원위부에 sausage on a string 모양을 보이는 다발성 협착이 발견되었다(Fig. 1). 뇌경색 병변은 국소 신경학적 결손을 유발하지 않은 작은 크기의 병변이었다. 꼬리핵은 렌즈핵줄무늬체동맥(lenticulostriate artery)의 분지에서 혈액을 공급받는 것으로 알려져 있다. 꼬리핵의 뇌경색은 다양한 원인에 의해 발생할 수 있으나 환자의 MRI에서 백질 변성이나 PCA 외의 협착 소견이 없고 당뇨, 고혈압이 없으며 기계판막을 가지고 있음을 고려할 때 환자의 뇌경색은 심장성 색전뇌졸중으로 평가되었다.
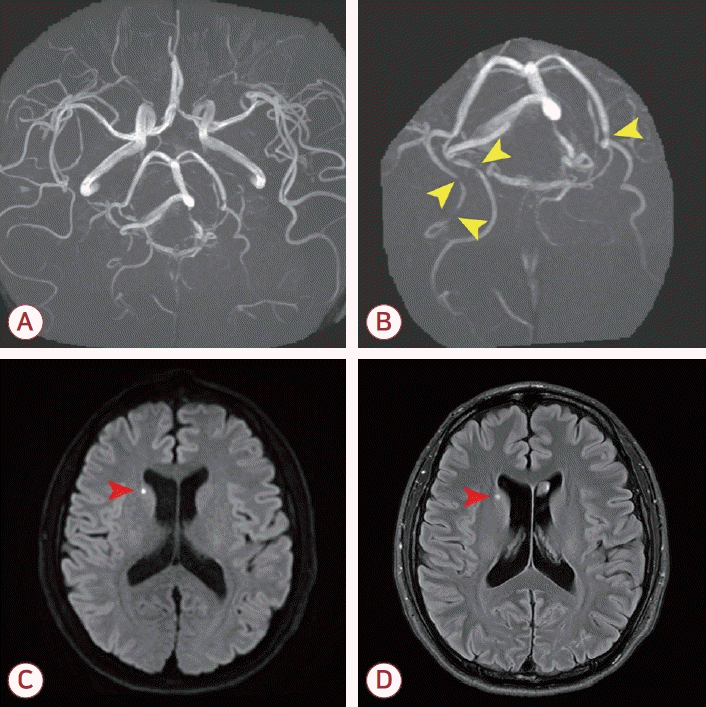
Brain MRI and MRA of the patient. (A, B) The brain magnetic resonance angiography demonstrates multifocal mild stenosis at bilateral distal posterior cerebral arteries of sausage on a string appearance (yellow arrowheads). (C) Diffusion weighted image and (D) fluid attenuated inversion recovery image demonstrates focal acute infarction in the right caudate nucleus (red arrowhead) which did not result in any focal neurological deficit. The brain parenchyme was otherwise normal. MRI; magnetic resonance imaging, MRA; magnetic resonance angiography.
한편 환자의 두통은 양측 PCA의 다발성 혈관협착과 관련이 있을 것으로 추정되었다. 환자의 동맥경화의 위험인자가 뚜렷하지 않고 갑자기 발생한 3차례 이상의 반복되는 벼락두통과 협착의 양상을 고려할 때[1] 협착의 기전으로 가역뇌혈관수축증후군(reversible vasoconstriction syndrome, RCVS)의 가능성이 고려되었다. 이에 입원 후 두통 조절을 위해 진통제와 경험적 경구 니모디핀(nimodipine)을 투약하기 시작하였으며 두통은 다음날 호전되었다. 환자의 큰 키와 기흉 병력, 젊은 연령에서 발생한 대동맥질환과 이후 검진에서 손목징후(wrist sign)가 확인됨을 고려하여 마르팡증후군(Marfan syndrome)과 같은 유전질환이 의심되었다.
이에 차세대 염기서열 분석(next generation sequencing) 기반의 다중 유전자 패널 검사를 시행하였으며 검사 결과 환자는 기존에 TAAD 연관 기능소실돌연변이(loss of function)로 보고된 MFAP5, c.472C>T 변이의 이종접합 보인자(heterozygous carrier)임이 확인되었다. 환자는 1남 1녀 중 1남으로 환자에게는 1녀가 있고(Fig. 2) 환자 외의 심장이나 대동맥질환, 마르팡증후군 연관 병력 및 뇌혈관질환의 가족력은 없었다. 환자의 대동맥 수술 전 대동맥근위부 Z점수는 2점 미만, 수정체 편위(ectopia lentis)나 FBN1유전자 돌연변이 및 다른 2010 Ghent II 진단 기준[2]에 해당하는 이상 소견은 확인되지 않아 환자는 마르팡 체형(Marfanoid habitus)으로 분류할 수 있었다. 환자의 자녀는 내원 당시까지 기저질환 및 발달 이상 없이 지내고 있으나 추후 상담 및 검사 예정이다.

Pedigree of the patient shows no family history of aortic disease or other phenotypes related to Marfanoid habitus. Arrow indicates the patient in this case report.
입원 후 두통은 호전 상태로 유지되어 환자는 퇴원하였으며 이후 1개월 뒤 외래 방문까지 두통의 재발은 없었다.
고 찰
본 증례는 수일에 걸쳐 반복적으로 발생하는 벼락두통으로 내원하여 앙측 PCA의 다발성 원위부 혈관협착이 발견된 37세 남자 환자로 진통제와 경험적 니모디핀 투약 후 두통이 호전되었고 큰 키와 젊은 나이에 발생한 대동맥질환과 일차자발기흉 병력, 검진상 확인된 손목징후를 통해 유전질환을 의심하여 시행한 유전체 검사 결과에서 MFAP5의 기능소실돌연변이가 확인되어 가족성 TAAD로 진단된 증례이다.
TAAD와 두개 내 혈관 병증과의 연관성에 대한 기존 보고는 TAAD와 두개 내 동맥류와의 연관성에 국한되어 있다. 대동맥질환 환자에서의 높은 두개 내 동맥류 유병률 혹은 두개 내 동맥류 환자에서의 높은 대동맥류 유병률이 보고되었으나[3] 이에 대한 유전인자의 기여 여부에 대한 문헌은 부재하다. 또한 TAAD 환자에서 두개 내 동맥류 외의 다른 두개 내 혈관 병증에 대한 보고는 찾아보기가 어렵다.
본 증례 환자의 반복되는 벼락두통, PCA에 국한된 원위부 위주의 sausage on a string 모양을 보이는 협착이 양측으로 발생한 점, 환자의 젊은 연령, 적은 죽상동맥경화 위험인자 및 호전 경과를 고려할 때 뇌혈관협착의 기전으로 죽상동맥경화와 같은 만성 경과를 보이는 혈관 병증보다는 혈관의 연축이나 박리 같은 급성 경과를 보이는 기전을 우선적으로 고려하는 것이 합당하다.
동맥박리의 경우 PCA에 국한되거나 본 증례와 같이 양측으로 발생하는 경우는 매우 드물고[4] 영상에서 혈관벽 내 혈종(intramural hematoma), 박리동맥류(dissecting aneurysm) 등 동맥박리를 시사하는 소견도 확인되지 않아 가능성이 낮다고 판단하였다. 또한 협착 부위 연관 국소 신경학적 이상 소견이 없고 혈관염에서 더 흔히 관찰되는 뇌실질이나 혈관의 조영증강도 확인되지 않았으며 니모디핀과 대증 치료만으로 호전된 후 두통의 재발이 없음을 고려할 때 혈관염 또한 가능성이 낮다[5,6]. 반복되는 벼락두통 및 원위부 우세한 혈관협착, 니모디핀과 대증 치료만으로 두통이 호전된 점 등을 통해 본 환자에서 RCVS의 가능성이 있으며 감별 및 확진을 위해 고해상도혈관벽MRI (high resolution vessel wall MRI) 및 뇌혈관영상의 추적 검사를 고려하였으나 환자가 이후 내원하지 않아 혈관협착 가역성 확인은 진행되지 못하였다. 다만 3회 이상 반복되는 벼락두통 자체의 RCVS에 대한 예측력이 크다는 점[1], international classification of headache disorders 3rd edition (ICHD-3)의 개연가역뇌혈관수축증후군에 기인한 급성 두통(acute headache probably attributed to RCVS)의 진단 기준 중[7] 환자의 두통 유발 상황이 명확하게 확인되지 않는 점을 제외하고는 기준을 만족하며 진단 기준에는 없지만 환자의 두통 발생 당시의 상황이던 배뇨 역시 RCVS의 유발 상황으로 보고되는 점[8], 환자의 응급실 내원 당시 혈압 증가[8] 등은 모두 본 증례에서 RCVS의 가능성을 시사한다.
MFAP5유전자의 c.472C>T 변이 외에 혈관질환의 위험인자가 뚜렷하지 않은 본 환자에서 마르팡 체형이라는 전신 소견이 있음을 고려할 때 RCVS 가능성이 있는 두개 내 혈관 협착에도 유전적 소인이 관여했을 가능성이 있다. MFAP5 c.472C>T 변이는 기능소실돌연변이로 가계 유전 분석을 통해 TAAD와의 연관성이 처음 보고되었다[9]. MFAP5유전자는 microfibril-associated glycoprotein 2 (MAGP-2)라는 세포외기질(extracellular matrix)의 구성 요소 단백질을 암호화하며 혈관 형성, 기능, 유지 등에 관여하는 기전은 아직 밝혀져 있지 않은 상태이다. 다만 시험관 내(in vitro) 실험에서 c.472C>T 변이의 이형접합체일 경우 MGAP-2 단백질의 양이 저하되어 반수체기능부전(haploinsufficiency)을 보일 가능성이 제시되었다. 또한 MFAP5유전자의 또 다른 기능 소실돌연변이로 생각되는 c.62G>T 변이 쥐를 이용한 생체 내(in vivo) 실험에서 대동맥의 transforming growth factor-beta (TGF-β) 신호 전달(signaling) 증가가 확인되었으며[9] 구체적 기전이 알려져 있지는 않으나 TGF-β 신호 전달의 변화는 혈관수축제(vasoconstrictor)인 엔도텔린(endothelin)-1의 발현에 영향을 미침으로서 RCVS의 발병 기전에도 관여할 가능성이 제시된 바 있다[8]. 그리고 TGF-β 신호 전달은 마르팡증후군의 원인인 FBN1유전자의 돌연변이에서도 증가하며[2] 마르팡증후군과 비슷한 표현형을 나타내는 유전질환들이 공통적으로 TGF-β 신호 전달과 연관성이 있는 것으로 보고되었다[10]. 따라서 본 증례의 환자에서 마르팡 체형이 나타난 것과 RCVS일 가능성이 높은 뇌혈관협착에 MFAP5, c.472C>T 돌연변이로 인한 TGF-β 신호 전달 변화가 관여하였을 가능성을 제시해 볼 수 있다. 다만 MFAP5유전자가 혈관 유지 및 기능에 미치는 영향에 대한 연구가 충분하지 못한만큼 두개 내 혈관 병증에서의 구체적인 역할에 대해서도 추가로 분자적인 연구가 필요하겠다.
본 증례에서는 추적 영상 검사가 어려워 RCVS의 확진에 제한이 있었고 하나의 증례로 환자의 두개 내 혈관 병증과 유전인자와의 인과관계를 확인하기는 어렵다. 그러나 가족성 TAAD에서 기 보고된 MFAP5유전자의 기능소실돌연변이를 가진 환자의 두개 내 혈관협착에 대한 첫 보고이며 아직 온전히 기능이 밝혀지지 않은 MFAP5유전자가 대동맥 외에 두개내 혈관 유지에도 관여할 수 있음과 이 과정을 TGF-β 신호 전달이 매개할 가능성을 시사하는 증례이다. 또한 TAAD 환자에서 신경학적 증상이 동반될 때 특히 유전적 소인이 의심되는 환자라면 뇌동맥류나 대동맥박리에 이차적으로 발생하는 뇌경색 외에도 두개 내 혈관 병증의 가능성이 있음을 보여주는 증례이다.