뇌하수체 종양에 출혈 또는 경색이 발생하는 뇌하수체졸중(pituitary apoplexy)은 급격한 종양의 팽창 또는 부종에 의해 내경동맥을 압박할 수 있으며 이는 대뇌의 혈류 제한 및 뇌경색의 드문 원인으로 알려져 있다[1,2]. 근본적인 치료는 종양의 수술이며 급성 대뇌허혈을 신속하게 해결하지 못하고 치료가 지연될 경우 심각한 신경계 후유증을 남기거나 사망에 이를 수 있다[3]. 저자들은 뇌하수체졸중에 의한 내경동맥 원위부의 심한 협착 및 뇌경색이 발생한 환자에서 수술 전 혈전제거술 및 스텐트삽입술을 통해 성공적인 혈류 재개통에 성공한 사례를 경험하여 이를 보고하고자 한다.
증 례
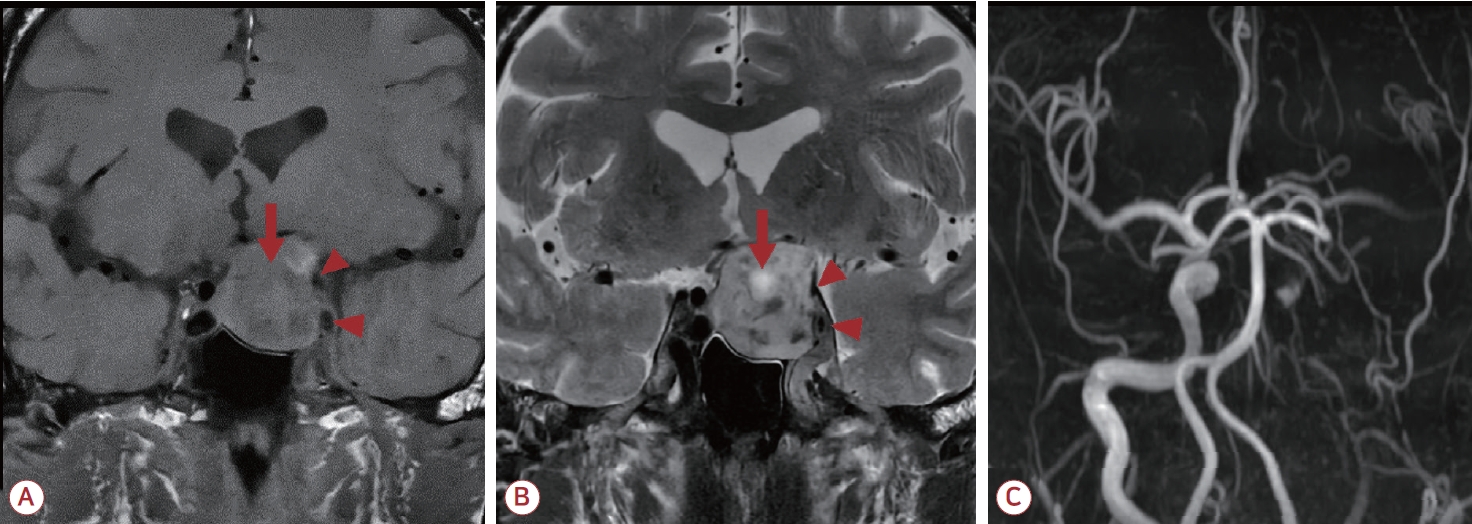
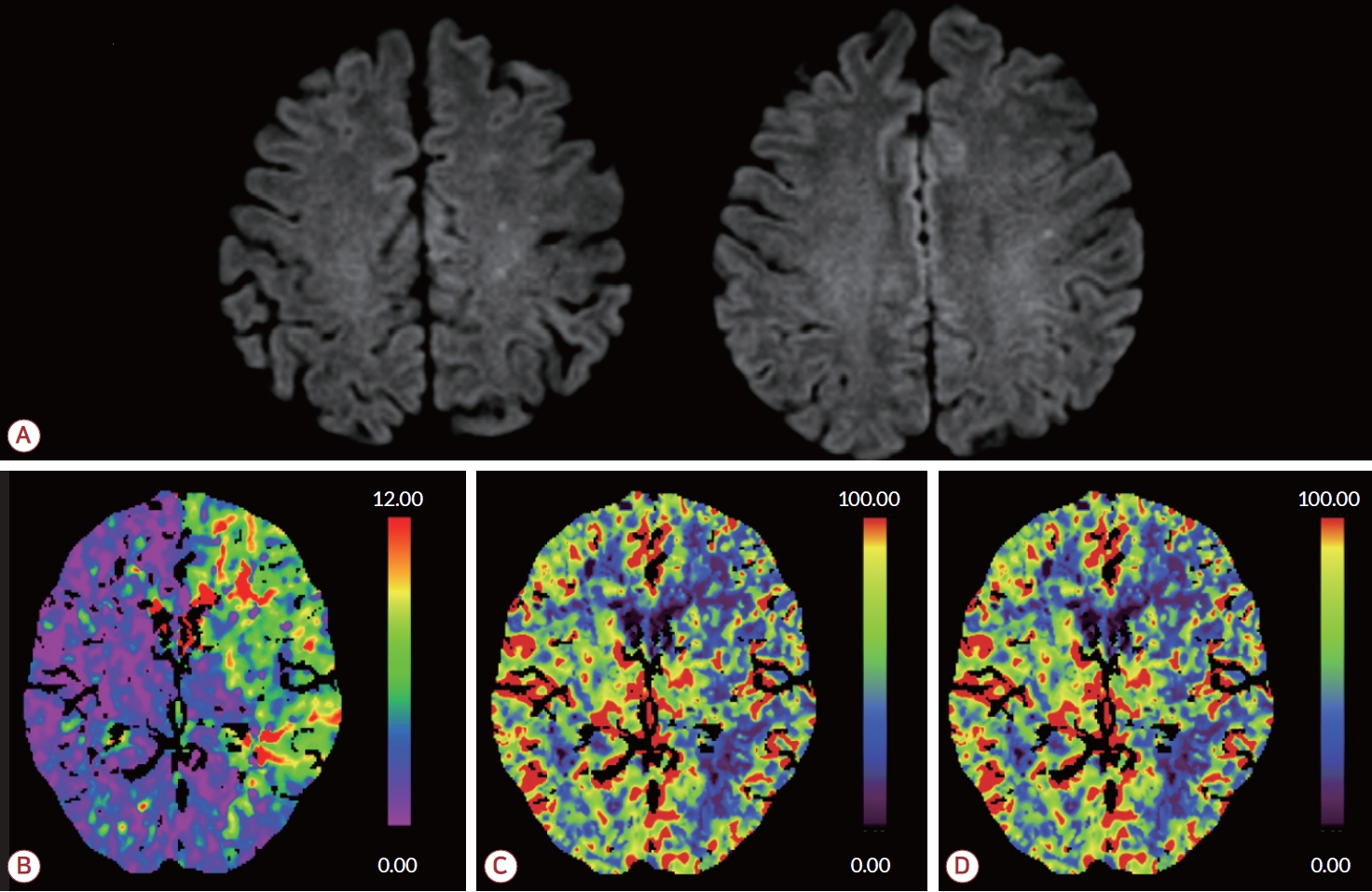
73세 남자 환자가 2시간 전 발생하여 30분가량 지속된 뒤 호전된 우측 편마비, 구음장애로 내원하였다. 환자는 수년 전부터 좌안 시력이 점차 저하되어 2개월 전부터 좌안 실명 상태였다. 과거력에서 고혈압으로 항고혈압제를 복용 중이었다. 내원 시 혈압은 140/90 mmHg, 맥박수 59회/분, 체온 37℃였다. 신경계진찰에서 좌측 동공 크기 5 mm, 우측 동공 크기 3 mm, 좌안의 동공반사가 소실되어 있었고 안검하수, 내전장애가 관찰되었으며 NIH 뇌졸중 척도(National Institutes of Health stroke scale, NIHSS) 점수 1점이었다. 흉부X선 검사, 심전도, 일반 혈액 검사와 전해질 검사는 모두 정상 소견이었다. 뇌자기공명영상 검사의 확산강조영상(diffusion-weighted image, DWI)에서 급성 뇌경색을 시사하는 소견은 관찰되지 않았으나 T1강조영상 및 T2강조영상에서 불균일한 신호 강도를 보이는 거대 뇌하수체 종양이 확인되었고 종양 내부에 T1강조영상에서는 경미한 저신호강도로 관찰되며 T2강조영상에서는 고신호강도로 관찰되는 영역이 확인되어 급성기 출혈을 시사하였다(Fig. 1-A, B). 뇌자기공명혈관조영(magnetic resonance angiography, MRA) 검사에서 좌측으로 편위된 종양의 물리적 압박에 의한 좌측 내경동맥 원위부 폐색이 의심되었고 전교통동맥 곁순환을 통한 중대뇌동맥 혈류가 관찰되었으나 우측 혈류에 비해 감소된 소견이었다(Fig. 1-C). 내부에 출혈이 발생하면서 급격하게 크기가 증가된 종양이 내경동맥을 압박하여 발생한 일과성허혈발작으로 진단하였고 신경외과와 협진하여 정규 종양 제거술을 계획하였다. 내원 12시간 뒤 의식 수준이 기면(drowsy) 상태로 저하되었고 언어의 유창성 및 이해력이 저하되어 간단한 단어만 표현할 수 있었다. 우측 편마비로 상하지 근력 모두 Medical Research Council 등급 4로 감소하였고 우안에서 이측 반맹이 확인되었으며 NIHSS 점수 14점이었다. 추적 뇌자기공명영상을 시행하였고 DWI에서 좌측 중대뇌동맥 영역의 급성 뇌경색이 새롭게 관찰되었다(Fig. 2-A). Computed tomography 관류영상에서 좌측 전대뇌동맥과 중대뇌동맥 영역 전반에 최고 농도 도달 시간(time to maximum)이 6초를 초과하여 연장되어 있었고 뇌혈류(cerebral blood flow, CBF)가 감소되어 있었으며 뇌혈액량(cerebral blood volume)은 경미하게 증가되어 있었다(Fig. 2-B-D). 뇌경색 병변이 대뇌피질에서도 관찰되어 동맥-동맥색전증의 가능성도 고려하였으나 신경계 증상의 악화는 CBF 저하가 원인일 것으로 판단하였다. 환자의 증상이 급격하게 악화되어 응급 종양 제거술을 시행하고자 하였으나 수시간의 지연이 예상되어 혈류 재개통을 고려하며 응급 대퇴동맥 경유 뇌혈관조영술(transfemoral cerebral angiography, TFCA)을 시행하였다. TFCA에서 좌측 내경동맥 안분절에 심한 협착이 관찰되었고 원위부로 혈류가 감소되어 있었다(Fig. 3-A, B). 내경동맥의 협착 부위 내부에 소량의 혈전이 관찰되어 REACT aspiration catheter (Medtronic, Minneapolis, MN, USA)로 흡인하여 혈전을 제거하였으나 여전히 심한 협착이 관찰되었다. 이에 Gateway balloon 2.5-15 mm (Stryker, Kalamazoo, MI, USA)로 두 차례 풍선혈 관성형술을 시행하였으나 종양에 의한 압박으로 인해 재협착이 발생하였고 Wingspan stent 4.5×20 mm (Stryker)를 삽입하였다(Fig. 3-C, D). 남아있는 재협착에 대해 Gateway balloon 3.0-15 mm (Stryker)로 한 차례 풍선혈관성형술을 시행한 뒤 좌측 대뇌 반구의 현저한 혈류 개선이 확인되었고 스텐트 내 혈전 또는 재협착은 관찰되지 않아 시술을 종료하였다(Fig. 3-E, F). 시술 이후 신경계진찰상 의식 수준, 우측 편마비, 실어증이 호전되었고 좌안 실명과 안검하수, 내전장애 및 우안의 이측 반맹 소견만 확인되어 NIHSS 점수 2점으로 호전되었다. 출혈 위험성을 고려하여 항혈소판제는 보류하였다. 뇌하수체졸중으로 인한 뇌하수체기능저하증의 동반 여부 및 그로 인한 수술 위험성을 평가하기 위한 검사가 진행되었고 갑상샘호르몬 및 혈청 코티솔을 포함한 호르몬 검사에서 뇌하수체기능저하증을 시사하는 이상 소견은 관찰되지 않았다. 시술 3일 후 접형동 경유 접근법을 통한 종양제거술이 시행된 뒤 우안 이측 반맹 소견이 호전되었다. 수술 5일 후 스텐트 내 혈전 생성 및 재협착을 방지하기 위해 이중 항혈소판제 투약을 시작하였고 수술 7일 후 만성화된 좌안 실명 상태를 제외한 신경계 증상은 모두 호전된 채로 퇴원하였다.
고 찰
뇌하수체졸중과 연관되어 발병하는 뇌경색은 극히 드문 것으로 알려져 있으며 문헌 고찰에 따르면 2022년까지 전 세계적으로 51명의 환자가 증례로 보고된 바 있다[1-5]. 이들 중 5명은 예후가 보고되지 않았고 예후가 보고된 46명의 환자들 중 13명의 환자가 사망하여 뇌하수체졸중 단독 질환보다 높은 사망률을 보인다[6]. 또한 1명은 식물 상태(vegetative state)였고 13명은 신경계 후유증으로 인한 장애가 남아 뇌경색이 동반된 뇌하수체졸중 환자의 경우 상대적으로 그 예후가 나쁜 편이다.
뇌하수체졸중에 동반되는 뇌경색은 병태생리적으로 두 가지 기전에 의해 발생하는 것으로 알려져 있다. 확장된 종양에 의해 인접한 뇌혈관이 물리적으로 압박되어 CBF가 감소하거나 종양에서 분비된 혈관 작용(vasoactive) 물질에 의해 혈관 연축(vasospasm)이 발생하게 되는 것이며 두 가지 기전이 복합적으로 작용하기도 한다[5,7]. 일반적으로 뇌하수체 종양은 크기가 서서히 증가하는 것으로 알려져 있으나 뇌하수체졸중은 종양 내 출혈이 발생하면서 급격하게 종양이 확장되어 인접한 혈관의 협착 또는 폐색 및 그로 인한 신경계 증상을 유발한다.
영국에서 발표한 뇌하수체졸중 치료의 진료지침에 따르면 아직 논란의 여지가 있으나 시력 저하, 시야 결손 또는 의식 변화가 동반된 뇌하수체졸중 환자는 수술적 치료를 고려해야 하며 수술은 증상 발생으로부터 7일 이내에 진행되는 것이 예후가 좋았다[8]. 뇌하수체졸중에 동반된 뇌경색에 대한 치료 권고 사항은 아직까지 확립된 바 없다.
본 증례는 급격하게 확장된 종양이 인접한 좌측 내경동맥 안분절을 직접적으로 압박하여 중증도 협착이 발생하였고 이로 인해 좌측 대뇌반구 혈류가 감소하여 신경계 증상이 나타났다. 근본적 치료로 응급 종양 절제술이 필요하였으나 수술까지 시간적 지연이 예상되었다. MRA에서 전교통동맥을 통한 곁순환이 일부 관찰되어 치료적 고혈압 유발 요법으로 곁순환을 통한 혈류 개선을 고려해 보기도 하였으나 고혈압이 뇌하수체졸중의 선행 요인으로 보고된 바 있어 종양 내 출혈의 악화 가능성을 고려하여 진행하지 않았다[6]. 허혈반음영(ischemic penumbra) 영역이 광범위 뇌경색으로 진행할 가능성이 높았기에 응급 풍선혈관성형술을 시행하였으나 CBF를 개선시키지 못하였고 스텐트삽입술까지 시행되었다. 뇌경색이 동반된 뇌하수체졸중 환자에서 응급 풍선혈관성형술이 시행된 환자는 국내에서 1예가 보고된 바 있으나[2] 이후 추가적인 스텐트삽입술을 시행한 환자는 본 증례가 국내외 첫 보고이다.
본 증례에서는 스텐트삽입술을 통해 뇌혈류 및 환자의 증상을 개선시켰으나 출혈 위험성으로 인해 시술 이후 8일 동안 항혈소판제를 투약하지 않은 제한점이 있다. 342명의 뇌하수체 종양 환자들을 뇌하수체졸중이 동반된 군과 그렇지 않은 군으로 분류한 후 이전 항혈전제 복용 여부를 분석한 해외의 후향 연구에 의하면 아스피린(aspirin), 클로피도그렐(clopidogrel) 단독 또는 병용 치료 및 항응고제 치료가 뇌하수체 종양 환자의 뇌하수체졸중 발생 위험성을 증가시키지는 않는 것으로 확인되었다[9]. 하지만 본 증례와 같이 뇌하수체 종양 내부에 출혈이 확인된 이후의 항혈전제 치료에 대한 안정성은 밝혀진 바 없다. 저자들은 항혈소판제 투약으로 인해 종양 내 출혈이 급격하게 확장되어 내경동맥 재압박 및 폐색이 발생할 가능성이 있다고 판단하여 항혈소판제를 투여하지 않았다. 또한 접형동 경유 접근법을 통한 종양 제거술이 예정되어 있었기에 수술 전 항혈소판제 투약은 수술 관련 출혈 위험성을 증가시킬 것으로 생각되었다. 이러한 이유로 8일간 항혈소판제를 투여하지 않았으나 스텐트 내부의 재협착이나 폐색은 발생하지 않았다. 스텐트 내 혈전 및 재협착과 관련된 요인으로는 전순환계 혈관, 혈관의 직경, 협착부 길이, 다발성 스텐트 설치 등이 보고되고 있다[10]. 본 증례에서는 내경동맥의 크기가 상대적으로 크고 혈류량이 많아 재협착이 동반될 위험성이 상대적으로 적었을 것으로 생각된다.
뇌하수체졸중으로 인해 뇌혈관의 압박 및 협착이 발생할 경우 종양 절제술이 근본적인 치료이다. 허혈반음영이 존재하는 경우 즉각적인 수술을 통한 감압이 이루어지지 않는다면 저하된 뇌혈류로 인해 뇌허혈이 진행될 수 있다. 본 증례와 같이 신속한 종양 절제술의 진행이 어려운 경우 응급 풍선혈관성형술 또는 스텐트삽입술과 같은 시술을 고려해 볼 수 있을 것이며 잇따른 종양 절제술이 필요하다. 저자들은 종양 내 출혈의 악화 가능성을 고려하여 항혈소판제를 보류하였으나 출혈 위험성이 높지 않다면 스텐트 설치 이후 혈전 및 재협착을 방지하기 위해 항혈소판제가 병용되어야 할 것이다. 저자들은 출혈성 뇌하수체 종양으로 인해 내경동맥 협착 및 뇌경색이 발생한 환자에서 항혈소판제 투약 없이 신속하게 두개강 내 스텐트삽입술을 시행하여 증상 호전에 성공한 증례를 경험하여 이를 보고한다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




