신경계 중환자실에서의 통증 조절 및 진정
Pain Control and Sedation in Neuro Intensive Critical Unit
Article information
Trans Abstract
Neurocritical patients who can self-report pain use the 0-10 numerical rating scale (NRS, verbal or visual form). However, critically ill patients whose nervous systems cannot express pain use the behavioral pain scale (BPS) and the critical care pain observation tool (CPOT) behavioral pain assessment tools. These tools reveal pain-related changes in movement, facial expression, posture, and physiological indicators such as heart rate, blood pressure, and respiratory rate. In pain control, it is first essential to reduce unnecessary painkillers through non-drug therapy and maximize the effect of the administered analgesics. For non-neuropathic pain, narcotic analgesics such as fentanyl, hydromorphone, morphine, and remifentanil are administered intravenously. Gabapentin, pregabalin, and carbamazepine are recommended along with narcotic analgesics for neuropathic pain control. In addition, non-narcotic analgesics for multi-modal analgesia are used to reduce the use of narcotic analgesics or the side effects of narcotic analgesics. In the intensive care unit (ICU), the sedation-agitation scale (SAS) and the Richmond agitation-sedation scale (RASS) are used to determine the depth of sedation to be maintained during shallow or deep sedation, considering the condition of the critically ill patient. When selecting sedatives for critically ill patients, preferentially consider nonbenzodiazepines such as propofol or dexmedetomidine rather than benzodiazepines such as midazolam or lorazepam. In addition, patients use painkillers or sedatives for over a week, and neurological changes or physiological dependence may occur. Therefore, clinicians should evaluate the critically ill patient’s condition, and sedatives and painkillers should be reduced or discontinued.
서 론
신경계 중환자실에서 치료받는 동안 중환자는 안정할 시기뿐만 아니라 기계환기(mechanical ventilator), 침습적인 시술(procedure), 간호, 외상 또는 동반 질병으로 중등도(moderate)에서 중증(severe)의 통증(pain)이 동반되는 경우가 있다. 특히 신경계 중환자는 의료진에게 통증을 표현하지 못하는 경우가 흔하기 때문에 통증이 조절되지 않아 육체적인 고통을 포함하여 섬망(delirium), 초조(agitation) 및 흥분(irritability)이 나타날 수 있다[1]. 이를 조절하기 위해 깊은 수준의 진정(sedation)을 시행한 경우에는 중환자실 재원 기간(length of stay, LOS) 및 기계환기 기간이 길어지며 사망률(mortality)이 증가하는 등의 나쁜 예후를 초래한다. 또한 신경계 중환자에서 진통제(analgesics)와 진정제(sedative)를 사용하는 경우에는 사용한 진통제와 진정제가 환자의 의식 수준에 영향을 미치는 정도와 뇌압(intracranial pressure), 뇌혈류량(cerebral blood flow) 및 뇌관류압(cerebral perfusion pressure)에 미치는 변화를 고려하여 뇌압 상승, 뇌산소 분압 저하, 경련(seizure) 등이 발생하지 않도록 주의해야 한다[2,3]. 그러므로 적절한 통증 조절 및 진정을 위해서는 신경계 중환자에 대한 의료진의 지속적이고 정확한 평가가 필요하며, 이에 따른 적절한 약물 선택 및 용량 조절과 같은 전략이 중요하다. 본 논문에서는 신경계 중환자실 환자의 통증 조절과 진정에 대하여 실제 진료에 적용할 수 있는 내용을 소개하고자 한다.
본 론
1. 통증(pain)
통증은 실제적이거나 잠재적인 조직 손상과 관련된 불쾌한 감각과 감정적 경험을 말한다[4]. 중환자의 경우 치료와 감시를 위해 삽입된 카테터나 배액관 또는 기관 내 삽관, 기도 흡인, 체위 변경 등의 일상적인 간호 과정 및 침상에 오래 누워 있는 것만으로도 통증이 발생할 수 있다. 그러나 신경계 중환자의 경우에는 의식 변화, 기계환기, 진정제 또는 근이완제 사용 등으로 인하여 자신의 통증을 적절하게 표현하지 못하는 경우가 많다[1]. 이러한 통증을 조절하지 않으면 빈맥(tachycardia), 심근의 산소 소모 증가, 면역 억제, 지속적인 분해 대사(catabolism) 등의 스트레스 반응으로 나타나게 된다[5]. 따라서 신경계 중환자에서 통증 발생 시 적절한 조절이 필요하나, 통증은 매우 개별적이고 주관적이기 때문에 통증의 평가와 통증 치료에 대한 반응은 적합한 방법에 의해 규칙적으로 평가되고 체계적으로 조절되어야 한다.
1) 통증의 평가(pain assessment)
통증을 평가할 때는 환자가 주관적으로 표현하는 통증의 정도를 표준화하여 반영해야 하므로 우선적으로 환자에게 통증의 여부를 물어보고 통증의 정도를 확인하는 것이 중요하다. 통증을 평가하는 도구 중 0-10 수치 통증 척도(numerical rating scale, NRS)는 환자가 스스로 자신의 통증 강도를 0에서 10까지 선택하는 척도로, 3점 이하는 적절한 통증 조절을 나타내고 10점은 가장 극심한 통증을 나타낸다(Fig. 1). 스스로 통증 표현(self-report)이 가능한 중환자의 경우에는 0-10 NRS (구두 또는 시각적 형식)가 비교적 효과적이고 중환자실에서도 사용 가능한 도구이다. Verbal descriptor scale (VDS)은 다양한 통증의 정도를 10 cm의 수평선에 ‘무통’에서 ‘매우 심한 통증 또는 극도로 심한 통증’의 설명 문구로 표시하여 나타내는 설명적인 통증 평가 도구이다[6]. 0-10 faces pain scale (FPS)도 사용하기 쉬워서 통증 강도를 평가하는 데 유용하며 VDS와 높은 상관관계를 나타낸다. 지금까지 설명한 통증 평가 도구들은 등급표를 읽지 못하거나 이해하지 못하는 환자에게 적용하기 어렵다는 단점이 있으나, 통증 강도를 스스로 표현할 수 있는 중환자들에게 직접 적용되고 있다[7].
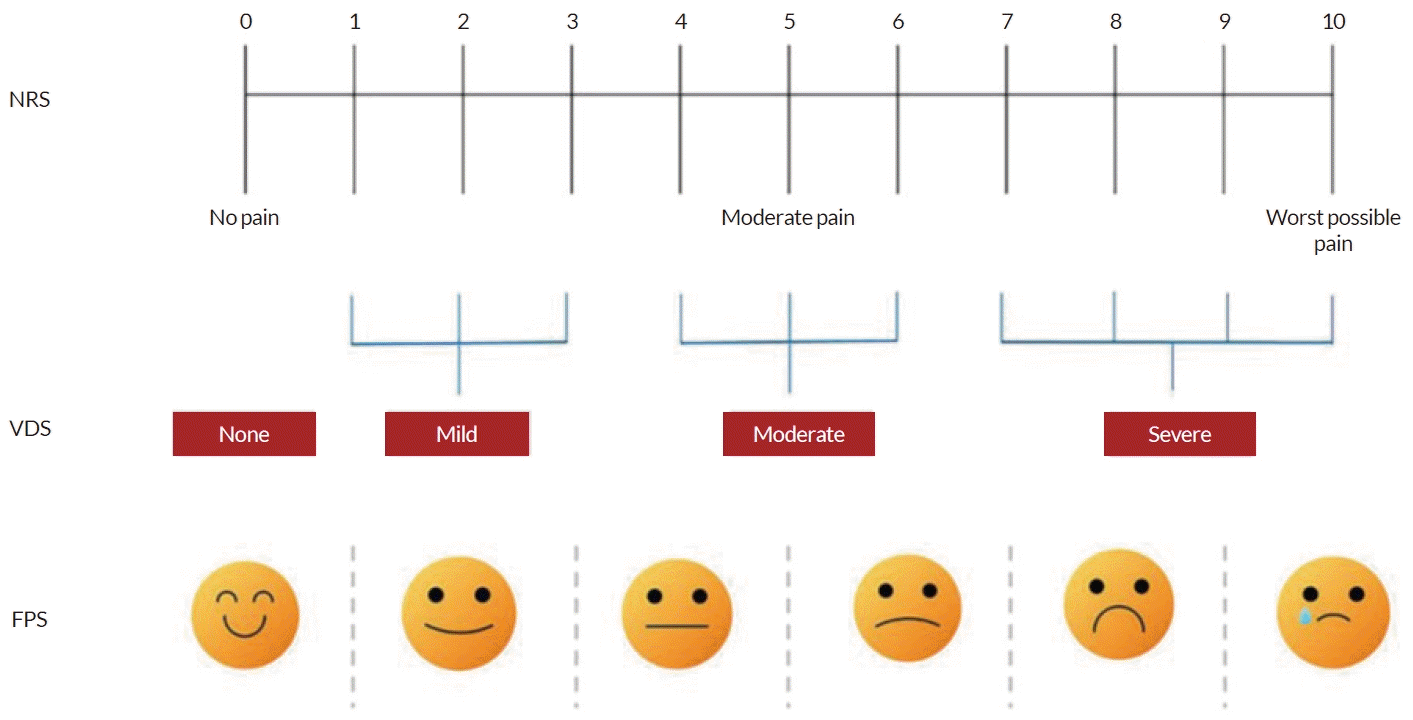
Pain assessment tool. NRS; numeric rating scale, VDS; verbal descriptor scale, FPS; faces pain scale.
하지만 대부분의 신경계 중환자들은 의사 표현이 불가능한 경우가 많아 앞에서 설명한 척도를 사용하기에는 제한적이다. 그래서 신경계 중환자들의 통증을 평가하기 위해 환자들의 통증과 관련된 움직임, 표정, 자세와 심박수, 혈압, 호흡수와 같은 생리 지표의 변화를 이용하는 행동 통증 평가 도구(behavioral pain assessment tools)를 사용한다. 대표적인 행동 통증 평가 도구에는 behavioral pain scale (BPS)과 critical-care pain observation tool (CPOT)이 있다. 이 두 가지 평가 도구들은 중환자들의 통증 정도를 평가하는 데 유효하고 신뢰할 수 있는 도구들이다(Table 1) [8,9]. BPS는 3점에서 12점까지로 측정할 수 있고, 3-5점이 적절한 통증 관리 범위이다.
2) 통증 조절(pain management)
(1) 진통제 선택 시 고려 요인(checkpoints for analgesia choice)
통증의 조절을 위해서는 무엇보다도 중환자의 통증 원인을 파악하여야 하고, 적절한 체위 유지, 빛, 소음 등의 물리적인 자극 제거, 적절한 수면 유지, 침상 내 재활운동 등을 통해 환자의 불안감을 최소로 하고 안락함을 유지할 수 있는 비약물 요법이 선행되어야 한다[10]. 이러한 비약물 요법을 통해 환자에게 불필요한 진통제 사용을 줄이고, 투여된 진통제의 효과를 최대화하는 것이 중요하다. 하지만 신경계 중환자들은 불가피하게 진통제 사용을 하게 되는 경우가 많아 환자의 상태를 고려하여 진통제의 약리 정보, 비용 등을 포함하여 적절한 진통제를 선택하여야 한다[11]. 중환자의 경우에는 간 또는 신장의 혈류가 감소하여 약물의 대사 및 청소율이 변화할 수 있어 약물을 지속적으로 주입하면 약동학(pharmacokinetics)에 영향을 줄 수 있다[12]. 또한 비만이나 저체중인 중환자의 경우 약물 분포 용적(volume of distribution)에 영향을 주고, 소화기 질환이 있거나 유전 소인에 따라 약물의 반응 및 대사에 차이가 있을 수 있다[2].
통증 조절을 위해 사용하는 진통제가 신경계 중환자에게 경련을 유발하는 경우도 있다. 트라마돌(tramadol), 펜타닐(fentanyl), 메페리딘(meperidine), 케타민(ketamine), 메페남산(mefenamic acid)을 사용하거나, 벤조다이아제핀(benzodiazepines) 계열의 해독제로 쓰이는 플루마제닐(flumazenil)을 사용하는 경우에도 경련을 유발할 수 있는 것으로 알려져 있다[2,13]. 따라서 이전에 경련을 경험하였거나 항경련제를 복용하고 있는 환자 또는 경련의 역치를 저하시킬 수 있는 약제를 투여받고 있는 환자에서는 진통제 처방에 유의해야 하며, 약물의 투여 시작 시점이나 용량 변경 시 부작용을 주의 깊게 감시해야 한다[10]. 신경계 중환자에서는 중추신경억제제(central nervous system depressant)를 병용 투여하는 경우가 흔하기 때문에 중추신경 억제 작용뿐만 아니라 약물로 인한 호흡 억제, 저혈압, 깊은 진정 효과 또는 의식 저하가 동반될 수 있다[10,14].
(2) 진통제 종류 및 부작용(types of analgesia and side effects)
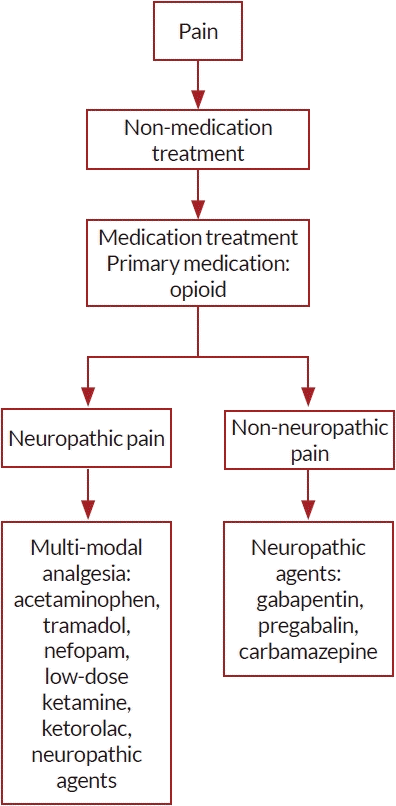
중환자실에서 사용할 수 있는 진통제로는 마약진통제인 아편유사제(opioid), 비마약진통제인 비스테로이드소염제(nonsteroidal anti-inflammatory drug), 아세트아미노펜(acetaminophen, paracetamol), 케타민(ketamine) 등이 있다(Tables 2, 3). 비신경병증 통증의 경우 펜타닐(fentanyl), 히드로모르폰(hydromorphone), 모르핀(morphine) 및 레미펜타닐(remifentanil) 등의 마약진통제를 정주할 것을 추천하고 있다. 신경병증 통증의 경우 가바펜틴(gabapentin), 프레가발린(pregabalin), 카바마제핀(carbamazepine)과 같은 항경련제가 마약진통제와 더불어 추천된다[2,15]. 아편유사제의 사용을 줄이고 통증 조절 효과를 증가시키려면 다중 진통제(multi-modal analgesia) 전략이 필요하다. 비마약진통제는 마약진통제의 사용을 줄이거나 부작용을 감소시키기 위해 사용한다(Fig. 2).
① 마약진통제
마약진통제는 μ1아편유사제수용체를 주로 자극하여 진통 작용을 하나, 다른 수용체들에도 영향을 미쳐 호흡 저하나 진정 효과를 나타낼 수 있다. 마약진통제 사용 시 환기량은 유지되나 호흡수는 저하되는 slow and deep respiration 양상을 보이기 때문에 벤조다이아제핀에 의한 호흡 억제 패턴과 구분할 수 있다[16].
모르핀은 체내에서 분해되어 활성 대사물질(active metabolites)로 변화한 후 작용하기 때문에 작용 시간이 비교적 길다. 또한 활성 대사물질이 신장에 축적될 수 있어 신기능이 저하된 중환자에서 사용 시 주의가 필요하다[15]. 그리고 히스타민 분비를 증가시켜 혈관 확장, 혈압 저하, 장운동 저하가 나타날 수 있어 사용에 주의가 필요하다. 히드로모르폰은 모르핀에 비해 5-10배 강한 진통 효과를 내며, 활성 대사물질을 가지고 있지 않다[15]. 그러나 신기능 저하 시 약물이 체내로 축적되어 혈중 농도가 증가한다. 펜타닐은 작용 시간이 빠르지만 지용성 물질로 지방 조직에 축적되어 약물 중단 후에도 장기적인 약물 효과가 나타날 수 있으므로 주의해야 한다[17]. 레미펜타닐은 작용 시간이 빠르고 혈액 내 혈장의 에스터분해효소(esterase)에 의해 불활성화되므로 간 및 신기능 저하에 영향을 받지 않는다는 특징이 있다[18]. 특히 작용 발현이 빠르고 작용 지속 시간이 짧아 신경계진찰을 자주 평가해야 하는 신경계 중환자들에게 약물 주입을 잠시 중단하고 사용할 수 있는 유용한 약제이다[15].
마약진통제는 내성 작용이 있어 이전과 동일한 진통 효과를 위해서는 약제를 증량해야 하는 단점이 있다. 또한 통각 과민(hyperalgesia) 같은 통증에 대한 과민성이 레미펜타닐과 같은 속효성 약물에서 발생할 수 있다. 특히 레미펜타닐은 빠른 시간 내에 대사되므로 약제 중단 시 바로 진통 조절이 되지 않는 상황이 발생할 수 있다[2,18].
② 비마약진통제
ㄱ. 케타민(ketamine)
케타민은 강력한 진통 작용을 하나 호흡 억제가 적고 기관지 확장 효과가 있다. 또한 교감신경계를 활성화시켜 혈압과 심박수를 증가시키며 장운동을 감소시키지 않는다. 그러나 혈압 상승과 심근의 산소 소모를 증가시켜 관상동맥 질환, 심부전 및 치료되지 않은 동맥류가 있는 환자에서 사용 시 주의가 필요하다[19]. 또한 케타민은 N-methyl-D-aspartate (NMDA) 수용체길항제로 작용하여 뇌전증지속상태(status epilepticus)에서 벤조다이아제핀 계열의 약제로 경련이 조절되지 않을 때 추가적으로 투여해 볼 수 있다[20]. 그러나 신기능이나 간기능이 저하된 중환자에서는 활성 대사물질인 norketamine이 축적될 수 있고, 과다 침분비, 구역, 구토, 환각, 섬망, 불쾌감 등이 부작용으로 나타날 수 있어 사용 시 환자 모니터링이 필요하다[2].
ㄴ. 비스테로이드소염제
비스테로이드소염제에는 대표적으로 근주(intramuscular, IM)하여 사용하는 케토롤락(ketorolac)과 이부프로펜(ibuprofen)이 있다. 비스테로이드소염제는 중환자에게 간헐적으로 발생하고 심하지 않은 급성 통증 조절을 위해 사용하며, 마약진통제의 요구량을 감소시킨다. 근주 후 케토롤락의 진통 효과는 1시간 내에 나타나기 시작하여 2시간 뒤 최대로 도달하고 5-6시간 지속된다. 케토롤락 30 mg은 모르핀 4 mg과 동등한 진통 효과를 나타낸다. 케토롤락과 아편유사제를 함께 투여하면 아편유사제 용량을 25-50%까지 줄일 수 있다.
비스테로이드소염제는 염증 반응에서 중요한 효소인 고리산소화효소(cyclooxygenase, COX)를 비선택적, 경쟁적으로 억제하여 진통 효과를 나타낸다. 부작용으로는 위장관 출혈과 혈소판 억제로 인한 출혈, 신부전 등이 동반될 수 있다. 혈소판 억제 작용 때문에 출혈 부작용이 의심되는 환자나 뇌출혈이 동반된 신경계 중환자에서는 사용 빈도가 낮지만, 출혈 부작용이 낮은 환자의 해열 진통 작용을 위해 사용해 볼 수 있다[2].
ㄷ. 아세트아미노펜(acetaminophen)과 트라마돌(tramadol)과 네포팜(nefopam)
아세트아미노펜은 경도나 중등도의 급성 통증과 발열에 투여하는 진통제로, 경구(acetaminophen, paracetamol) 및 정맥(propacetamol HCl)으로 투여 가능하다. 비스테로이드소염제와 달리 아세트아미노펜은 항염증 효과가 없고, 혈소판 억제 작용 및 위장 장애가 적다. 그러나 장기 사용이나 과용량으로 투여할 경우에는 독성을 유발할 수 있고, 와파린(warfarin)과 약물 상호작용 효과가 있어 프로트롬빈 시간(prothrombin time)을 연장시킬 수 있으므로 주의해야 한다[2].
트라마돌은 중추신경에서 μ아편유사제 수용체를 자극하고, 세로토닌과 노르에피네프린의 재흡수를 억제하여 진통 효과를 나타낸다. 부작용으로 경련의 역치를 낮출 수 있고, 호흡 억제를 유발할 수 있으므로 사용 시 주의가 필요하다[2].
네포팜(nefopam)은 도파민, 노르아드레날린 및 세로토닌 재흡수를 억제하여 진통 효과를 나타낸다. 네포팜 20 mg은 모르핀 6 mg과 동등한 효과를 나타낸다.
2. 진정(sedation)
중환자들은 앞에서 기술한 통증을 포함하여 호흡 부전, 약물 금단증후군(withdrawal syndrome) 및 부작용 같은 요인과 대사장애, 전해질장애, 내분비장애와 같은 내과적인 문제, 침습적인 치료 및 시술 등 다양한 원인에 의해 자주 흥분하고 불안한 증상을 나타낼 수 있다[21]. 중환자에서 흥분, 불안 및 초조는 중환자에게 나쁜 예후를 초래할 수 있어 증상에 대해서는 정확한 평가 및 적절한 조절이 필요하다. 적절한 증상 조절만으로도 추가적인 진정제 없이 환자의 안정을 유지할 수도 있다[10,22]. 그러나 대부분 진정제 투여가 필요한 경우가 훨씬 많다. 적절한 진정제의 사용은 중환자의 스트레스를 완화시키고 시술과 처치가 용이하도록 도와주며, 환자의 안전을 유지하는 데 도움이 되므로 중환자 치료에 필수적이다[23]. 하지만 과도하고 무분별한 진정제 사용으로 인해 발생하는 부작용에 대해서는 주의하여야 한다. 따라서 적절한 진정 요법을 위해서는 진정 깊이에 대해 미리 결정하고, 평가 도구를 활용하여 수시로 진정 수준을 평가하며, 이에 따라 진정제의 종류와 용량을 조절하는, 신경계 중환자에 대한 체계적인 치료 전략이 필요하다[10].
1) 진정 평가(sedation assessment)
적절한 진정을 위해서는 진정 상태에 대한 객관적인 평가가 필요하다. 이상적인 평가를 위해서는 의료진이 평가하기 편리하고 중환자에 대한 진정 수준이 명확하게 분리되어 있으며, 평가된 진정 수준에 따라 진정제 사용량의 조절이 가능하고 중환자들에게 사용하기 효과적이며 신뢰성이 높은 평가 도구를 사용해야 한다. 여러 가지 진정 평가 도구 중 중환자실에서는 sedation-agitation scale (SAS)과 Richmond agitation-sedation scale (RASS)을 가장 많이 사용하고 있다. SAS는 Ramsay scale을 바탕으로 흥분 정도를 좀 더 세분화한 평가 도구이다(Table 4) [24,25]. RASS는 각성 상태, 인지기능 및 응답에 대한 지속가능성을 바탕으로 평가하는 도구로 SAS와 함께 진정 정도와 깊이를 측정하기 위한 평가 도구로 사용되고 있다[25]. 주관적인 평가 도구 외에 bispectral index (BIS) 같은 진정 수준에 대한 객관적인 평가 도구는 매우 깊은 진정 상태 또는 치료적 근이완제 사용으로 환자 행동이 관찰되지 않을 때 유용하게 사용할 수 있다[1].
2) 진정 조절(sedation management)
(1) 진정제 선택 시 고려 요인(checkpoints for sedatives choice)
진정제를 사용하는 경우 중환자의 상태를 고려하여 얕은 진정(light sedation) 또는 깊은 진정(deep sedation) 중 유지하고자 하는 진정 깊이에 대해 결정한다. 대부분의 경우 얕은 진정을 목표로 하는데, 불필요한 약물 사용과 부작용을 줄이고 목표로 하는 수준의 진정 상태를 유지하여야 한다. 깊은 진정에 비해 얕은 진정을 시행하는 것은 중환자의 수면 주기가 적절하게 유지되도록 하며 기계환기 적용 시간 감소, LOS와 병원 입원 기간 감소, 섬망 발생 감소와 관련이 있다. 진정 깊이를 결정할 때 RASS를 사용하여 얕은 진정을 유지하는 경우 0점에서 -2점으로 진정제를 조절한다.
신경계 중환자에서 혈역학적으로 불안정하거나 심한 저산소증이 동반된 경우 또는 뇌압 상승에 대한 치료 혼수 요법 등을 시행하는 경우 깊은 진정이 필요하다. 혈역학적으로 불안정한 저산소증이 동반된 중환자에게는 진정제 투여를 통해 조직의 산소 소모를 줄이고 기계환기를 원활하게 할 수 있다. 뇌압이 상승한 경우에는 진정제 투여를 통해 뇌압 감소 효과를 기대할 수 있으며, 뇌전증지속상태에서는 지속적인 뇌파 검사를 통해 경련을 조절할 수 있다. 깊은 진정을 유지하고자 할 때에는 RASS 점수 -3점에서 -5점으로 진정제를 조절한다
진정제 사용을 중단하였을 때 약물 혈중 농도가 50%까지 감소하는데 소요되는 시간을 의미하는 상황민감반감기(context-sensitive half life, context-sensitive half time)가 매우 중요하다(Fig. 3) [26,27]. 중환자실에서 사용한 모든 진통제, 진정제는 사용한 시간이 지남에 따라 혈액, 지방 및 중추 신경계수용체 등 각종 구획(compartment) 사이에 존재하는 약물의 농도 차에 의하여 혈중 농도가 변하게 된다. 그러므로 상황민감반감기는 주입한 약물의 분포와 대사에 따라 다르며 일반적으로 주입되는 시간이 길어질수록 길어지게 된다. 벤조다이아제핀, 모르핀, 펜타닐 같은 약물은 정주 시간이 길어짐에 따라 상황민감반감기가 늘어나며 프로포폴, 레미펜타닐(remifentanil)은 상대적으로 영향이 적다[2].
(2) 진정제 종류 및 부작용(types of sedatives and side effects)
진정제는 신체 전반적인 영향과 뇌의 생리에 많은 영향을 미치기 때문에 환자의 특성도 반드시 고려해야 한다(Table 5). 기계환기를 적용하고 있는 중환자에서 진정제를 선택하는 경우에는 미다졸람(midazolam)이나 로라제팜(lorazepam) 등의 벤조다이아제핀보다는 프로포폴이나 덱스메데토미딘 등의 비벤조다이아제핀(nonbenzodiazepine)을 우선적으로 고려한다. 프로포폴과 벤조다이아제핀을 비교한 연구에서 프로포폴은 벤조다이아제핀에 비해 얕은 진정 유도 시간을 평균 7.2시간, 기관 내 발관(extubation) 시간을 평균 11.6시간 단축시켰다. 덱스메데토미딘과 벤조다이아제핀을 비교한 연구에서 덱스메데토미딘은 벤조다이아제핀에 비해 기관 내 발관 시간을 평균 1.9일 단축시켰고, 기계환기 기간을 단축시켰으며, 섬망 발생률을 유의하게 감소시켰다. 중환자에서 벤조다이아제핀을 진정제로 선택할 경우 섬망 발생의 빈도, 기계환기의 적용 일수, LOS가 증가하는 것으로 알려져 있다.
① 벤조다이아제핀(benzodiazepines)
미다졸람과 로라제팜은 중환자실에서 대표적으로 사용하는 진정제이다. 미다졸람은 작용 시간이 빠르고 반감기가 짧으나 장기간 사용 시 지방 조직에 축적되므로 지속 사용 시 상황 민감반감기를 고려하여야 한다[28,29]. 또한 간기능이나 신기능이 감소된 중환자에서 반감기가 연장될 수 있어 사용 시 주의해야 한다. 로라제팜의 경우 프로필렌글라이콜(propylene glycol) 독성으로 인해 심한 젖산산증(lactic acidosis)을 유발할 수 있어 지속 주입 시 주의하여야 한다[30]. 장기적으로 진정이 필요한 환자에서는 로라제팜의 간헐적 약덩이(bolus) 투여가 선호된다. 로라제팜은 미다졸람과 달리 신부전이나 간부전에 영향을 받지 않는다[30]. 다이아제팜(diazepam)은 작용 발현이 빠르고 근육 이완 효과가 있다. 그러나 반감기가 길고 혈압 강하의 부작용이 동반될 수 있어 중환자의 진정 목적으로는 잘 사용되지 않는다.
벤조다이아제핀 약덩이 투여는 간헐적인 초조를 조절하기 위해 시도해 볼 수 있지만, 지속 주입은 혈액량이 감소한 환자에서 저혈압을 유발할 수 있고, 섬망 발생의 위험이 있으며, 기계환기 기간을 연장시키는 결과를 초래한다. 따라서 금단 증상, 알코올 금단 증상, 진전섬망, 경련 등을 조절하는 경우가 아니라면 단순한 진정 목적으로 중환자에게 벤조다이아제핀을 투여하는 것은 추천되지 않는다. 벤조다이아제핀의 해독제는 플루마제닐(0.3-2.0 mg, intravenous, IV)을 사용하는데, 뇌전증 환자 또는 경련 역치가 감소한 환자에게서 플루마제닐을 사용하는 경우 경련 발생 위험이 있어 주의가 필요하다.
② 프로포폴(propofol)
프로포폴은 지용성으로 정맥 투여 후 혈액뇌장벽(blood-brain barrier)을 신속하게 투과하여 빠른 진정 효과를 나타내나 진통 효과는 없다[31]. 지속 주입을 중단하는 경우에는 다른 약제에 비해 의식 회복이 빠른 점이 특징이다. 프로포폴은 간에서 불활성 대사물로 전환되어 신장으로 배설되며, 제거반감기(elimination half life)는 3-12시간으로 간부전이나 신부전 환자에서도 유의한 약물역동학 변동은 유발하지 않는다[14].
프로포폴은 뇌 대사율을 낮추고 뇌압을 감소시키는 효과가 있어 뇌압이 상승된 신경계 중환자에서 사용 시 뇌압 감소에 도움이 될 수 있다. 또한 항경련 효과로 인해 뇌전증지속상태의 중환자에서도 사용할 수 있다. 그러나 혈관 확장 효과(vasodilation effect)로 인한 저혈압이 유발될 수 있어 약덩이로 급속히 주입하거나 저혈량(hypovolemia)이 동반된 환자에게 주입하는 경우 주의해야 한다[31].
약물 전달체로 사용되는 긴사슬중성지방(long-chain triglycerides)은 1.1 kcal/mL의 열량이 포함되어 있어 프로포폴을 사용한 중환자의 경우 하루 동안 제공한 총 칼로리에 포함시켜야 하며 고칼로리, 고중성지질혈증의 부작용이 발생할 수 있다[32]. 고용량의 프로포폴을 장기간 투여하는 경우 프로포폴주입증후군(propofol infusion syndrome, PIS)이 동반될 수 있어 70 μg/kg/min 이상의 주입 속도로 장기간 이상 사용하는 것은 바람직하지 않다. PIS는 고칼륨혈증, 간비대, 고중성지질혈증, 대사산증, 횡문근융해, 불응서맥, 심근 억제, 신부전을 유발할 수 있으며 PIS 발생 시 사망률이 높다[32].
중환자의 진정 목적으로 프로포폴과 덱스메데토미딘의 사용을 비교한 연구에 의하면, 두 약제 모두 비슷한 빈도로 심각한 저혈압과 서맥(bradycardia) 부작용을 발생시켰다. 간혹 프로포폴의 페놀 대사산물(phenolic metabolite)이 소변으로 배출되기 때문에 소변 색깔이 초록색으로 변하는 경우가 있다. 이 자체가 위험한 부작용은 아니지만, 이에 대해 불필요한 검사를 하지 않는 것과 프로포폴 용량을 줄이는 조치를 취하는 것이 바람직하다.
③ 덱스메데토미딘(dexmedetomidine)
덱스메데토미딘은 중추신경계의 α2수용체작용제로서 진정 효과와 진통 효과가 있다. 다른 진정제와 비교 시 유의한 호흡 억제가 없고, 약제 지속 주입 중에도 비교적 쉽게 환자의 각성을 유도할 수 있으며, 기억상실(amnesia) 부작용이 없다는 점에서 신경계 중환자에 사용할 수 있는 유용한 약제로 알려져 있다[33,34]. 기관 내 삽관이나 기계환기를 적용하지 않고 환자를 진정시켜야 하는 경우나 진정 상태에서도 환자를 깨워 신경계 진찰을 해야 하는 경우에 유용하게 사용된다.
덱스메데토미딘은 미다졸람에 비해 섬망을 유발하는 확률이 낮아 섬망이 있거나 섬망의 발생 위험이 높은 환자에서 사용을 고려할 수 있다[35]. 약물의 반감기는 약 2시간으로 짧지만, 간부전 환자에서는 연장될 수 있다. 부작용으로는 서맥이나 저혈압이 흔하여 서맥, 부정맥, 심부전, 저혈량, 저혈압 환자에게 사용하는 경우에는 주의가 필요하다. 이러한 약리작용을 이용하여 발작적인 고혈압, 빈맥, 빠른 호흡, 발한, 발열, 근긴장 이상(dystonic posturing)을 특징으로 하는 돌발 교감 신경 과다 활동(autonomic storming, paroxysmal sympathetic hyperactivity) 환자에서 고혈압, 빈맥, 초조 증상을 조절하기 위해 사용하는 경우도 있다.
(3) 진정 중단(discontinuation of sedatives)
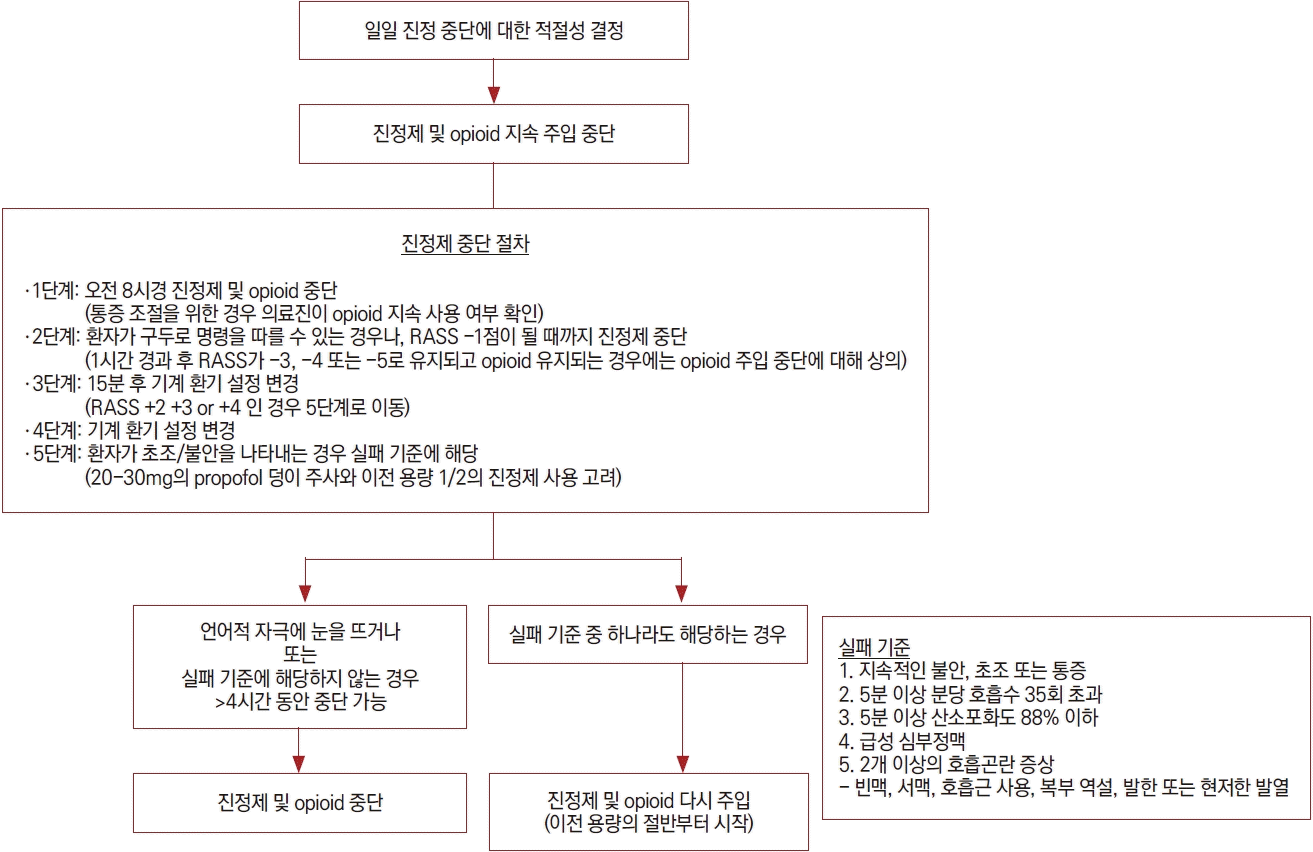
진통제나 진정제를 일주일 이상 사용하는 중환자에서는 신경계 변화나 생리적 의존성이 나타날 수 있어, 진통제나 진정제를 갑자기 중단하게 되면 금단 증상이 나타날 수 있다. 따라서 환자의 상태를 감안하여 진통제나 진정제 필요 여부에 대해 매일 재평가하고 필요시 약물 용량도 재조정하여야 한다. 질병의 상태가 호전을 보이고 진정제 투여의 필요성이 낮아지면 진정제와 진통제를 감량하거나 중단해 보아야 한다(Fig. 4) [36].
벤조다이아제핀 금단 증상 및 징후는 근육통, 떨림, 두통, 메스꺼움, 발한, 피로, 불안, 흥분, 지각기능장애, 빛과 소리에 대한 민감성 증가, 근육경련, 근간대경련수축, 수면장애, 섬망이 있으며, 프로포폴 금단 증상은 벤조다이아제핀 금단 증상과 유사하다. 중환자실에 7일 이상 입원했거나 로라제팜을 35 mg/day 이상 투여한 경우 금단 증상 발병 위험이 높아진다[37].
간헐적으로 진통제나 진정제를 투여하는 경우 지속형 약물로 전환하는 것이 금단 증상 예방에 도움이 된다. 지속적인 약물 주입률을 20-40%까지 낮춘 후에 환자의 반응에 따라 12-24시간마다 추가로 10%씩 감량하는 것도 금단 증상 완화에 도움이 된다. 장시간 작용 경구 제제(옥시코돈 등)나 아편유사제 부착포(opioid patch)로 변경하거나, 덱스메데토미딘을 추가하는 것도 도움이 될 수 있다[35].
결 론
스스로 통증 표현이 가능한 신경계 중환자들은 0-10 NRS(구두 또는 시각적 형식)를 이용하며, 통증 표현이 불가능한 신경계 중환자들은 통증과 관련된 움직임, 표정, 자세와 심박수, 혈압, 호흡수 같은 생리 지표의 변화를 이용하는 BPS과 CPOT 등의 행동 통증 평가 도구를 사용한다. 통증 조절에는 우선적으로 비약물 요법을 통해 불필요한 진통제 사용을 줄이고 투여된 진통제의 효과를 최대화하는 것이 중요하다. 비신경병증 통증의 경우 펜타닐, 히드로모르폰, 모르핀 및 레미펜타닐 등의 마약진통제를 정주하고, 신경병증 통증 조절에는 가바펜틴, 프레가발린, 카바마제핀이 마약진통제와 더불어 추천된다. 다중 진통제를 위한 비마약진통제는 마약진통제의 사용을 줄이거나 마약진통제의 부작용을 감소시키기 위해 사용한다. 중환자실에서는 SAS와 RASS를 이용하여 중환자의 상태를 고려하여 얕은 진정 또는 깊은 진정 중 유지하고자 하는 진정 깊이에 대해 결정한다. 중환자에서 진정제를 선택하는 경우에는 특정한 경우를 제외하고 미다졸람이나 로라제팜 등의 벤조다이아제핀보다는 프로포폴이나 덱스메데토미딘 등의 비벤조다이아제핀을 우선적으로 고려한다. 진통제나 진정제를 일주일 이상 사용하면 신경계 변화나 생리적 의존성이 나타날 수 있어, 중환자의 상태를 평가하여 진정제와 진통제를 감량하거나 중단을 시도하여야 한다.