| J Korean Neurol Assoc > Volume 40(1); 2022 > Article |
|
Abstract
Delayed stenosis of the treated artery following mechanical thrombectomy is known to occur in approximately 10% of the patients after the procedure. It is usually asymptomatic, and was frequently found within 1 year after the procedure. Here we report a 58-year-old stroke patient who suffered from recurrent transient ischemic attacks due to a delayed stenosis of the middle cerebral artery 2 years after the mechanical thrombectomy for an abrupt embolic occlusion of the vessel.
기계적 혈전제거술(mechanical thrombectomy)은 두개내대혈관 폐색에 의한 급성허혈 뇌졸중에서 치료 효과가 입증되어 임상현장에서 현재 표준 치료로 사용된다. 특히 최근 수년 동안 신경중재 치료의 기술과 시술기구의 비약적인 발전으로 시술 중 발생하는 합병증 발생은 과거에 비하여 매우 낮아졌다[1]. 기계적 혈전제거술 중에 발생하는 합병증을 최소화하기 위한 노력에도 불구하고 혈전 제거용 스텐트와 혈관벽이 직접 접촉하는 시술의 특성으로 인해서 시술 부위 혈관벽의 손상이 발생할 수 있다. 죽경화협착에 의한 폐색인 경우 기계적 혈전제거술 이후에도 재폐색으로 인한 혈관성형술, 스텐트 삽입술 등의 추가 시술이 흔히 필요하다[2]. 색전뇌경색의 경우에도 성공적인 기계적 혈전제거술 후 영상에서 혈관손상이 관찰되지 않았던 환자에서도 지연협착이 나타날 수 있으며, 현재까지 알려진 바로는 이와 같은 지연협착은 대부분 무증상이고 추적 검사에서 협착이 호전되었다[3-5]. 본 증례는 기존 보고와는 달리 중간대뇌동맥의 색전성 폐색에 대한 성공적인 혈전제거술 2년 후에 같은 부위에서 발생한 심한 국소협착과 이로 인한 반복적인 일과성허혈발작을 보인 환자이며 지연협착의 발생 기전에 대한 고찰과 함께 보고하고자 한다.
59세 남자가 반복되는 왼쪽 상하지 근력약화 및 감각 이상으로 응급실을 방문하였다. 환자는 2년 전 심방세동에 의한 오른쪽 중간대뇌동맥의 급성폐색(Fig. 1-A)으로 병원을 방문하였고, 당시 Solitaire 카테터(EV3, Irvine, CA, USA)를 이용한 혈전제거를 시도하였으나 실패하였고 이후 흡입 카테터인 ACE68 (Penumbra, Alameda, CA, USA)을 이용여 혈전을 제거하였다(Fig. 1-B). 시술 당일 시행한 뇌자기공명영상 확산강조영상에서 이미 오른쪽 중간대뇌동맥 영역의 고신호강도가 관찰되었으나(Fig. 1-C) 혈관조영술에서 시술 부위의 혈관 손상은 관찰되지 않았다(Fig. 1-D). 기계적 혈전제거술 시행 6개월 뒤 흉통으로 응급실을 방문하여 시행한 뇌 컴퓨터단층촬영 혈관조영술에서 오른쪽 중간대뇌동맥의 뚜렷한 이상은 관찰되지 않았다(Fig. 1-E). 환자는 첫 뇌경색으로 인한 왼쪽 상하지 마비는 상당히 호전되어 보행기를 통해 보행가능한 정도로 회복되었다. 응급실 방문시에 혈압은 208/102 mmHg, 맥박 67/분, 호흡수 20/분, 체온 36.6도였다. 뇌자기공명영상에서 급성뇌경색을 시사하는 소견이 관찰되지 않았으나 오른쪽 중간대뇌동맥의 심한 국소협착이 새롭게 관찰되었다(Fig. 1-F, G). 디지털 감산혈관조영술(digital subtraction angiography)에서 2년 전 기계적 혈전제거술이 시행된 오른쪽 중간대뇌동맥 M1 분절 중간 부위에 심한 협착이 관찰되었다(Fig. 1-H). 3-Tesla 두개내혈관벽 자기공명영상(intracranial vessel wall magnetic resonance imaging)에서 중간대뇌동맥의 M1 부위 국소적인 혈관벽 비후 소견이 관찰되었고(Fig. 2-A, D) 조영제 주사 후 촬영에서 혈관벽에 경도의 불균일한 조영증강이 관찰되었다(Fig. 2-C, F). 그 외 이중 내강, 내막 절편(intimal flap), 혈관벽 출혈(intramural hematoma) 등의 혈관박리를 시사하는 소견은 관찰되지 않았다(Fig. 2-A, B, D, E). 환자에게 심방세동으로 복용 중이던 아픽사반(apixaban)에 더해 아스피린(aspirain) 100 mg, 클로피도그렐(clopidogrel) 75 mg을 새롭게 투여하였고 기존에 복용 중이던 아토바스타틴(atorvastatin) 10 mg을 로수바스타틴(rosuvastatin) 20 mg으로 변경하였다. 입원 기간 중에 기존에 복용 중이던 항고혈압제인 암로디핀(amlodipine) 5 mg, 네비볼롤(nevivolol) 2.5 mg 투여를 중단하였고 생리식염수를 시간당 40 mL 주사하였고 수축기 혈압은 130-150 mmHg 정도로 유지되었다. 일주일 간 입원 후 퇴원 시에 신경계상태가 안정되어 항고혈압제를 다시 투여하기 시작하였고. 이후 증상의 재발은 없었고 퇴원 4개월 후에 시행한 추적 관찰 뇌자기공명영상에서 중간대뇌동맥에 관찰되는 병변의 뚜렷한 변화는 없는 상태였다. 출혈 위험을 감소시키기 위해서 아스피린은 중단하였고 클로피도그렐과 아픽사반을 투여 중이다.
기계적 혈전제거술은 대혈관폐색을 보이는 급성뇌경색에서 매우 효과적인 치료이지만 막힌 혈관에서 기계적으로 혈전을 제거하는 시술의 특성으로 인해서 혈관벽의 손상이 발생할 수 있다. 이러한 의인성(iatrogenic) 혈관벽 손상은 급성 및 지연 손상으로 나눌 수 있는데, 혈관 내 치료를 시행한 직후에 관찰되는 혈관의 박리(dissection), 천공(perforation), 연축(vasospasm)등의 급성 손상이 대부분이지만, 때로는 추적 관찰에서 지연성으로 혈관의 병적 변화가 관찰되는 경우가 있다[1]. 이전 연구에 따르면 기계적 혈전제거술을 시행한 약 1년 뒤에 뇌영상을 추적 관찰하였을 때 39명중 4명(10.3%)에서 새롭게 지연성으로 내경 감소, 혈관벽 비후, 협착 등의 이상소견이 관찰되었고 흥미롭게도 스텐트의 통과 횟수와 지연 혈관손상과는 관련성을 보이지 않았다[5]. 기계적 혈전제거술을 시행 받은 57명을 연구한 또 다른 보고에서는 시술 3개월째에 시행한 뇌 자기공명혈관조영술에서 5명(8.8%)의 환자에서 새롭게 지연 협착이 확인되었다. 지연협착을 보인 환자들은 모두 무증상이었고 12개월째 검사에서 모든 환자에서 협착정도는 호전을 보였다[3]. 두개내혈관벽 자기공명영상 연구에 의하면 기계적 혈전제거술을 받은 경우 해당 동맥벽의 비후와 조영증강이 관찰되었다[6,7]. 따라서 시술 직후에는 개통된 혈관이 정상으로 보이는 경우에도 약 10% 환자에서 지연성뇌혈관협착을 보일 수 있으므로 기계적 혈전제거술을 받은 환자들은 뇌혈관에 대한 장기간의 추적 관찰이 필요하다.
지연혈관협착의 정확한 병태 생리기전은 아직 정확하게 알려져 있지 않지만 잠정적으로 시술 당시 기구와 연관된 혈관벽의 손상이 가설로 제시되고 있다. 실제 동물모델을 이용한 연구에서 급성 뇌혈관폐색을 치료하기 위해서 개발된 다양한 카테터 중에서 흡입 카테터보다는 stentriever가 내피손상을 광범위하게 일으킨다는 것이 확인되었고 치료 대상 혈관의 직경이 작은 경우 손상의 정도가 심했다[8]. 다른 동물모델 연구에서는 기계적 혈전제거술 후에 혈관 표면의 혈소판응집, 중막내에서의 민무늬근육세포층의 분리, 중막의 염증세포 침윤 등의 조직 소견이 확인되었다[9]. 또한 뇌혈관이 혈전에 의해 폐색된 뒤 허혈에 노출된 혈관내막에서 종양괴사인자(tumor necrosis factor-α), 인터루킨(interleukin 1β) 등의 염증 매개 사이토카인이 대량 분비되며 혈관뇌장벽을 구성하는 치밀이음(tight junction)에도 광범위한 손상이 발생하는 것으로 알려져 있다[10]. 이와 같이 취약해진 뇌혈관은 정도의 차이는 있을 수 있으나 기계적 혈전제거술 시행 과정에서 발생하는 의인성 내막손상에 더욱 취약할 것으로 보인다. 따라서 기계적 혈전제거술 후에 지연성으로 발생하는 혈관협착은 초기 뇌혈관 자체의 허혈에 의한 내막의 취약성에 기계적인 손상이 가해진 이후에 시간이 지나며 신생 혈관내막(neointima) 형성 및 중막의 평활근 세포 증식(smooth muscle cell hyperplasia)등에 의해 발행하였을 것으로 추정해볼 수 있다.
결론적으로 본 증례는 색전뇌경색으로 인한 급성폐색에 대한 기계적 혈전제거술 시술 직후 및 6개월 후의 영상검사에서도 혈관 손상의 소견이 관찰되지 않았지만 약 2년 후에 지연되어 발생한 증상성 협착에 대한 보고이다. 따라서 두개강내혈관협착이 없던 색전뇌경색 환자에서도 시술 후 정기적인 뇌혈관검사를 통해 기계적 혈전제거술의 장기 합병증 발생여부를 파악하고 증상을 보이는 경우 적절한 향후 치료 계획을 세우는 것이 필요하다. 또한, 이와 같은 경우 고해상도혈관벽 자기공명영상검사는 지연협착의 병태 생리를 확인하는데 도움이 될 수 있겠다.
REFERENCES
1. Balami JS, White PM, McMeekin PJ, Ford GA, Buchan AM. Complications of endovascular treatment for acute ischemic stroke: prevention and management. Int J of Stroke 2018;13:348-361.

2. Tsang ACO, Orru E, Klostranec JM, Yang IH, Lau KK, Tsang FCP. Thrombectomy outcomes of intracranial atherosclerosis-related occlusions: a systematic review and meta-analysis. Stroke 2019;50:1460-1466.


3. Enomoto Y, Takagi T, Matsubara H, Tsujimoto M, Yoshimura S. Delayed stenosis in the intracranial vessels following endovascular treatment for acute stroke. J. Vassc. Interv. Radiol 2015;26:1814-1819.

4. Kurre W, Pérez MA, Horvath D, Schmid E, Bäzner H, Henkes H. Does mechanical thrombectomy in acute embolic stroke have long-term side effects on intracranial vessels? An angiographic follow-up study. Cardiovasc Intervent Radiol 2013;36:629-636.


5. Eugène F, Gauvrit JY, Ferré JC, Besseghir A, Ronzière T. One-year MR angiographic and clinical follow-up after intracranial mechanical thrombectomy using a stent retriever device. Am. J. Neuroraiol 2015;36:126-132.

6. Kitano T, Matsubara S, Uno M, Yagita Y. Vessel wall enhancement by gadolinium-enhanced MRI in a patient with delayed stenosis after mechanical thrombectomy. Case Reports 2018;2018:bcr2018226252.

7. Power S, Matouk C, Casuabon LK, Silver FL, Krings T, Mikulis DJ. Vessel wall magnetic resonance imaging in acute ischemic stroke: effects of embolism and mechanical thrombectomy on the arterial wall. Stroke 2014;45:2330-2334.


8. Teng D, Pannell JS, Rennert RC, Li J, Li YS, Wong VW. Endothelial trauma from mechanical thrombectomy in acute stroke: in vitro live-cell platform with animal validation. Stroke 2015;46:1099-1106.


9. Yuki I, Kan I, Golshan A, Sohn J, Murayama Y, Vinters HV. A swine model to analyze arterial structural changes induced by mechanical thrombectomy. Am. J. Neuroradiol 2013;34:E87-E90.

10. Clausen BH, Lambertsen KL, Babcock AA, Holm TH, Daganes-Hansen F, Finsen B. Interleukin-1beta and tumor necrosis factor-alpha are expressed by different subsets of microglia and macrophages after ischemic stroke in mice. J. Neuroinflammation 2008;5:1-18.
Figure 1.
Brain magnetic resonance imaging and digital subtraction angiography (DSA) of the patient. (A) An initial DSA showed complete occlusion of the right proximal middle cerebral artery (MCA). (B) Successful revascularization was achieved after the mechanical thrombectomy (MT), and there was no significant residual stenosis or dissection on the post-MT DSA. (C) Post-MT day 1 diffusion-weighted image of the brain showed a territorial infarct on the right hemisphere. (D) Time of flight (TOF) imaging did not suggest vascular injury 1 day after the MT. (E) Computed tomography angiography performed 4 months after the MT showed good patency of the treated MCA. (F) TOF imaging performed 2 years after the MT showed delayed severe stenosis of the treated MCA. (G) Source images of 3D TOF imaging showed an eccentric focal severe stenosis in the same segment (arrowhead). (H) DSA performed 2 years after the MT showed focal severe stenosis in the treated right MCA. MRI; magnetic resonance imaging.
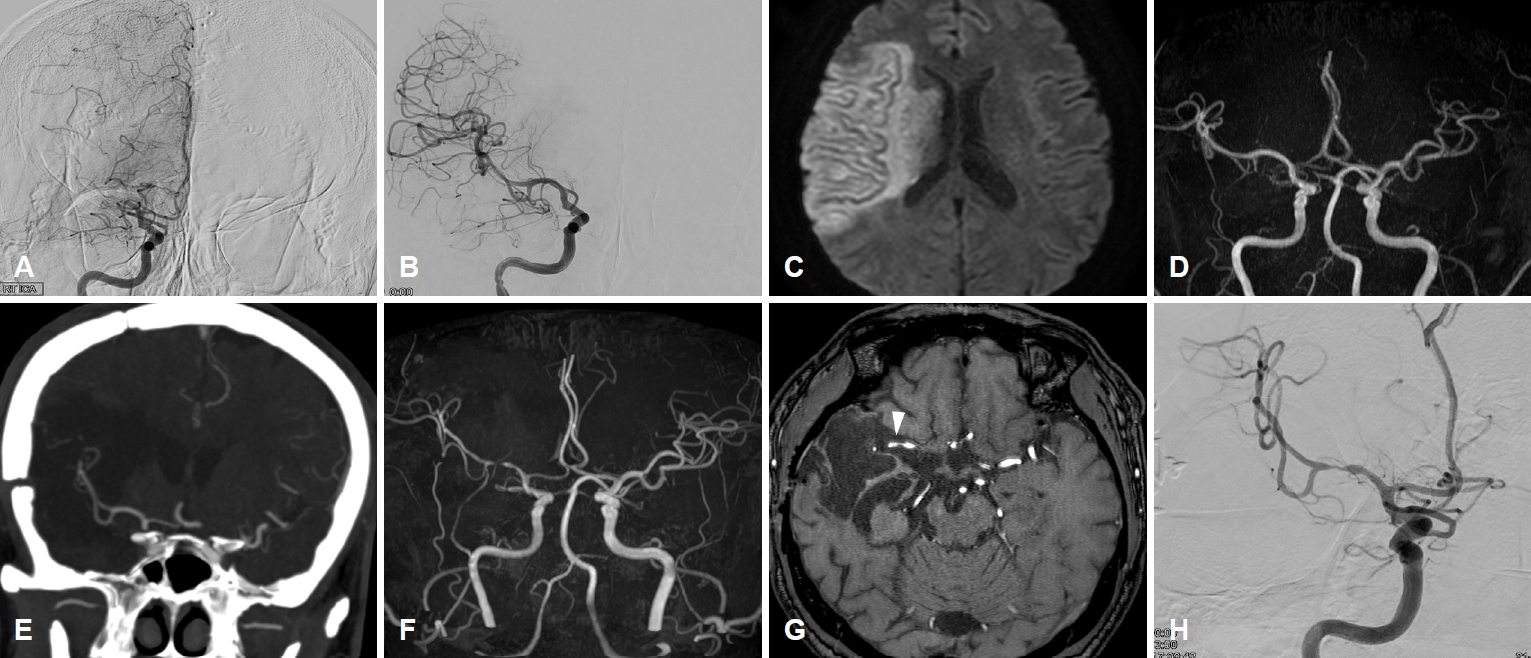
Figure 2.
Vessel wall magnetic resonance (VW-MR) imaging of the patient. (A) Axial, (B) coronal T1-weighted, (D) axial, (E) coronal T2-weighted images show eccentric arterial wall thinckening (arrowhead), without evidence of double lumen, intimal flap or intramural hematoma. (C) Axial, (F) coronal contrast-enhanced T1-weighted VW-MR, images show heterogenous enhancement (arrowhead) within the vessel wall of the right middle cerebral artery.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




