Rotundarpene이 파킨슨증 유발 신경독소 1-methyl-4-phenylpyridinium에 의한 세포자멸사에 미치는 억제효과
Inhibitory Effect of Rotundarpene on Parkinsonian Neurotoxin 1-Methyl-4-Phenylpyridinium-Induced Apoptotic Cell Deathute lesions.
Article information
Trans Abstract
Background
The extract and hemiterpene glycosides of Ilex Rotunda Thunb exert antioxidant and anti-inflammatory effects. The effect of rotundarpene on apoptosis in neuronal cells caused by the 1-methyl-4-phenylpyridinium (MPP+) has not been reported previously.
Methods
Using differentiated PC12 cells and human neuroblastoma SH-SY5Y cells, we investigated the effect of rotundarpene on MPP+-caused apoptosis in relation to the cell death process.
Results
MPP+-induced cell death was identified using the MTT and neutral red uptake tests. Apoptosis was induced by eliciting decreases in the cytosolic levels of Bid and Bcl-2 proteins, increases in the cytosolic levels of Bax and p53, disruption of the mitochondrial transmembrane potential, and the release of cytochrome c and the activation of caspase-8, -9, and -3 in differentiated PC12 cells and SH-SY5Y cells. Treatment with rotundarpene reduced the MPP+-induced changes in the levels of apoptosis-regulated proteins, formation of reactive oxygen species, depletion and oxidation of glutathione, and cell death in both PC12 and SH-SY5Y cells.
Conclusions
Rotundarpene may reduce MPP+-induced apoptosis in neuronal cells by suppressing the activation of the mitochondria-mediated pathway and the caspase-8 and Bid pathways. Rotundarpene appears to act by inhibiting the production of reactive oxygen species and by the depletion and oxidation of glutathione.
서 론
사립체 기능손상, 산화 스트레스, 단백질 처리변화, 염증 변화가 세포자멸사와 자가초식현상(autophagy)을 통해 파킨슨병 환자의 뇌 흑질에서 세포기능 손상과 세포사를 일으킨다고 알려졌다[1]. 파킨슨병에서 주요 사립체기능 손상은 막투과성 변화와 호흡사슬 복합체 I의 활성억제이며, 결과로 활성산소(active oxygen)가 과다 생성되어 사립체기능 손상과 세포사가 나타난다고 알려졌다[2,3]. Methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)은 흑색질 도파민신경세포를 선택적으로 손상시켜 파킨슨병 유사 증상을 일으킨다[4]. 투여된 MPTP는 아교세포에서 모노아민산화효소 억제-B (monoamine oxidase-B)에 의해 또는 자발적으로 활성 대사물인 1-methyl-4-phenylpyridinium (MPP+ )으로 전환되고, MPP+ 는 도파민수송체에 의해 도파민신경세포로 들어가 사립체 기능손상, 산화스트레스, 에너지 생성 억제를 일으킨다[5,6]. MPP+ 는 사립체 막 투과성 변화에 영향을 주는 Bcl-2, Bax 같은 세포자멸사 조절 단백질 양에 변화를 일으키고, 이어 caspase 활성화를 유발하여 신경세포에서 세포사를 일으킨다[7,8]. MPTP를 투여한 생쥐의 흑색질에서 세포자멸사가 나타난 세포의 숫자가 증가하는 것이 확인되었다[1].
Ilex Rotunda Thunb 수피는 중국에서 감기, 편도염, 인후통, 급성 위장염, 이질 치료에 사용하고 있다[9,10]. Ilex Rotunda의 주요 활성성분은 트리테르페노이드 사포닌, 페놀산 화합물, 플라보노이드이다. Ilex latifolia, Ilex asprella와 Ilex Rotunda로 구성된 trilex는 생쥐에서 초산 투여에 따른 복강 내 염증삼출을 억제한다고 알려져있다[9]. Ilex Rotunda 추출물 syringin은 흰쥐에서 carrageenan 주입에 따른 족부 부종을 억제한다[11]. 헤미테르핀 rotundarpene (4-caffeoyl-3-methyl-but-2-ene-1,4-diol)은 각질세포에서 세균 구성성분에 의해 유발된 염증 매개물질의 생성을 억제한다[12]. Ilex Rotunda Thunb 수피의 추출물은 항산화 효과가 있으며, 1,1-diphenyl-2-picrylhydrazyl (DPPH), 알킬, 수산기, 과산화물 유리기에 제거작용을 나타낸다고 보고한다[13]. Ilex Rotunda Thunb 잎의 헤미테르핀 배당체는 DPPH유리기, 과산화물유리기를 제거하여 항산화효과를 나타낸다[14].
신경증식인자로 분화된 PC12 세포에 MPP+ 를 처리하여 파킨슨병의 시험관 모델로 흔히 사용한다[15,16]. 사립체기능 항진, 항염증, 항산화 효과를 가진 화합물은 신경세포 퇴행에 억제효과를 나타낼 수 있다[17]. Ilex Rotunda Thunb의 수피 추출물은 항산화, 항염증 효과를 나타낸다고 보고되었다[12,13]. 그럼에도 신경세포에서 파킨슨병 유사증상 유발 신경독소 MPP+ 노출에 따른 세포자멸사에 미치는 rotundarpene 효과는 규명되지 않았다. 분화된 PC12 세포를 이용하여 세포사 관점에서 MPP+ 노출에 따른 세포자멸사에 미치는 rotundarpene의 효과를 분석하였다.
대상과 방법
1. Rotundarpene의 추출, 분리, 화학구조 확인
이 실험에서 사용한 rotundarpene(M.W.=264)은 이민원 교수로부터 제공을 받았으며, 이전에 발표된 연구 방법에 따라[12] Ilex Rotunda Thunb의 줄기에서 추출, 분리하였고 화학구조는 분광분석법에 의해 확인하였다.
2. 세포배양
흰쥐 PC12 세포(pheochromocytoma cell line)를 한국세포주은행에서 구입하여 매뉴얼에 따라 배양하였다. PC12 세포에 100 ng/mL의 7S 신경성장인자(Sigma-Aldrich Inc., St. Louis MO, USA)를 9일 동안 처리하여 세포를 분화시켰다[18].
사람 신경모세포종 세포주 SH-SY5Y 세포는 한국세포주은행으로부터 구입하였다. SH-SY5Y 세포주를 세포주은행의 매뉴얼에 따라 배양하였다.
3. 세포 생존 분석
세포 생존은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)가 미토콘드리아 탈수효소에 의해 포르마잔 (formazan) 결정체로 전환되는 것을 조사하여 결정하였다[19]. 세포 생존은 화합물을 처리하지 않은 대조군을 100%로 하고 표본값을 이에 비교하여 %로 표시하였다. Microplate reader (Magellan, TECAN, Salzburg, Austria)를 이용하여 파장 570 nm에서 흡광도를 측정하였다. 세포 생존은 시약을 처치하지 않은 대조군에 비교하여 %로 표시하였다.
세포 생존을 neutral red가 살아있는 세포의 리소좀에 흡수되는 것을 이용하여 측정하였다[20]. 파장 540 nm에서 흡광도를 측정하였다. 세포 생존은 시약을 처치하지 않은 대조군에 비교하여 %로 표시하였다.
4. 세포자멸사 조절 단백질의 웨스턴블롯 측정
세포자멸사조절단백질(Bid, Bax, Bcl-2, cytochrome c, p53; Santa Cruz Biotechnology Inc., Santa Cruz, CA, USA)의 양을 웨스턴블롯과 효소결합면역흡착측정법(enzyme-linked immunosorbent assay, ELISA)으로 조사하였다.
단백질 밴드의 밀도를 서울대학교 라이선스 TINA 2.10 g 소프트웨어 프로그램으로 처리하여 대조 밀도에 대한 상대적 크기로 결정하고, 숫자로 표기하였다.
시토크롬(cytochrome) c 유리에 대한 양적분석을 QuantikineⓇ M rat/mouse cytochrome c assay kit (R&D systems, Minneapolis, MN, USA)을 사용하여 양적분석하였다. 상업용 시토크롬 c를 희석하여 표준곡선을 작성하여 분석하고 단백질 µg 당 나노몰(nanomole)로 표시하였다.
5. Caspase (-8, -9, -3) 활성 측정
Caspase-8, caspase-9, caspase-3 활성을 측정 키트(R&D systems, Minneapolis, MN, USA)로 분석하였다. PC12 세포를 용해, 원심 분리하고 얻어진 상청액을 dithiothreitol과 caspase (-8, -9, -3)에 대한 기질이 함유되어 있는 반응액에 넣고 반응시켰다. Chromophore p-nitroanilide의 흡광도를 405 nm에서 측정하였다. 매뉴얼에 따라 caspase 활성을 임의 unit로 표시하였다.
6. 사립체 막전위 측정
PC12세포함유반응액에 양이온 지질친화성인 3,3’-dihexyloxacarbocyanine iodide (DiOC6(3))를 넣고 flow cytometry로 사립체 막투과 전위 변화를 측정하였다[21]. 막전위 변화는 argon laser excitation 501 nm에서 FACScan cytofluorometer (Becton Dickinson, San Jose, CA, USA)로 분석하였다.
7. 세포 내 활성산소 생성의 측정
염료 2’,7’-dichlorofluorescein diacetate (DCFH2-DA)가 hydroperoxide와 반응하여 형광물질 2’,7’-dichlorofluorescin (DCF)로 산화되는 것을 조사하여 세포 내 과산화물 양을 측정하였다[22]. 형광광도계를 사용하여 형광의 변화를 여기 파장 485 nm, 방출 파장 530 nm에서 조사하였다.
8. 글루타티온(glutathione)의 총량 측정
Glutathione 총량(환원형 GSH + 산화형 이황화글루타티온 [glutathione disulfide])은 굴루타티온 환원효소를 사용하여 조사하였다[23]. 파장 412 nm에서 흡광도를 측정하였다 표준곡선은 상업용 GSH를 희석하여 5,5'-dithio-bis-(2-nitrobenzoic acid) 함유 반응액과 반응시켜 나온 흡광도를 측정하였다.
9. 환원형과 산화형 굴루타티온의 측정
PC12 세포(4×104)를 MPP+ 로 37°C 배양기에서 24시간 처리 후, 환원형 글루타티온(glutathione=GSH)과 산화형 이황화글루타티온 (glutathione disulfide=GSSG)을 각각 측정하였다[24]. 여기 파장 350 nm, 방출 파장 420 nm에서 형광을 측정하여 환원형 글루타티온과 산화형 이황화글루타티온 양을 계산하였다. 표준곡선은 상업용 환원형 글루타티온 또는 산화형 이황화글루타티온을 o-phthalaldehyde 함유 반응액에 넣어 반응시키고 형광 변화를 측정하여 작성하였다.
10. 통계 분석
일원배치분산분석을 하여 통계적 유의성을 조사하였다. 유의성이 검증되면 사후검증으로 다자간 비교를 위한 Duncan’s test를 하여 집단간 유의성을 비교하였다. 자료는 평균±표준오차로 표기하였다.
결 과
1. Rotundarpene 이 MPP+ 처리에 따른 세포사에 미치는 효과
MPP+ 세포독성에 미치는 rotundarpene의 억제효과를 신경증식인자로 분화시킨 PC12 세포에서 조사하였다. PC12 세포를 500 µM MPP+ 로 24시간 처리하였을 때 약 47%의 세포사가 나타났다. Rotundarpene은 MPP+ 노출에 의한 세포사를 억제하였고 15 µM 에서 약 66%의 최대 억제효과를 보였으며, 이 농도 이상에서 억제 효과는 감소하였다(Fig. 1A). Rotundarpene이 도파민신경세포의 특성을 갖고 있는 신경모세포종 세포주 SH-SY5Y 세포에 대해 보호효과를 나타내는지 조사하였다(Fig. 1B). 이 세포에서 rotundarpene은 MPP+ 노출에 의한 세포사를 억제하였으며 15 µM에서 약 63%의 최대 억제효과를 보였다. Neutral red 흡수를 이용하여 세포생존을 분석하고 MPP+ 독성에 대한 rotundarpene의 억제 효과를 확인하였다. Rotundarpene은 500 µM MPP+ 처리에 따른 세포사멸을 억제하였으며 15 µM에서 최대 억제효과를 나타내었으나, 이후 농도에서는 억제효과가 감소하였다(Fig. 1C). 사립체 복합체 I 억제작용이 있으며 MPP+ 와 유사한 독성효과를 나타내는 rotenone 독성에 대해서도 rotundarpene이 보호효과를 나타낼 수 있는지 조사하였다. Rotundarpene 은 2.5 µM rotenone 노출에 따른 세포사를 억제하였으며, 15 µM에서 최대 억제효과를 나타내었고, 이 농도 이상에서 억제효과는 감소하였다(Fig. 1D).

Effect of rotundarpene on MPP+-induced cell death. (A, B) Differentiated PC12 cells or SH-SY5Y cells (4×104 cells/200 µL) were treated with 500 μM MPP+ in the presence or absence of 1-25 μM rotundarpene for 24 h. Cell viability was measured using the MTT reduction assay. (C) Differentiated PC12 cells (4×104 cells/200 µL) were treated with 500 μM MPP+ in the presence or absence of 1-25 μM rotundarpene for 24 h. Cell viability was measured using neutral red uptake assay. (D) Differentiated PC12 cells (4×104 cells/200 µL) were treated with 2.5 µM rotenone in the presence or absence of 1-25 μM rotundarpene for 24 h. Cell viability was measured using the MTT reduction assay. Values are expressed as absorbance and represent the mean±SEM, n=6 (duplicates from 3 individual experiments). +p<0.05 compared to the control; *p<0.05 compared to MPP+ alone. MPP+ was abbreviated as MPP and rotundarpene as RTD. SEM; standard error mean, MTT; 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MPP+ ; 1-methyl-4-phenylpyridinium.
2. Rotundarpene 이 MPP+ 노출에 따른 세포자멸사 조절 단백질 활성화에 미치는 효과
PC12 세포에서 세포자멸사조절단백질 양의 변화를 측정하여 MPP+ 노출에 따른 세포자멸사 과정을 분석하였다. PC12 세포를 MPP+ 로 4시간 처리하였을 때 세포질 Bid와 세포자멸사를 억제하는 Bcl-2 양이 감소하였고, 세포자멸사를 일으키는 Bax, 시토크롬 c, 세포사 촉진 인자 p53양이 증가하였다(Fig. 2A). Rotundarpene은 MPP+ 처리에 따른 Bid, Bax, Bcl-2, cytochrome c, p53양의 변화를 억제하였다. 이어서, MPP+ 에 의한 세포자멸사에 대한 항산화제의 효과를 조사하였다. 1 mM N-acetylcysteine, 50 μM trolox 는 MPP+ 노출에 따른 Bid, Bax, Bcl-2, cytochrome c, p53양의 변화를 억제하였다(Fig. 2A). 세포자멸사조절단백질 양의 변화에 미치는 rotundarpene 억제효과는 항산화제 효과와 비슷하거나 큰 것으로 나타났다.
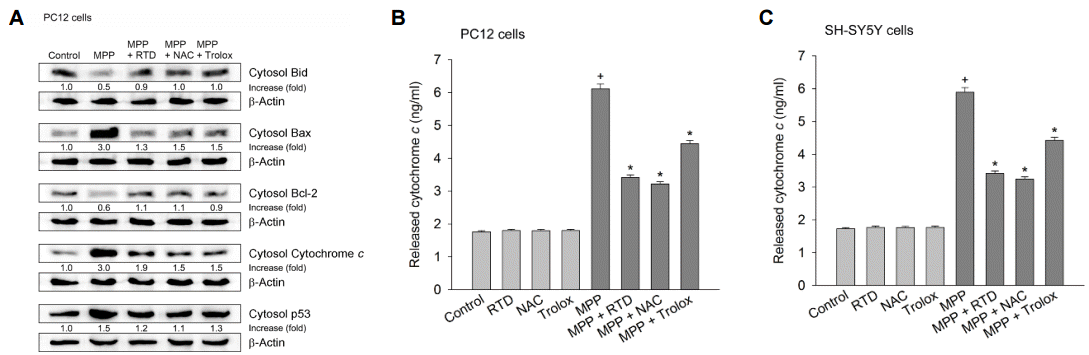
Effect of rotundarpene on MPP+-induced changes in the levels of apoptosis-related proteins. (A) Differentiated PC12 cells were pre-treated with 15 μM rotundarpene, 1 mM N-acetylcysteine or 50 μM trolox for 20 min and then exposed to 500 μM MPP+ in combination with rotundarpene or compounds for 4 h. The levels of Bid, Bax, Bcl-2, cytochrome c and p53 proteins were assayed by Western blotting with specific antibodies. The densities of protein bands were expressed as a fold increase compared to the control density. Data are representative of three independent experiments. (B, C) PC12 cells (or SH-SY5Y cells) were pre-treated with compounds (15 μM rotundarpene, 1 mM N-acetylcysteine or 50 μM trolox) for 20 min and then treated with MPP+ in combination with compounds for 6 h. The amount of released cytochrome c was determined using an analysis kit, and the data are expressed as ng/mL for cytochrome c. Values are represent the mean±SEM, n=6 (duplicates from 3 individual experiments). +p<0.05 compared to the control; *p<0.05 compared to MPP+ alone. SEM; standard error mean, RTD; routundarpene, NAC; N-acetylcysteine, MPP+; 1-methyl-4-phenylpyridinium.
MPP+ 노출에 따른 시토크롬 c 유리에 미치는 rotundarpene 효과를 ELISA 양적 분석으로 측정하였다. 분화된 PC12 세포와 SH-SY5Y 세포에서 MPP+ 는 사립체에서 시토크롬 c 유리를 자극 하였다. Rotundarpene, N-acetylcysteine과 trolox는 MPP+ 노출에 따른 시토크롬 c 유리를 억제하였으며, 화합물 단독은 시토크롬 c 유리를 일으키지 않았다(Fig. 2B and C).
MPP+ 처리한 PC12 세포에서 caspase 활성화를 caspase 억제제 효과로 분석하였다. MPP+ 에 의한 세포사는 세포막투과성 caspase-8 억제제인 30 μM z-IETD.fmk (z(-Ile-Glu-(O-ME)-Thr-Asp(O-Me) fluoromethyl ketone), 세포막투과성 caspase-9 억제제인 30 µM z-LEHD.fmk (z-Leu-Glu-(O-ME)-His-Asp(O-Me) fluoromethyl ketone), 세포막투과성 caspase-3 억제제인 30 µM z-DQMD.fmk (z-Asp-(OMe)-Gln-Met-Asp(OMe) fluoromethyl ketone z-Asp-(OMe)-Gln-Met-Asp(OMe) fluoromethyl ketone) 첨가에 의해 억제되었다(Fig. 3A). Caspase 억제제 단독은 세포독성을 나타내지 않았다. MPP+ 를 처리한 PC12 세포에서 caspase (-8, -9, -3)의 활성화를 양적 분석하였다. 분화된 PC12 세포와 SH-SY5Y 세포에 MPP+ 를 6시간 처리 하였을 때 caspase (-8, -9, -3)의 활성이 유의하게 증가하였다. Rotundarpene, N-acetylcysteine, trolox는 분화된 PC12 세포에서 MPP+ 처리에 따른 caspase (-8, -9, -3)의 활성화를 억제하였으며, SH-SY5Y 세포에서 MPP+ 처리에 따른 caspase-3 활성화를 감소시켰다(Fig. 3B and C). Rotundarpene과 항산화제 단독은 caspase 활성화를 일으키지 않았다.
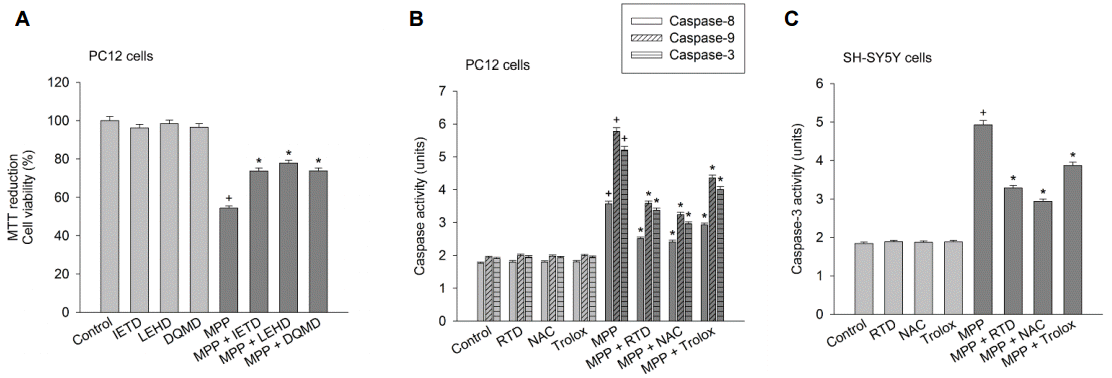
Effect of rotundarpene on MPP+-induced caspase activation. (A) Differentiated PC12 cells were pre-treated with 30 µM caspase inhibitors (z-IETD.fmk, z-LEHD.fmk or z-DQMD.fmk) and then exposed to 500 μM MPP+ in combination with caspase inhibitors for 24 h and cell viability was determined.Values represent the mean±SEM (n=6). +p<0.05, compared to the control; *p<0.05, compared to MPP+ alone. (B, C) PC12 cells (or SH-SY5Y cells) were treated with MPP+ in the presence of 15 μM rotundarpene, 1 mM N-acetylcysteine, 50 μM trolox or 100 μM ascorbic acid for 6 h. The activities of caspase-8, -9 and -3 were determined using analysis kits. Values are expressed as units and represent the mean±SEM, n=6 (duplicates from 3 individual experiments). +p<0.05 compared to the control; *p<0.05 compared to MPP+ alone. SEM; standard error mean, RTD; rotundarpene, NAC; N-acetylcysteine, ETD; z-Ile-Glu-(O-ME)-Thr-Asp(O-Me) fluoromethyl ketone (z-IETD.fmk), DQMD; z-Asp-(OMe)-Gln-Met-Asp(OMe) fluoromethyl ketone (z-DQMD.fmk), LEHD; z-Leu-Glu-(O-ME)-His-Asp(O-Me) fluoromethyl ketone (z-LEHD.fmk).
MPP+ 처리한 PC12 세포에서 사립체 막전위 변화를 측정하였다. 세포에 MPP+ 를 처리하였을 때 탈분극(낮은 값의 DiOC6[3] 형광) 상태의 사립체를 가진 세포 숫자가 증가하였다. MPP+ 효과는 사립체 막투과 억제제인 0.5 μM cyclosporin A 처리에 의해 억제되었다(Fig. 4). Rotundarepene, N-acetylcysteine는 MPP+ 에 의해 유발된 사립체 막전위 붕괴를 억제하였다.

Effect of rotundarpene on MPP+-induced loss of the mitochondrial transmembrane potential. PC12 cells were treated with 500 μM MPP+ in the presence or absence of 15 μM rotundarpene, 0.5 μM cyclosporin A and 1 mM N-acetylcysteine for 24 h. Values are expressed as the percentage of cells with depolarized mitochondria (low values of DiOC6(3) fluorescence) and represent the mean±SEM (duplicates from 2 individual experiments). +p<0.05 compared to the control; *p<0.05 compared to MPP+ alone. SEM; standard error mean, RTD; rotundarpene, CsA; cyclosporin A, NAC; N-acetylcysteine.
3. Rotundarpene 이 MPP+ 노출에 따른 활성산소의 생성과 글루타티온의 고갈과 산화에 미치는 효과
MPP+ 세포독성에 대한 rotundarepene의 억제효과가 활성산소 생성 억제에 의해 이루어졌는지 조사하였다. 활성산소가 DCFH2-DA를 형광물질 DCF로 산화시키는 것을 이용하여 활성산소 생성을 측정하였다. PC12 세포를 MPP+ 로 처리하였을 때 DCF 형광이 현저히 증가하였으며, 이러한 증가는 rotundarpene, N-acetylcysteine, trolox의 첨가에 의해 억제되었다(Fig. 5A). Rotundarpene과 항산화제 단독은 활성산소 생성을 일으키지 않았다. MPP+ 노출에 따른 세포사에 있어 활성산소의 역할을 조사하기 위해 항산화제가 세포사에 나타내는 효과를 조사하였다. N-acetylcysteine, trolox, ascorbic acid는 MPP+ 노출에 따른 세포사를 억제하였다(Fig. 5B).
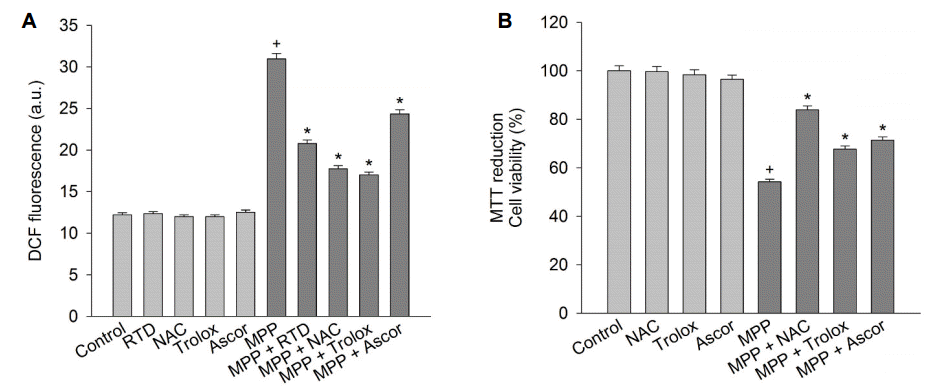
Effect of rotundarpene on MPP+-induced production of reactive oxygen species. PC12 cells were treated with 500 μM MPP+ in the presence of 15 μM rotundarpene, 1 mM N-acetylcysteine, 50 μM trolox or 100 μM ascorbic acid for 24 h. (A) Changes in DCF fluorescence were measured and data are expressed as arbitrary units of fluorescence. (B) Cell viability was measured using the MTT reduction assay. Values are represent the mean±SEM, n=6 (duplicates from 3 individual experiments). +p<0.05 compared to control; *p<0.05 compared to MPP+ alone. SEM; standard error mean, RTD; rotundarpene, NAC; N-acetylcysteine, MTT; 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, DCF; 2’,7’-dichlorofluorescin.
MPP+ 세포독성에 미치는 rotundarpene의 억제효과가 글루타티온 고갈에 대한 효과로 이루어졌는지 조사하였다. 대조세포에서 티올 양은 5.34±0.10 nmol/mg 단백질이었다. 500 µM MPP+ 로 24시간 처리하였을 때 티올 양이 46-47% 고갈되었다. Rotundarepene (15 µM)은 MPP+ 노출에 따른 글루타티온 고갈을 억제하였다(Fig. 6A). N-acetylcysteine, trolox, ascorbic acid는 MPP+ 노출에 따른 글루타티온 고갈을 억제하였으며, 단독은 글루타티온 양에 영향을 나타내지 않았다.

Effect of rotundarpene on MPP+-induced production of depletion and oxidation of GSH. PC12 cells were treated with treated with 500 μM MPP+ in the presence of 15 μM rotundarpene, 1 mM N-acetylcysteine, 50 μM trolox or 100 μM ascorbic acid for 24 h. Total GSH, reduced GSH and GSSG were measured, and data are expressed as nmol of GSH/mg protein. Values are represent the mean±SEM, n=6 (duplicates from 3 individual experiments). +p<0.05 compared to control; *p<0.05 compared to MPP+ alone. SEM; standard error mean, RTD; rotundarpene, NAC; N-acetylcysteine, MPP+; 1-methyl-4-phenylpyridinium, GSH; glutathione, GSSG; Glutathione disulfide.
MPP+ 노출에 의한 세포사에 미치는 rotundarpene의 억제효과가 글루타티온 산화에 대한 효과로 이루어졌는지 조사하였다. 대조 PC12세포에서 글루타티온 산화형인 이황화글루타티온의 양은 0.49±0.02 nmol/mg 단백질이었다. MPP+ 로 세포를 24시간 처리하였을 때 이황화글루타티온의 양은 대조세포에 비교하여 3.7배 증가(1.83 nmol/mg 단백질)하였다. Rotundarpene은 MPP+ 노출에 따른 글루타티온의 산화를 억제하였으며, 15 µM에서 72% 억제효과를 보였다(Fig. 6B). Rotundarpene, trolox, ascorbic acid자체가 이황화글루타티온 양을 증가시켰으나, N-acetylcysteine과 함께 MPP+ 처리했을 때는 이황화글루타티온 양 증가와 GSSG/GSH 비율 증가를 억제하였다(Fig. 6B and C).
고 찰
분화된 PC12 세포에서 MPP+ 는 세포자멸사 조절 단백질 Bid, Bcl-2, Bax, p53, 시토크롬 c 유리와 caspase (8, 9, 3) 활성화를 유발하였다. SH-SY5Y 세포에서도 MPP+ 는 시토크롬 c 유리와 caspase-3 활성화를 초래하였다. MPP+ 는 사립체 막투과성을 변경시켜 시토크롬 c 유리시키고 caspase-9, -3를 활성화하여 신경세포사를 일으킨다[7,8,25]. Caspase-9는 pre-caspase-3를 분해, 활성화하여 caspase-3를 만든다[26]. Caspase-3은 caspase-2, 7을 자극하여 PARP-1을 분절, 활성화하고 분절된 PARP-1은 핵의 분절을 일으켜 세포사를 일으킨다[25,26]. 따라서 분화된 PC12 세포에서 사립체막전위 붕괴와 caspase (8, 9, 3) 활성화는 MPP+ 가 사립체 막투과성을 변경시켜 시토크롬 c 유리시키고 caspase-9, -3을 활성화하여 세포자멸사를 일으킨다는 것을 뒷받침한다. 세포자멸사 유발 Bax 는 사립체 막 투과성을 변화시켜 시토크롬 c 유리를 자극하여 세포 자멸사를 항진시키며, Bax 작용은 Bcl-2에 의해 억제된다[26]. 전사인자 p53은 직접 Bax 유전자를 활성화한다[26]. 세포자멸사 개시자, caspase-8은 Bid를 분열시켜 사립체 막투과성을 증가시키거나, caspase-3을 직접 활성화시킨다[27]. 따라서, 연구결과는 MPP+ 가 신경세포에서 사립체 매개 경로와 caspase-8-Bid 경로 활성화를 통 해 세포자멸사를 일으킨다는 것을 시사한다.
Ilex Rotunda Thunb의 수피 추출물은 항산화, 항염증 효과를 나타낸다고 알려졌다[12,13]. 그럼에도 신경세포에서 MPP+ 처리에 따른 세포자멸사에 미치는 효과는 밝혀지지 않았다. 이러한 관점에서 분화된 PC12 세포를 이용하여 세포사 관점에서 MPP+ 처리에 따른 세포자멸사에 미치는 rotundarpene의 효과를 분석하였다. 분화된 PC12 세포와 SH-SY5Y 세포에서 rotundarpene은 MPP+ 처리에 따른 세포자멸사 조절 단백질 양의 변화와 사립체 막전위 붕괴를 억제하였다. 이러한 결과로써 rotundarpene은 caspases-9, -3 활성화에 이르는 사립체 경로와 caspase-8-Bid 경로 활성화를 억제하여 MPP+ 에 의해 유발된 세포자멸사를 억제할 것으로 생각한다.
MPP+는 사립체 호흡연쇄사슬을 억제하여 활성산소 생성을 유발한다[2]. 생성된 활성산소는 사립체에 작용하여 사립체 막투과성 을 변경시키고 시토크롬 c를 유리시킨다[27]. 활성산소 생성이 증가하면, 세포 내 항산화제 글루타티온 농도가 감소하게 되고, 이에 따라 사립체 기능 손상이 나타난다[28,29]. 세포사 초기 현상으로 세포 글루타티온 고갈과 산화 현상이 나타나며 이에 따라 사립체 막투과가 변경되고 시토크롬 c 유리와 caspase 활성화에 따른 세포자멸사 과정이 진행된다[30,31]. 본 실험에서 MPP+ 는 PC12 세포에서 활성산소 생성, 글루타티온 고갈과 산화를 일으켰으며, 항산화제는 MPP+ 에 의한 세포자멸사 조절 단백질 양의 변화를 억제하였다. Rotundarpene은 MPP+ 노출에 따른 활성산소 생성, 글루타티온 고갈과 산화를 억제하였다. 따라서 rotundarpene은 활성산소 생성, 글루타티온 고갈과 산화를 억제하여 MPP+ 노출에 따른 세포자멸사 조절 단백질 양의 변화를 억제한다고 생각한다.
결론적으로, 분화된 PC12 세포에서 rotundarpene은 caspase 활성화에 이르는 사립체 경로뿐만 아니라 caspase-8-Bid 경로 활성화를 저해하여 MPP+ 에 의한 세포자멸사를 억제한다고 생각한다. Rotundarpene이 세포자멸사에 미치는 저해효과는 활성산소생성, 글루타티온 고갈과 산화 억제에 의해 이루어졌을 것으로 생각한다. Rotundarpene은 항염증 효과, 항산화 효과가 있고 신경독소 MPP+ 에 의한 세포자멸사 억제효과가 있으므로, rotundarpene이 파킨슨병 유사증상 유발 신경독소에 의한 신경세포퇴행을 억제할 수 있을 것으로 예상한다.