만성 신질환을 동반한 후기발병 MELAS
Late-onset MELAS with Chronic Kidney Disease
Article information
Trans Abstract
Mitochondrial encephalomyopathy with lactic acid and stroke-like episodes (MELAS) is a multisystem mitochondrial disorder that typically presents in childhood. We report a case of MELAS syndrome diagnosed in a 45-year-old man presented with chronic kidney disease before a stroke-like episode. Genetic testing revealed a m.3243A>G point mutation in the mtDNA. The original diagnostic criteria for MELAS required the onset of stroke-like episodes prior to 40 years of age but this case demonstrates that disease onset may delay in certain individuals.
멜라스(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes, MELAS)는 사립체 DNA의 점돌연변이(point mutation)에 의한 가장 흔한 모계 사립체질환 중에 하나이다. 멜라스를 일으키는 사립체 DNA의 유전자변이로 현재까지 30개 이상의 다양한 변이들이 보고되었으나 약 80%에서는 루이신 전달 RNA 3,243번째 염기인 아데닌이 구아닌으로 점돌연변이 되어 발생한다. 임상증상으로 두통, 구토, 의식 장애, 경련, 편마비와 같은 증상들을 흔히 야기하며, 당뇨, 감각신경성 청각장애 등의 동반질환들도 일으킬 수 있다. 또한 드물지만 위장관과 신장을 포함하여 전신에 걸쳐 증상이 나타나기도 하며, 일부 환자에 국소분절 사구체경화증으로 인해 신부전증으로 발전되기도 한다[1].
멜라스 환자 대부분의 경우는 20세 이전에 증상을 경험하며, 40세 이후에 뇌졸중유사증상이 발생하는 경우는 드물다[2,3]. 외국의 경우 40세 이상에서 첫 뇌졸중유사증상을 보인 환자에 대한 보고가 있었고, 국내에는 멜라스에 대한 증례보고가 수차례 있었으나 40세 이후에 진단받은 경우는 3예뿐이었으며 신부전증상을 가진 환자는 없었다[4-7]. 이에 본 저자들은 35세에 신부전을 진단받고, 45세에 실어증 증상을 보인 남자 환자에서 분자유전학적인 방법으로 확진된 멜라스 1예를 보고하는 바이다.
증 례
45세의 남자가 15일 전부터 시작된 실어증 및 일시적인 우측 상지 위약감으로 내원하였다. 환자는 오른손잡이로, 내원 약 1달 전 갑자기 오른손이 들어올려지지 않고 말이 나오지 않았다고 하며, 1-2주 후 증상은 호전되었으나 이후 발음이 어눌하고, 남의 말이 이해가 되지 않으며, 물건을 보면 이름이 잘 생각나지 않게 되었다고 한다. 또한 머리 전반에 걸쳐 두통이 생겼다고 한다.
과거력에서 환자는 어린 시절에는 건강하였으나 내원 약 10년 전부터 사구체신염, 고혈압, 고지혈증으로 본원 신장내과를 다니며 약물을 복용하는 중이었다. 가족력에서 환자의 어머니가 알 수 없는 이유로 갑자기 쓰러져 돌아가신 적이 있다고 하며, 이외 가족들은 당뇨병이나 청각장애 및 혈관질환 병력이 없었다.
입원 시 신체검사에서 혈압이 159/107 mmHg, 심박수는 분당 78회, 체온은 36.6℃로 정상이었다. 신경학적 진찰에서 의식은 명료하였으나 언어장애가 관찰되었는데, 따라 말하기, 이해하기에서 손상이 확인되었다. 뇌신경검사에서 우측 중추성 안면마비가 관찰되었으며, 운동과 감각이상은 없었다. 좌우측 건반사도 대칭적으로 정상이었고, 병적 반사도 없었다. 심전도, 단순흉부방사선사진은 정상이었으나, 뇌 자기공명영상에서 양측 측두엽 및 좌측 두정엽에 혈관영역에 부합하지 않으면서 다양한 겉보기확산계수(apparent diffusion coefficient) 값을 보이는 뇌병변이 보였다(Fig. 1). 자기공명분광술에서는 뇌 자기공명영상에서 확인된 병변 측에서 젖산정점(lactate peak)이 확인되었다(Fig. 2). 뇌 자기공명혈관영상과 경두개도플러검사는 정상이었으며, 심장초음파검사와 24시간 심전도검사도 정상이었다. 말초혈액검사, 갑상선기능검사는 모두 정상이었고, 항핵항체, 항중성구세포질항체, 류마티스인자, 루푸스항응고인자는 모두 음성이었다. 혈액요소질소(blood urea nitrogen) 은 28 mg/dL, 혈중 크레아티닌 농도는 2.01 mg/dL로 증가되었으며, 사구체여과율은 40.4 mL/min/1.732였다. 요 단백-크레아티닌 비는 4.6 mg/mg으로 증가되었다. 뇌파검사에서는 우측 측두후두엽 쪽으로 불규칙한 복합서파가 보였다.
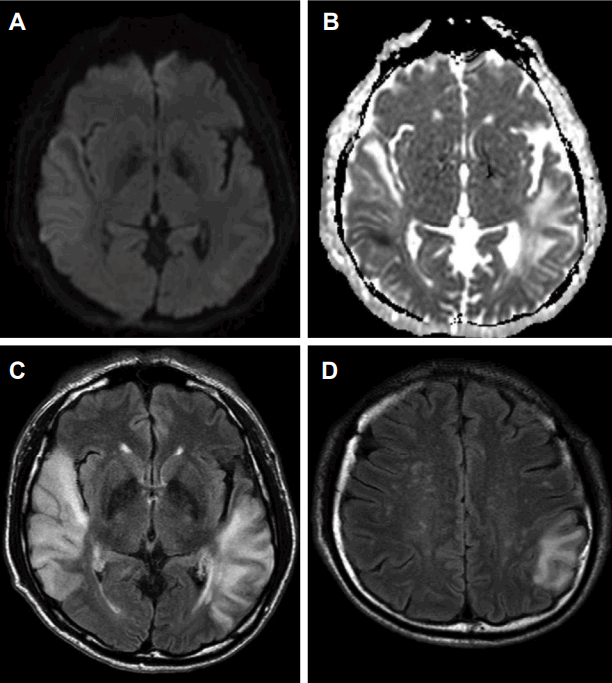
Brain magnetic resonance images. (A) Diffusion-weighted image shows subtle diffuse high signal intensity in both temporal and left parietal lobe. (B) Apparent diffusion coefficient image shows partially low signal intensity in right temporal and iso-high signal intensity in both temporal lobes. (C, D) Fluid attenuation inversion recovery axial images show high signal intensity in both temporal and left parietal areas.
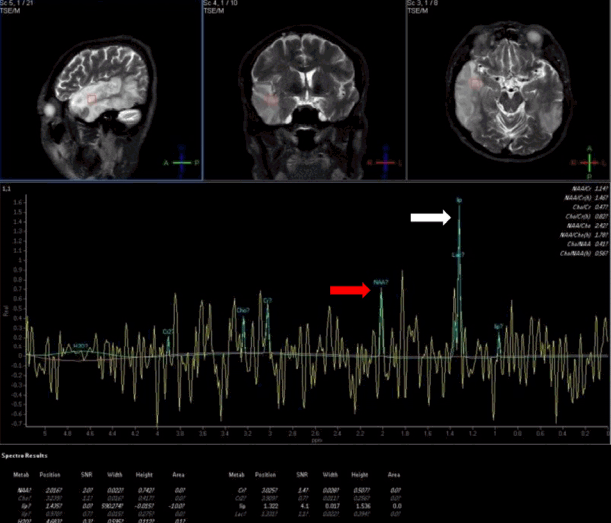
Magnetic resonance spectroscopy image shows decreased N-acetyl-aspartate (red arrow) with increased lactate peak (white arrow) in right temporal area.
확산강조영상에서 고신호강도를 보이지만 현성확산계수영상에서는 고신호와 저신호가 섞여있는 점과 자기공명분광술에서 젖산 정점이 확인되어 멜라스를 의심하여 젖산농도를 측정한 결과, 말초혈액에서 1.93 mmol/L (정상 수치: 0.9-1.7 mmol/L)로 농도가 증가되어 있었다. 확진을 위해 분자 유전학적 검사를 하였고, 말초 혈액 백혈구의 mtDNA에 대한 직접 시퀀싱법으로 mtDNA 루이신 전달 RNA 3,243번 염기의 이종조직(heteroplasmy)과 A→G 점돌연변이를 확인하였다.
고 찰
멜라스의 기전으로는 사립체 DNA의 돌연변이로 인하여 정상적인 호기성 대사작용과 에너지대사에 필수적인 호흡쇄기능에 장애를 유발하며, 주로 에너지 요구량이 많은 골격근, 신경계, 심장 등에서 증상을 일으키는 것으로 알려져 있다. 사립체 DNA 중 루이신 전달 RNA의 점돌연변이로 인해 발생하는 것으로 알려져 있으며, 80%에서 3,243번째 염기의 A→G 점돌연변이가 발견된다. 멜라스의 병태생리학적인 기전은 크게 두 가지로 생각하고 있다. 첫 번째는 산화질소대사 이상과 내피세포장애에 의한 뇌허혈증상 유발이고, 두 번째는 adenosine triphosphate 부족과 활성산소의 발생으로 세포 자멸사가 유도되어 조직 기능장애가 발생한다는 것이다[8]. 따라서 사립체 DNA 돌연변이와 관계된 질환의 증상은 주로 에너지 요구량이 많은 골격근, 신경계, 심장, 망막, 나선기관, 신장에서 나타날 수 있으며, 신장을 침범할 경우 주로 단백뇨를 동반한 신증후군(특히 국소분절사구체경화증) 형태로 잘 나타나거나 신세뇨관을 침범하여 판코니증후군(fanconi syndrome)으로 나타날 수 있다. 멜라스에 동반된 신부전증상의 경우 아직까지 이유는 명확하지 않으나 멜라스 진단 전 초기에 주로 나타나는 것으로 알려져 있다. 신부전증상의 발병 연령은 10대에서 30대로, 다른 동반 질환과 마찬가지로 주로 40세 전에 나타나며, 급성 또는 만성 신부전 형태로, 때로는 신장암의 형태로 나타나기도 한다[5].
다양한 임상증상들을 특징으로 하는 멜라스의 발병 연령은 2세부터 60세 이상까지 다양하게 보고되어 있지만 보통 20세 이전에 70% 정도에서 발병한다. 40세 이전에는 90%에서 나타나며 40세 이후는 드물다고 알려져 있다[9]. 40세 이상에서 첫 뇌졸중 유사증상이 나타나는 경우가 외국의 보고에서는 드물지 않게 있으나 국내에서는 3예 정도밖에 없다[10]. 본 증례의 환자는 45세에 실어증이 발생하여 내원하였으며, 뇌 자기공명영상에서 특정 뇌동맥 영역에 국한되지 않는 양측 측두엽의 세포독성부종과 혈관성부종이 혼재된 뇌병변이 확인되었다. 이에 유전자검사를 통해 3,243번째 염기가 아데닌에서 구아닌으로 점돌연변이된 것을 확인하여 멜라스가 진단되었다. 아쉽게도 환자의 거부로 신생검은 이루어지지 못하였으나 신증후군 진단에 합당한 단백뇨는 멜라스에 의해 신부전이 발생하였을 개연성이 높을 것으로 생각된다. 본 증례는 40세 이후 뇌졸중 유사 증상으로 발현된 신부전이 동반된 국내 첫 증례이며, 고령에서 멜라스가 진단된 경우 젊은 나이에 진단된 다른 증례들과 달리 뚜렷한 가족력이 없었다는 점과 어머니와 형제들에서 당뇨병과 청각장애 등 증상이 나타나지 않아 모계유전의 증거를 확인할 수 없었다는 최근 보고와 유사점이 있었다[7].
멜라스 환자에서 어떤 경우에 늦은 나이에 증상이 발생하는지에 대한 기전은 아직 확립되지 않았다. 하지만 현재까지의 가설으로는 사립체 DNA의 변이 양과 질병 부담과의 관계로 추정하고 있다. 즉, 본 증례의 환자의 경우 낮은 이형질성률로 인해 이들 환자들의 뇌에는 사립체 DNA의 돌연변이에 의한 호기성 대사저하의 부담이 많지 않은 것이 그 이유일 것으로 추정하고 있다.
멜라스는 대개 40세 이전에 발병하며 임상양상이 다양하고 호전과 악화를 반복하므로, 40세 이후의 환자가 병원에 왔을 때 충분한 과거 병력 청취와 가족력에 대한 조사 및 신경학적 진찰을 포함한 자세한 신체검사를 하지 않을 경우 진단이 늦어질 수 있다. 따라서 40세 이상에서도 뚜렷한 뇌혈관질환 위험요소 없이 뇌 자기공명영상에서 다양한 뇌혈관영역을 침범하는 비전형적인 뇌졸중 병변 및 젖산혈증이 동반되어 있을 경우 멜라스를 고려해보아야 한다. 사립체질환과 관련된 신부전의 경우에도 진단 과정은 일반적인 신부전 진단 과정과 같으나, 사립체질환을 의심할 수 있는 당뇨병이나 청각장애, 가족력이 있을 경우 더욱 의심을 하여 유전자 검사를 고려해보아야 한다[1,5]. 본 증례의 제한점으로, 신생검은 이루어지지 못하였으나 신생검을 통한 병리학적 소견은 사립체질환에 의한 신장질환 확인에 도움이 될 수 있으며, 본 증례처럼 다른 증상이나 가족력이 없을 경우에도 젊은 나이에 신부전이 동반되어 있는 경우라면 환자의 나이가 많더라도 멜라스의 가능성을 고려해 보아야 할 것이다.