가슴샘절제술 후 20년만에 가슴샘종이 재발한 중증근무력증 증례: 적절한 추적검사 기간은?
Myasthenia Gravis with Thymoma Recurrence 20 Years after Thymectomy: What Is the Optimal Follow-up Duration?
Article information
Trans Abstract
Thymoma occurs in about 20% of patients with myasthenia gravis (MG), but the recurrence of thymoma has rarely been reported. A 68-year-old man presented with ptosis and weakness of the neck muscles. He had undergone thymectomy for ocular MG with invasive thymoma 20 years previously. Chest computed tomography revealed recurrence of the thymoma. This 20-year period is, to our knowledge, the longest reported interval for recurrence of an MG-associated thymoma. The literature on the optimal follow-up duration after thymectomy is reviewed.
중증근무력증은 신경근육이음부의 아세틸콜린수용체에 대한 자가항체에 의해 발생하는 자가면역 질환으로 반복되는 근력약화와 피로가 특징이다[1]. 중증근무력증에서 가슴샘종의 빈도에 대해서는 보고마다 차이가 있지만 근래에 시행된 메타분석에 의하면 약 20% 정도이다[2]. 가슴샘 종양은 서서히 진행하지만 악성의 가능성이 있기 때문에 수술을 포함한 적절한 치료가 필요하다. 가슴샘종 제거술 후에 재발은 7-30%로 알려져 있고[3], 수술 후 재발까지 시간은 평균 7.6년이었다[4]. 저자들은 성공적으로 가슴샘종절제술을 시행한 중증근무력증 환자에서 20년 후에 중증근무력증 증상의 악화와 함께 가슴샘종이 재발한 증례를 경험하였기에 보고한다.
증 례
67세 남자가 일주일 동안의 안검하수와 경부 근력약화로 내원하였다. 증상은 일중변동이 있어 아침보다는 저녁에 심하였다. 환자는 1997년 안검하수로 내원하여 안구중증근무력증(ocular myasthenia gravis)으로 진단받았고 당시 아세틸콜린수용체항체(acetylcholine receptor antibody)는 8.11 nmol/L이었다(참고치, <0.5 nmol/L). 흉부 컴퓨터단층촬영(computed tomography, CT)에서 가슴샘종이 발견되어(Fig. 1-A) 확대가슴샘절제술(extended thymectomy)을 시행하였다. 병리학적으로 침습가슴샘종(invasive thymoma)이었다. 2000년까지 경구 프레드니솔론(prednisolone)과 피리도스티그민(pyridostigmine)을 투약하며 외래 통원치료를 하였으나 이후에 자의로 치료를 중단하였다. 2009년 다시 추적흉부CT를 시행하였고 가슴샘종의 재발은 없었다(Fig. 1-B). 경한 안검하수가 간헐적으로 있었으나 일상생활에 불편함이 없어서 치료를 계속하지 않았다.
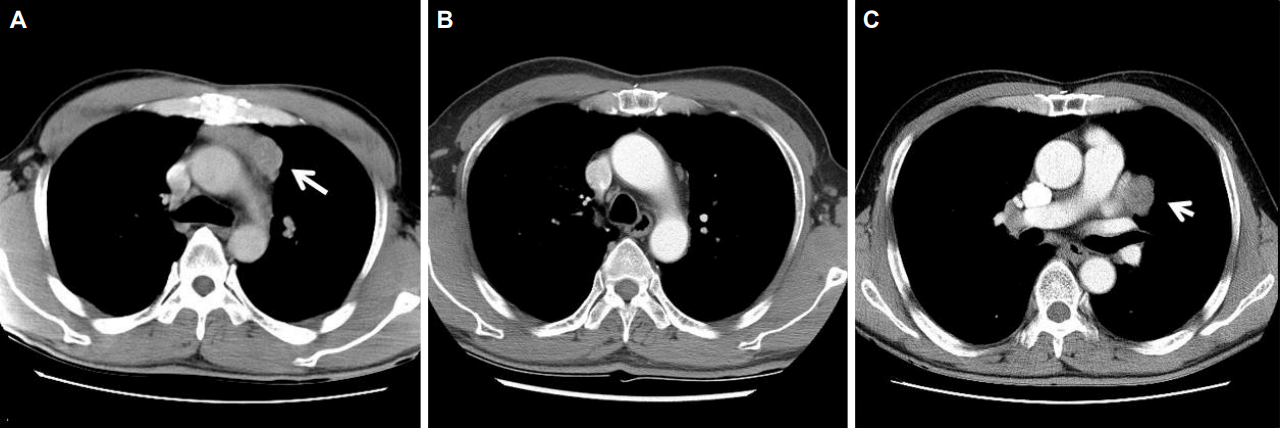
Serial chest computed tomography (CT) shows recurrence of thymoma after thymectomy. (A) A chest CT image in 1997 shows thymoma (arrow) located at anterior mediastinum. (B) There is no evidence of tumor recurrence on follow-up chest CT image in 2009. (C) A chest CT image in 2017 shows irregular mass (arrow) abutting to left ventricle and left upper lobe.
신경학적진찰에서 양쪽 눈에 안검하수가 있었고, 경부 신전(extension)의 근력저하가 있었다(Medical Research Council 등급 3). 반복신경자극검사에서 눈둘레근(orbicularis oculi)과 코근(nasalis)을 자극했을때 18%의 의미있는 감소를 보였다. 혈액검사에서 아세틸콜린수용체항체는 14.35 nmol/L로 증가되었다. 흉부CT에서 좌심실과 인접한 좌상엽에 위치한 3 cm 크기의 종괴가 확인되었다(Fig. 1-C). 전형적인 위치가 아니어서 CT유도세침흡인검사를 시행하였고, 가슴샘조직이 확인되어 가슴샘절제술을 시행하였다. 종괴는 심장막(pericardium) 및 주변 폐조직과 인접하여 있었고, 좌상엽의 내장쪽가슴막(visceral pleura)에 가슴샘조직으로 보이는 결절이 관찰되어 좌상엽쐐기절제술도 함께 시행하였다. 병리학적소견으로 피막 내부까지 가슴샘종조직이 확장되어있었으나 경계를 넘어서지는 않았고 가슴샘상피세포가 림프구와 혼재된 모습을 보였다(WHO type B1, Fig. 2). 좌상엽의 내장쪽가슴막검체에서도 가슴샘조직이 발견되었다(Masaoka stage 4a). 수술 이후 보조화학요법(adjuvant chemotherapy; 독소루비신[doxorubicin]+시스플라틴[cisplatin]+시클로포스파미드[cyclophosphamide])을 하였고, 근무력증치료를 위해 피리도스티그민과 면역억제제(프레드니솔론+미코페놀레이트모페틸[mycophenolate mofetil])를 사용하였다. 환자의 증상은 서서히 호전되었고 오른쪽 눈의 경미한 안검하수만 남아있다.
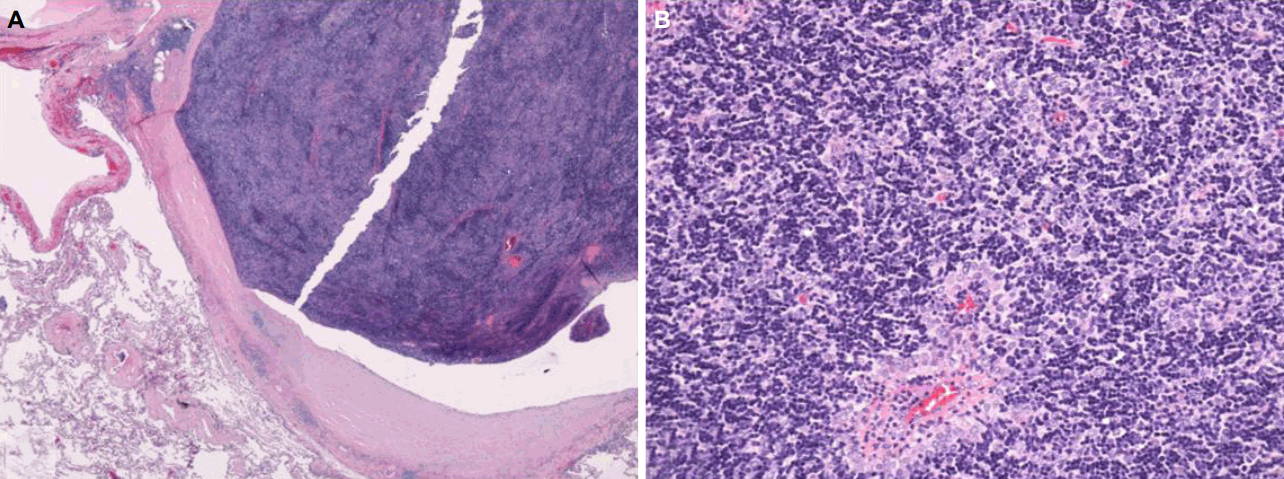
Pathologic images of the resected thymus and its adjacent tissues. (A) Dense fibrous capsule of encapsulated thymoma is contact with lung parenchyme. Thymoma extends into capsule, but not beyond capsule (H&E stain, x20). (B) The thymoma consists of lymphocytes mixed with bland thymic epithelial cells (H&E stain, x200).
고 찰
가슴샘은 중증근무력증의 발병에 중요한 역할을 하는 것으로 알려져 있고, 가슴샘종은 약 20%의 중증근무력증 환자에서 발견된다[2]. 악성으로 진행할 가능성이 있고 중증근무력증의 치료와도 관련성이 있어서 수술적가슴샘제거술을 원칙으로 한다. 일반적인 가슴샘종의 수술적제거 후 재발률은 7-30% 정도이다[3]. 재발률은 Mosaoka분류, 조직소견, 치료방법 등에 의한 영향을 받는다[5]. 비침습가슴샘종의 경우는 재발하는 경우가 매우 드물고, Mosaoka분류에서 단계가 높을수록 재발률이 높아진다. WHO조직소견에서 재발률을 비교했을 때 A/AB형에서 가장 낮고, B형, C형으로 갈수록 재발률이 증가하여 C형에서는 50% 재발률을 보였다[6]. 수술적치료에서 불완전한 가슴샘종의 제거도 재발의 위험요인이다. 수술 후 추가적인 방사선치료와 항암치료의 재발방지효과에 대해서는 좀 더 연구가 필요하다. 본 증례의 환자는 20년 전 수술 당시 가슴샘종과 인접한 폐조직에서 가슴샘조직이 확인되어 침습가슴샘종으로 진단하였고 완전한 수술적절제(complete resection)가 이루어진 것으로 판단하여 추가적인 항암치료나 방사선치료를 시행하지 않았다.
가슴샘종을 수술적으로 절제하고 추적관찰을 한 연구에서 14%에서 가슴샘종의 재발이 관찰되었고 수술 후 재발까지 기간은 평균 7.6년이었다[4]. 긴 시간 간격을 두고 재발한 증례만을 모아서 발표한 Spillane 등[7]의 보고에서는 재발기간이 평균 12년(6-15년)이었다. 근무력증을 동반한 가슴샘종 환자를 대상으로 한 문헌조사에서 가장 긴 재발기간은 19년이었다[8]. 이와 같이 재발기간이 비교적 다양하게 나타나고 길게 나타난 것은 가슴샘종의 성장속도가 비교적 느리기 때문으로 설명할 수 있다.
가슴샘종의 제거 후 적절한 추적기간에 대한 일치된 의견은 아직 없다. 3년 내에 재발확률이 높기 때문에 불완전한 제거를 한 경우나 가슴샘암의 경우는 처음 3년 동안은 6개월마다 CT검사를 권한다[9]. 가슴샘종환자를 추적한 대규모연구에서 85%는 수년(평균 4.3년)내에 재발하지만 15%의 환자는 10년 이후에 재발 결과가 나와서, 저자들은 처음 5년은 매년마다 이후에는 격년으로 20년까지 추적검사를 권유하였다[10]. 재발한 가슴샘종을 초기에 발견할수록 성공적으로 제거할 확률이 높아서 생존율도 향상되고, 증상이 없는 경우가 많기 때문에 주기적이고 장기적인 추적검사가 중요하다[10].
가슴샘종은 수술적절제 후 재발할 수 있으며 본 증례의 환자처럼 오랜 시간이 지난 후에도 재발이 가능하다. 가슴샘절제술을 시행한 중증근무력증 환자는 주기적인 영상검사를 통해 가슴샘종재발에 대한 확인이 필요할 것이다.