허혈뇌졸중 환자에서 콩팥기능 감소와 뇌경색 부피와의 상관관계
Renal Impairment and Infarct Volume in Ischemic Stroke
Article information
Trans Abstract
Background
The decreased estimated glomerular filtration rate (eGFR) levels at admission in patients with stroke have been associated with more severe clinical deficits and with worse outcomes; however, the relationship between eGFR levels and volumetric measurement of cerebral infarct size on neuroimaging has not been studied, to our knowledge.
Methods
Consecutive patients who presented within 48h of ischemic stroke and underwent brain diffusion-weighted imaging (DWI) over a 55-month period were studied. Patients with ischemic stroke of large artery atherosclerosis (LAA), small vessel occlusion (SVO), or cardioembolism (CE) etiologies were included. Those who were treated with thrombolysis and disabled before index stroke were excluded. Infarction volumes were log transformed to approximate normality. Chronic kidney disease (CKD) was defined as an eGFR < 60 mL/min per 1.73 m2. Subjects were categorized into two groups: CKD or no CKD. The relationship between CKD and DWI infarct volumes was examined using an analysis of covariance.
Results
Of the included 405 patients (mean age, 68 years; female, 60.2%; LAA, 60.0%; SVO, 16.5%; CE, 23.5%), 108 patients had CKD. Infarct volumes (mL, median [interquartile range]) were not significantly different between stroke patients with CKD and those without CKD in any stroke subtype (LAA, 0.77 [0.01-2.97] vs. 0.96 [0.01-5.22]; SVO, 0.18 [0.02-0.21] vs. 0.27 [0.01-0.52]; CE, 8.91 [0.04-28.54] vs. 5.22 [0.05-42.39]). Adjustment for possible confounders did not change the associations.
Conclusion
Renal impairment is not associated with cerebral infarct volume among acute ischemic stroke patients.
서 론
만성콩팥병(chronic kidney disease, CKD)은 어떠한 원인으로든 콩팥 손상이 발생하여 3개월 이상 사구체여과율(glomerular filtration rate, GFR)이 60 mL/min/1.73 m2 미만인 경우로 정의한다[1]. 노인 인구에서 나이가 들어감에 따라 만성콩팥병의 유병율은 증가하게 되는데 이는 지속적으로 사구체여과율이 감소하기 때문이다[2]. 이전 역학연구에서 콩팥질환을 가지고 있는 환자들이 만성 콩팥병 혹은 콩팥부전보다 심장혈관질환에 의한 사망이 많다는 결과를 보였다[3]. 만성콩팥병의 합병증이 콩팥질환 진행 자체보다 사망률에 있어서 더욱 중요한 것이다[4]. 따라서 콩팥기능과 다른 계통 질환과의 연관성을 찾아내는 것이 노인 인구에서 발생할 수 있는 질환의 예방과 치료에 있어서 중요한 관심사가 되어 왔다. 뇌졸중과 콩팥기능의 이상과의 관련성을 본 연구들도 있다[5,6]. 일반 인구 대상의 연구에서 콩팥기능의 저하가 있었던 환자들이 허혈 뇌졸중의 발생이 높았다는 보고가 있으며[4] 급성뇌졸중으로 입원했을 당시의 혈청 크레아티닌(creatinine)이 높았던 환자들은 18개월 후 사망률이 높다는 보고가 있다[7]. 이와 함께 만성콩팥병이 무증상뇌경색, 백질변성과의 연관성이 있다는 연구결과도 있다[8]. 또한 급성뇌경색의 크기는 뇌졸중의 중증도 및 기능적 평가와 상관관계가 있다는 연구결과가 있다[9,10]. 따라서 콩팥기능의 저하가 있는 급성 뇌경색 환자에서 병변의 크기를 측정하는 것이 환자의 기능적 예후 및 중증도를 판단하는데 임상적으로 유용할 수 있을 것이다[11]. 콩팥기능 저하가 뇌졸중 환자의 예후 및 중증도에 직접적으로 영향을 미치는지 혹은 콩팥기능저하로 인한 이차적 원인들에 의한 것인지를 부피와의 연관성을 통하여 알아 볼 수 있다. 아직까지 국내에는 콩팥기능의 저하와 뇌졸중 크기와의 연관성에 대한 연구는 전무하다. 따라서 본 연구에서는 급성허혈뇌졸중이 발생한 환자에서 콩팥기능과 뇌경색 부피의 상관관계를 분석하여 콩팥기능 저하가 뇌경색에 미치는 영향을 알아보았다.
대상과 방법
본 연구는 후향 관찰연구(retrospective observational study)로 2009년 1월부터 2013년 7월까지 을지병원에 발병 48시간 이내에 입원한 급성뇌경색 환자 중 내원 1시간 이내에 촬영한 뇌확산강조 영상이 있는 경우를 대상으로 하였다. 입원 시 시행한 혈청 크레아티닌 농도가 없는 환자, 급성기에 혈전용해술을 한 경우, 뇌경색 발생 이전에 장애가 있던 환자(수정랜킨지수가 2 이상), 내원 48시간 이내에 시행한 혈청 저밀도지질단백콜레스테롤 값이 없는 경우는 제외하였다. 본 연구는 을지병원 임상시험심사위원회로부터 승인을 받았으며(연구번호 19-95), 제시된 기준을 준수하였다.
내원 직후 시행한 혈청 크레아티닌 농도를 이용하여 사구체여과율을 계산한 후 60 mL/min/1.73 m2 미만으로 저하되어 있는 경우와 60 mL/min/1.73 m2 이상으로 증가되어 있는 경우로 환자를 나누었다. 본 연구에서 사구체 여과율의 측정은 환자들의 혈중 크레아티닌과 나이, 성별을 이용한 modification of diet in renal disease formula 공식을 사용하였다[12]. 뇌자기공명촬영(1.5- and 3.0-Tesla whole-body scanners; GE Signa, GE medical Systems, Milwaukee, WI, USA)은 단면 두께 5 mm로 하였다. 뇌경색 부피는 뇌자기공명촬영의 확산강조영상을 바탕으로 하여 평가하였다. 영상에서 병변으로 확인된 각 단면에서의 최대 직경의 길이 (A)와 이에 수직인 최대 직경의 길이 (B)를 프로그램상의 측정자를 이용하여 계측하였고 병변의 최대 수직 길이 (C)는 단면 두께에 병변이 관찰되는 단면 수를 곱하여 얻은 값으로 하였다. 최종 뇌경색 부피는 0.5 (cm, thickness)×A (cm)×B (cm)×C×0.5 계산식을 통해 얻었다[13]. 이 계산법은 임상에서 악성 허혈뇌졸중 환자의 감압수술이나 삼투압요법 같은 응급치료나 예후 예측 등에 추천되는 방법으로 이에 본 연구에서도 사용하였다[14,15]. 부피 측정의 정확성을 얻기 위하여 2명의 연구자가 각각 다른 시기에 같은 뇌자기공명촬영의 확산강조영상을 통하여 뇌경색 부피를 계측하였다. 이 연구자 간의 신뢰도 및 재현성은 급내상관계수(intraclass correlation)를 통하여 평가하였으며 0.79로 측정되었다.
의무기록 조사를 통해 환자의 나이/성별, 내원 시 혈압 등의 기본 신체사항, 뇌졸중의 과거력, 심장질환의 과거력, 고혈압, 당뇨병, 흡연 등 허혈성 혈관질환의 위험인자, 혈청 저밀도지질단백콜레스테롤, National Institutes of Health Stroke Scale (NIHSS)를 통한 내원 시의 신경학적 결손 정도, 발병 이전의 기존 장애 정도(수정랜킨지수) 등 뇌경색 급성기의 혈청 크레아틴농도나 뇌경색 부피에 영향을 미칠 수 있는 임상 및 검사실 변수를 조사하였다. 뇌졸중의 과거력은 뇌졸중 증상이 있으면서 병의원에서 진단 받은 경우로 하였다. 고혈압의 과거력 유무는 병의원에서 진단 받은 적이 있는 경우로 하였다. 과거력이 없을 경우 급성기를 지난 후에도 수축기 혈압이 140 mmHg 또는 이완기 혈압이 90 mmHg를 초과하는 경우가 2회 이상인 경우를 고혈압으로 판정하였다. 당뇨병 과거력 유무는 병의원에서 진단 받은 적이 있는 경우로 하였으며 과거력이 없을 경우, 급성기를 지난 후에 공복 혈당이 126 mg/dL 이상이거나 식후 2시간 혈당이 200 mg/dL 이상인 경우 당뇨병이 있다고 판정하였다. 흡연력은 현재 흡연 중이거나 최근 5년 이내 금연한 경우로 정의했다.
전체 환자를 Trial of Org 10172 in Acute Stroke Treatment classification system (TOAST) 분류에[16] 따라 뇌졸중 아형 3가지(대혈관죽상경화증, 소혈관폐색, 심장색전)로 나누었으며 각 아형 안에서 콩팥기능저하가 있는 환자와 없는 환자에서 뇌경색 부피를 비교하였다. 열공성뇌경색의 경우 다른 아형의 뇌경색보다 부피가 작기 때문에 이에 의한 영향을 보정하기 위하여 뇌졸중 아형에 따른 층화 분석을 하였다. 범주형 변수는 Pearson Chi-square test, Fisher’s exact test을 이용하였고 연속형 변수는 Student’s t test를 이용하여 콩팥기능에 따른 두 군간의 비교분석을 하였다. 발병 이전의 기존 장애 정도를 나타내는 수정랜킨지수는 Mann–Whitney U test를 통한 비모수 검정을 시행하였다. 뇌경색의 부피가 정규분포를 하지 않아서 자연로그를 하여 비교하였다. 성별, 나이, 고혈압, 당뇨병, 고지혈증, 뇌졸중의 과거력, 심장질환 과거력, 흡연력, 혈청 저밀도지질단백콜레스테롤 농도 등을 사구체여과율이 60 mL/min/1.73 m2 미만, 60 mL/min/1.73 m2 이상인 군에서 비교하여 양 군에서 차이가 나는 변수를 교란변수로 선정하였고 이 교란변수들을 공분산분석 모델에 입력해서 뇌경색 부피를 보정하였다. 마지막으로 콩팥기능 장애 단계에 따라 뇌경색 부피의 차이가 있는지를 확인하기 위하여 아형 별로 사구체여과율을 여러 단계로 나누어 콩팥기능저하의 심한 정도와 부피와의 연관성을 보았으며 Kruskal-Wallis test를 통하여 검정하였다. 사구체여과율의 단계는 30 mL/min/1.73 m2 미만, 30 mL/min/1.73 m2 이상이면서 60 mL/min/1.73 m2 미만, 60 mL/min/1.73 m2 이상의 세 군으로 나누었다. 통계분석은 SPSS 18.0 (IBM Corporation, Armonk, NY, USA)을 이용하였으며 모든 분석에서 p 값이 0.05 미만인 경우에 통계적으로 유의한 것으로 판정하였다.
결 과
본 연구의 환자등록 기간에 내원한 환자 중 48시간 이내의 뇌경색 발생 및 내원 1시간 이내에 촬영한 뇌확산강조 영상이 있는 환자는 1095명이었다. TOAST 분류상 3가지 아형에 포함되지 않는 환자 359명, 입원 시 시행한 혈청 크레아티닌 농도가 없는 환자, 내원 48시간 이내에 시행한 혈청 저밀도지질단백콜레스테롤 농도 수치값이 없는 환자 107명, 급성기에 혈전용해술을 한 경우와 뇌경색 발생 이전에 장애가 있던 환자(수정랜킨지수가 2점 이상) 224명을 제외하였다. 따라서 405명을 최종 분석에 사용하였다.
본 연구에서 여자 환자는 244명으로 전체 환자의 60.2%를 차지하였고 평균 연령은 68세(범위, 최소값: 29, 최대값: 97)였다. 심장 질환, 고혈압, 당뇨병 환자는 각각 101명, 288명, 182명으로 전체의 25.0%, 71.1%, 44.9%에 해당하였다. 흡연자는 133명인 32.8%에 해당하였으며, 이상지질혈증, 뇌졸중 과거력이 있는 환자는 각각 101명, 70명으로 30.0%, 17.3%의 비율을 보였다(Table 1). TOAST 아형 분류상 대혈관죽상경화증에 해당하는 환자는 243명(60.0%), 소혈관폐색 환자는 67명(16.5%), 심장색전 환자는 95명(23.5%)이었다.
각 아형 별로 보았을 때 대혈관죽상경화증 환자 중에서는 콩팥기능저하군에서 정상환자군보다 나이(72±9세 vs. 65±14세, p<0.01)가 많았고, 당뇨병(68.3% vs. 46.4%, p<0.01)과 고혈압(88.3% 대 62.3%, p<0.01)의 비율이 높았으나, 흡연자(21.7% vs. 43.2%, p<0.01) 43.2%, p<0.01)의 비율 및 내원 시 저밀도지질단백콜레스테롤(101.3±29.8 vs. 114.1 114.1±33.9, p=0.01) 값은 정상환자군에서 유의하게 높았으며, 성별, 뇌졸중 과거력, 입원 전 수정 랜킨지수 및 NIHSS는 양 군에서 유의한 차이가 없었다. 소혈관폐색 환자 중에서는 콩팥기능 저하군에서 정상환자군보다 나이가 많았고(74±9세 vs. 65±12세, p=0.01) 여자(69.2% vs. 24.1%, p=0.01)의 비율도 높았다. 흡연자(7.7% vs. 46.3%%, p=0.01)의 비율은 정상 환자군에서 높았다. 심장색전에 의한 뇌경색 아형을 가진 환자 중에서는 콩팥기능저하군에서 정상환자군보다 나이가 많았으며(75±10세 vs. 70±12세, p=0.04) 다른 변수에서 차이는 없었다(Table 2).

Comparison of risk factors and baseline demographicsbetween normal kidney function group and chronic kidney disease group according to stroke mechanism
이후 양 군에서 유의한 차이가 나는 변수를 교란변수로 선정하여 각 아형 별로 뇌경색 부피를 비교하였다. 보정 후에도 모든 아형에서 콩팥기능저하군과 정상환자군 사이의 비교에서 유의한 차이를 보이지는 않았다(Table 3, Fig.).
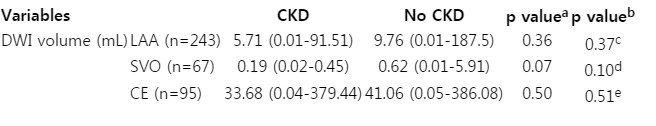
Comparison of infarct volumesbetween normal kidney function group and chronic kidney disease group according to stroke mechanism
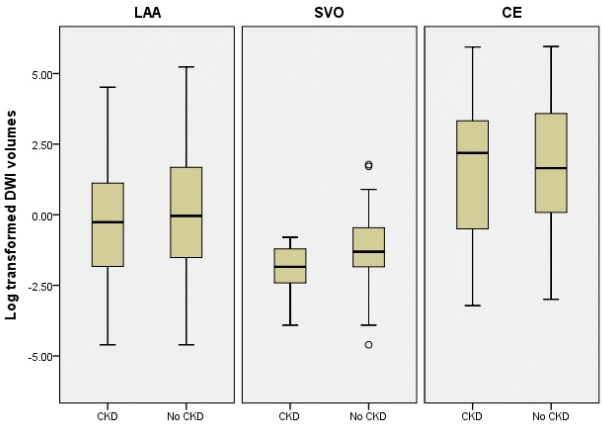
Comparison of log-transformed infarct volumes between normal kidney function group and chronic kidney disease group according to stroke ·mechanism. CKD; chronic kidney disease, LAA; large artery atherosclerosis, SVO; small vessel occlusion, CE; cardioembolism, DWI; diffusion weighted image.
최종적으로 콩팥기능저하의 심한 정도와 뇌경색 부피와의 연관성을 알아보기 위하여 만성콩팥병 단계에 따른 사구체여과율과 뇌경색 부피와의 검정을 시행하였고 의미 있는 관계는 없었다(Table 4).
고 찰
콩팥기능 감소는 죽상경화증을 가지고 있는 환자에서 허혈뇌졸중의 발병 및 그에 따른 기능적 악화와 연관되어 있다[17,18]. 또한 만성콩팥병은 대뇌 미세혈관질환이나 백색질 변성의 발생 및 예후와 연관되어 있다[19]. Sauer 등은 242명을 대상으로 한 연구에서 심방세동에 의해 발생한 급성뇌경색 환자에서 입원 당시 콩팥기능 감소가 나쁜 예후와 연관되어 있음을 밝혔다[20]. Yahalom 등이 821명의 환자를 대상으로 한 연구에서 만성콩팥병과 그에 따른 사구체여과율의 감소 정도가 뇌졸중의 사망과 예후에 대한 예측인자로 작용할 수 있음을 밝혔다[5]. 만성콩팥병은 출혈의 위험성을 높이며 이와 연관된 부작용의 위험성도 가지고 있다. Molshatzki 등이 128명의 환자를 대상으로 한 연구에서 중증도 이상의 콩팥기능감소를 가지고 있는 환자들은 대뇌출혈의 크기가 커지고 그에 따라 예후가 나쁘다는 것을 밝혔다[21]. Hao 등은 1,758명의 급성뇌졸중 환자를 대상으로 입원 당시 측정하였던 사구체여과율과 예후를 평가하였다. 뇌출혈 환자에서는 사구체여과율 감소가 나쁜 예후와 연관되어 있지만 허혈뇌졸중에서는 예후와 연관이 없는 것을 확인하였다[22]. 이러한 연구 결과들로 미루어 보아 콩팥기능 저하가 있는 환자들에서 급성뇌경색 병변의 부피를 측정하면 콩팥기능이 뇌경색 환자의 예후에 미치는 영향을 평가하는데 도움이 될 것으로 보인다[6,11]. 하지만 콩팥기능저하 정도와 급성뇌경색 크기에 대한 상관관계 자료는 거의 없는 실정이다[5]. 이전 연구들은 입원 당시 만성 콩팥병 환자들이 NIHSS 등으로 측정한 뇌졸중 중증도가 심한 것으로 보고하였다[5,17]. 하지만 본 연구에서는 콩팥기능 저하 환자군과 정상 콩팥기능 환자군 사이에서 NIHSS 점수의 차이가 3가지 아형 모두에서 없었다. 또한 콩팥기능 저하 환자군과 정상 콩팥기능 환자군에서 뇌경색 부피를 비교하여 보았을 때 양 군 간의 유의한 차이는 어떤 뇌졸중 아형에서도 보이지 않았다. 단 본 연구에서는 퇴원 이후의 신경학적 회복 정도 및 사망률에 대한 평가를 하지 않았기 때문에 콩팥기능 저하가 뇌졸중의 장기적인 예후에 미치는 영향을 판정할 수는 없다. 하지만 입원 시의 신경학적 손상 정도와 발생 당시의 뇌경색 부피에는 콩팥기능 저하가 영향을 미치지 않는다고 볼 수 있다. 하지만 언급되었던 기존의 뇌경색 중증도 및 사망률과의 연관성 연구결과와는 다른 해석이 가능하다. 만성 콩팥병 환자에서 신경학적 중증도 및 사망률은 뇌경색 자체뿐만 아니라 다른 전신질환의 영향을 받을 가능성이 높다. 혈관질환, 심방세동 등에 의한 심장색전, 감염 및 염증질환 등의 발병 가능성이 높기 때문이다. 또한 만성콩팥병 환자들은 콩팥기능의 저하로 인해 효과적으로 경구 항응고제 및 항혈전제를 사용하기 어렵고 약물치료농도를 측정하는 것이 어려우며, 응급관류치료 등에 한계가 있을 수 있어 신경학적 손상 및 사망률을 높일 것이다[18]. 이는 만성콩팥병 환자에서 발생한 허혈뇌졸중은 입원 당시 부피나 신경학적 손상과 연관성을 보았을 때 정상 콩팥기능 환자와 차이는 없지만 추후 사망률이나 장기적 신경학적 예후 정도에는 다른 이차적 요인들이 더 영향을 미쳐서 차이가 날 수 있다는 의미를 가진다.
본 연구의 장점은 뇌경색 부피 측정 시 전산화단층촬영, T2 강조 영상 혹은 액체감약반전회복(fluid attenuation inversion recovery) 영상을 이용하지 않고 뇌확산강조영상만을 사용하였다는 점이다. 또한 2명의 연구자가 같은 영상을 각각 다른 시기에 분석하였고 급내 상관계수를 통하여 재현성을 확인하였다는 점이다. 따라서 급성뇌경색 환자의 부피 측정에 있어 본 방법이 비교적 쉽고 정확하게 임상에서 적용할 수 있다는 장점을 확인하였다. 하지만 1개 병원에서만 진행된 연구로 뇌졸중 환자에 대한 대표성을 가지는데 한계가 있으며 입원 시에 측정한 크레아티닌 농도로 사구체여과율을 평가하였기에 콩팥조직검사나 콩팥손상을 나타내는 알부민뇨(albuminuria) 등의 검사를 통해서 진단할 수 있는 만성콩팥병 환자들이 누락되었을 가능성이 있다. 또한 본 연구는 콩팥기능저하를 만성콩팥병 단계에 따라 나누어 분석하였다. 하지만 뇌경색 부피와 콩팥기능저하 정도가 서로 상관관계를 보이지 않았다. 이에 뇌경색 아형 별로 더 많은 환자수를 가지고 콩팥병 시기와 뇌경색 부피에 대한 추가적 비교 연구가 필요할 것이다.
결론적으로 본 연구는 콩팥기능의 저하와 급성허혈뇌졸중 부피에 대한 국내의 유일한 연구로, 콩팥기능저하 자체가 급성뇌경색 부피 및 입원 시 신경학적 손상 정도에 독립적인 인자로 작용하지 않는다는 점을 발견하였다.
Acknowledgements
본 연구는 보건복지부 보건의료연구개발사업(과제고유번호: HI10C2020) 및 한미약품의 지원에 의하여 이루어진 것임.

