표현형 차이를 보인 CLCN1유전자(p.A313T)돌연변이를 가진 한국인 선천근긴장증 가족
Phenotypic Difference of CLCN1 Gene Variant (A313T) in a Korean Family with Myotonia Congenita
Article information
Trans Abstract
Myotonia congenita (MC) is a hereditary disease of the chloride channels of skeletal muscle caused by mutation of CLCN1. It characteristically manifests as delayed relaxation of the skeletal muscle or myotonia. It has a wide phenotypic variability, ranging from asymptomatic to severe disability. However, it is uncommon for a phenotypic difference to appear within a family. We report the first Korean family with the p.A313T mutation exhibiting marked phenotypic variability.
선천근긴장증(myotonia congenital, MC)은 골격근의 섬유막흥분성 이상으로 근이완에 장애가 생기는 유전근육병증이다. 증상은 영아기부터 시작하여 주로 상하지의 근긴장도가 증가하고 심한 경우 삼킴곤란도 생길 수 있다. 임상적으로 우성유전하는 톰슨(Thomsen)형과 열성유전하는 베커(Becker)형으로 나눌 수 있고, 두 경우 모두 CLCN1 (skeletal muscle chloride channel)유전자돌연변이에 의해 발생한다.
이와 관련된 유전자돌연변이는 100가지가 넘게 보고되어, 위에서 언급한 임상구분보다는 CLCN1유전자 돌연변이의 표현형에 따른 새로운 분류가 시도되고 있다[1]. 하지만 같은 유전자돌연변이 내에서도 무증상에서 중증까지 표현형이 다양하며, 이는 환경, 성별, 나이, 임신여부, 대립유전자의 발현(allelic expression) 같은 여러 요인이 관여한다[2].
저자들은 한국인에서 아직 보고되지 않은 CLCN1유전자돌연변이를 확인하였고 같은 돌연변이가 한 가족 내에서 임상양상과 신경생리학적으로 다른 표현형을 보인 경우를 경험하여 보고한다.
증 례
19세 남자가 10년 전부터 양손 위약감과 간헐근경련이 발생하여 왔다. 신경계진찰에서 의식은 명료하였고, 뇌신경검사는 모두 정상이었다. 양쪽 사지 근력은 정상이었고 오히려 나이 또래에 비해 체격이 좋았다. 심부건반사는 양쪽이 대칭적으로 다소 저하되어 있었다. 병적과다반사는 없었으나, 특징적으로 손을 잡았다 놓았을 때 근긴장증(grip myotonia)이 확인되었다. 또한, 반복운동 후에 근긴장증이 호전을 보이는 warm-up현상(phenomenon)이 있었다. 가족력에서 환자의 외할아버지(72세)와 외삼촌(53세)의 유전자이상은 아쉽게도 거부하여 확인하지 못하였으나 A313T돌연변이는 보통염색체우성유전양상을 보이는 점과 문진에서 이들이 손을 사용하는데 불편함이 있다고 하는 점을 고려하면 근긴장증이 있는 것으로 판단하였다(Fig. A).
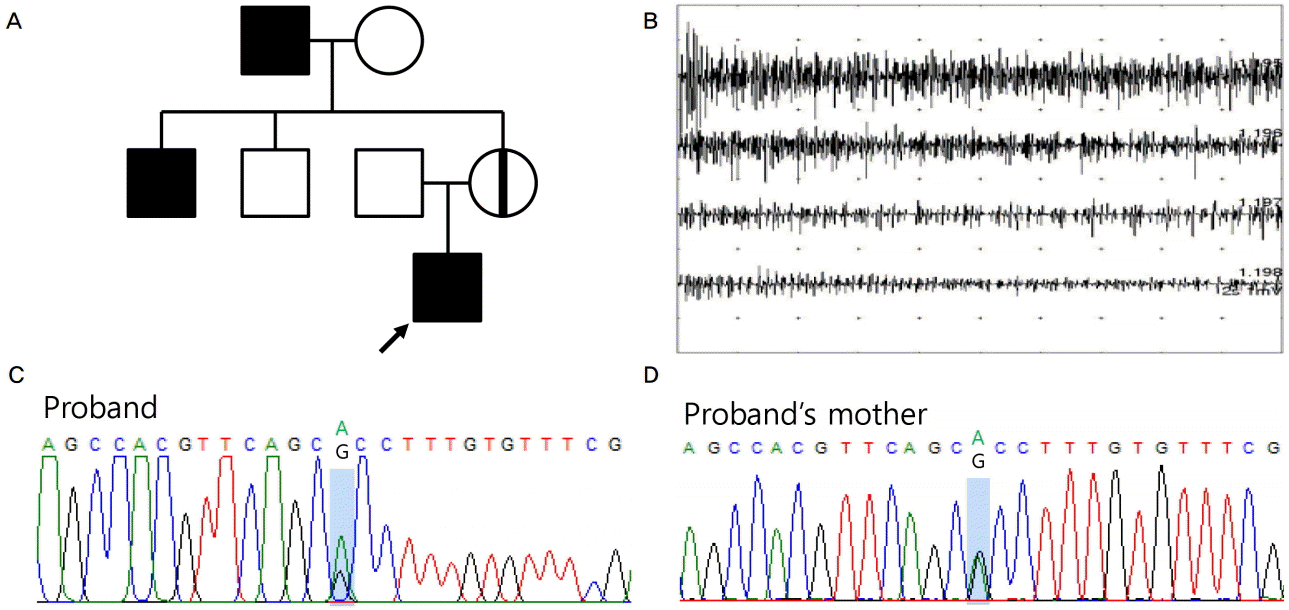
The pedigree, needle electromyographical finding and CLCN1 mutation found in the proband and his mother. (A) The pedigree shows the autosomal dominant inheritance pattern. (B) Needle electromyographical examination showed profuse myotonic discharges in the proband’s right vastus lateralis muscle. (C, D) The identical CLCN1 mutation c.937G>A (p.A313T) was found in both the proband and his asymptomatic mother (carrier).
혈액검사에서 크레아틴키나아제, 간효소수치를 포함한 기본혈액검사는 모두 정상이었고, 갑상선기능검사도 정상이었다. 신경전도검사는 정상이었으나, 침근전도검사에서 가쪽넓은근, 앞정강근, 위팔두갈래근, 긴손가락폄근 모두에서 전형적인 근육긴장방전이 나타났다(Fig. B).
환자의 어머니는 46세였으며 일상생활에 전혀 지장이 없었으며 신경계진찰에서 뇌신경검사와 근력검사 모두 정상이었다. 임상적으로 근긴장증도 보이지 않았으며, 침근전도검사에서도 정상이었다. 비슷한 증상을 가진 외삼촌과 외할아버지가 있어서 우성유전 가족력이 의심되었고, 환자에게서 임상양상과 신경생리학적으로 확인된 근긴장증과 함께 warm-up현상이 있으므로 우성유전의 선천근긴장증을 우선 고려하였다. 이를 확인하기 위해 CLCN1유전자검사를 하였고 엑손8번에 위치한 c.937G>A (p.A313T)에서 이형접합(heterozygous)유전자돌연변이가 발견되었고, 임상양상과 신경생리학적검사에서 근긴장증이 보이지 않았던 환자의 어머니에게서도 동일한 유전자돌연변이를 확인하였다(Fig. C, D). 환자의 외할아버지와 외삼촌은 신경계진찰이나 유전자검사를 원치 않아 하지 못하였다. 하지만 p.A313T돌연변이는 우성유전을 하는 것으로 알려져 있으며 문진에서 이들이 손을 사용하는데 불편함이 있다고 하여 이들 또한 임상적으로 근긴장증이 있는 것으로 생각하였다.
CLCN1의 엑손8번의 p.A313T의 이형유전자돌연변이는 한국인에서는 보고된 적이 없으며, 외국 문헌에 우성유전의 선천근긴장증으로 보고하였다. 환자에게는 증상완화를 위해 발프로산을 사용하였으며 현재까지 경과관찰 중에 있다.
고 찰
비디스트로피근긴장증(non-dystrophic myotonia, NDM)은 근긴장증이 주 증상인 비균질적인 유전근골격계질환이다. NDM은 크게 나트륨통로에 연관된 SCN4A (sodium channel, voltage gated type IV alpha subunit)와 염소통로와 연관된 CLCN1의 유전자 돌연변이로 발생하는 이온통로병증으로 분류한다. 이 중 가장 대표적인 질환이 선천근긴장증이며, 이 병은 수의운동 후 근육이완에 장애가 생기지만, 지속적인 근육을 운동하면 호전을 보이는 warm-up현상이 특징적이다. 톰슨근긴장증은 우성유전되며 증상은 대체로 유년기초반에 나타난다. 증상도 가벼워 오히려 지속적인 운동으로 증상이 호전되어 근육 비대가 있는 경우가 흔하다. 베커형은 열성유전되며 유년기후반에 나타나는데 근위약이 동반되기도 한다. 공통적으로 이들은 근육섬유막에 널리 분포되어 있는 CIC-1염소통로를 형성하는 CLCN1의 유전자돌연변이로 인해 발생한다.
선천근긴장증은 선천이상근긴장증(paramyotonia congenital), 나트륨통로근긴장증에 대한 감별이 필요하다. 선천이상근긴장증 환자는 임상적으로 추위 같은 환경요인에 의해 악화되며 warm-up현상이 나타나지 않는다. 반면 나트륨통로근긴장증은 warm-up현상이 나타나는 경우도 있으며, 저온단기운동검사(short exercise test with cold exposure)에 이상이 없는 것으로 감별할 수 있다. 이 검사는 기저선과 가장 낮은 복합근육활동전위(compound muscle action potential, CMAP)를 비교하여 40% 이상 감소할 때 비정상으로 판정하며[3], 선천근긴장증은 초기에 빠른 감소와 함께 빠른 복합근육활동전위의 회복을 보인다. 본 증례는 기저선에 비해 복합근육활동전위가 23% 감소되었다가 빠른 회복을 보였다.
본 증례와 동일한 우성유전의 p.A313T 변이는 현재까지 세 개의 외국문헌에서 임상정보와 함께 보고되었다(Table) [4-6]. 이 보고에서 환자가 병원에 왔을 때 나이는 4세부터 81세까지 다양하였으며 여성이 더 많았다. 또한 근긴장증상이 심한 환자도 한 명 있었으나 대부분의 경우에는 근긴장증이 가벼웠으며 근위축도 없었다. Plassart-Schiess 등도 한 가족 내에서 본 증례와 동일한 p.A313T 변이를 보고하였다. 이들도 우성유전을 보였고 가족 내에서 유전자돌연변이는 확인되었으나 무증상인 가족도 있었다. 이러한 보고를 보아도 CLCN1유전자는 동일한 유전자돌연변이에 의해 임상양상이 다양하며 이는 유전자돌연변이 이외에 다른 이차요인이 중요하게 관여할 것으로 생각한다. 그러므로 환자와 같은 돌연변이를 가진 어머니에서 증상이 없었던 것은 추후 증상이 발생할 가능성이 있기에 지속적인 추적관찰이 필요하다.
국내에서도 p.A313T 변이를 제외한 CLCN1의 유전자돌연변이로 발생한 선천근긴장증 환자군 10명의 임상양상과 유전자돌연변이에 대한 보고가 있었다. 이 중 9명이 남성이었으며, 7명은 본 증례와 같이 근비대가 있었다. 흥미롭게도 이 보고에서도 두 명의 환자가 같은 p.S189C의 유전자돌연변이를 보였으나 한 환자는 증상이 약했고 다른 환자는 증상이 심하였다[7]. 이와 같이 유전자돌연변이의 위치만으로는 임상증상을 설명하는데 한계가 있다. 이차적인 원인을 확인하기 위한 후속연구에서는 HEK293세포에 p.S189C을 포함하여 이미 알려진 CLCN1의 유전자돌연변이의 염소통로를 발현시켜 막전압고정법(patch clamp)실험을 하였다. 이를 통해 CLCN1유전자돌연변이마다 다른 염소채널의 반응을 확인할 수 있었고 이것으로 이차적인 병인을 증명하기도 하였다[8].
하지만 동일한 돌연변이에 의해 임상양상이 다양한 원인은 주로 성별이나 대립유전자발현(allelic expression)의 차이로 의해 설명한다[2]. 일반적으로 여성에서 근긴장증상이 약하고 남성에서 증상이 더 심하게 나타나는 경향이 있으며 이는 성호르몬의 영향으로 알려져 있다. 또한 경미한 선천근긴장증이 있는 여성이 임신을 하면 근긴장증이 악화되는 경우가 흔히 있는데 이는 임신 때문에 프로게스테론이 증가하여 CIC-1통로를 억제시켜 근긴장증이 악화되며 이것이 위의 가설을 뒷받침한다[9]. 또한 대립유전자의 발현의 차이도 같은 돌연변이를 가진 개인간 증상 차이의 원인이 될 수 있는데, 이는 대립유전자가 같은 양으로 발현되지 않아 같은 CLCN1정지돌연변이가 우성 또는 열성유전으로 나타난다고 보고하였다[10].
저자들은 우성유전가족력이 있으며 임상양상과 신경생리학적으로 근긴장증이 있는 환자와, 무증상인 어머니에서 동일한 CLCN1 유전자의 p.A313T이형접합돌연변이를 확인하였다. 이 유전자돌연변이는 한국인에서는 아직까지 보고된 적이 없으며, 같은 돌연변이를 가진 가족 내에서 임상증상이 다를 수 있으므로 선천근긴장증의 임상평가와 유전상담에 있어서 예시 가치가 있어서 보고한다.
Acknowledgements
이 논문은 2015년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(NRF-2015R1D1A3A 01019580).
