재발 시신경염 기왕력이 있는 Balo동심경화증
Balo's Concentric Sclerosis in a Patient with Previous Recurrent Optic Neuritis
Article information
Trans Abstract
Balo's concentric sclerosis is regarded as a rare variant of multiple sclerosis. Traditionally, Balo's concentric sclerosis was a post-mortem diagnosis, but the recent introduction of brain magnetic resonance imaging (MRI) scans may allow noninvasive access without biopsy. Brain MRI findings of Balo's concentric sclerosis is characteristic concentric configuration of alternating bands of white matter of different pathology, with relatively preserved myelination alternating with regions of demyelination in the cerebral white matter. We report a case of Balo's concentric sclerosis with recurrent optic neuritis.
Balo동심경화증은 다발경화증의 드문 아형으로 간주되는 뇌의 염증탈수초질환으로 뇌의 정상적인 수초고리와 탈수초된 고리들로 구성된 병변이 특징이다[1]. 질병특유의 뇌자기공명영상검사 소견은 T2강조영상에서 백색질에 고신호강도와 저신호강도의 띠가 교대로 있는 모습과 질병의 활성기에 T1강조영상에서 조영증강된 층과 조영증강되지 않은 층이 연속된 다수의 동심구조이다[2].
Balo동심경화증은 일반적으로 급속히 악화되는 경과를 보이며 예후 및 치료효과가 좋지 않은 것으로 알려져 있었으나 최근 진단기법의 발전과 빠른 치료를 통해 좋은 예후를 보이는 사례가 보고되고 있다[3].
Balo동심경화증은 정확한 유병률을 측정하기 어려울 정도의 매우 드문 질환으로[4] 아직 국내에 보고된 바가 없어 두 차례 시신경염 기왕력이 있는 환자에서 발생한 Balo동심경화증이 스테로이드치료 후 호전된 증례를 보고하고자 한다.
증 례
2008년 6월, 고혈압, 당뇨병 등의 과거력 및 약물력, 외상력, 가족력이 없는 28세 여자가 3일전 발생한 우측 시력저하로 왔다. 안와자기공명영상에서 이상소견을 보이지 않았으며 시각유발전위검사에서 우측 P100잠복기가 연장되었다. 환자는 메틸프레드니솔론(methylprednisolone) 1 g을 5일간 정주 후 경구 프레드니솔론(prednisolone)으로 변경하여 퇴원하였고 증상은 완전히 호전되었다. 2010년 5월, 환자는 2일전 발생한 양안 시력저하로 다시 왔다. 시각유발전위검사에서 양측 P100잠복기연장소견을 보였으며 뇌척수액올리고클론띠가 양성이었고 immunoglobulin G (IgG) 지수는 0.24로 정상범주였다. 환자는 메틸프레드니솔론 1 g을 5일간 정주 후 경구 프레드니솔론으로 변경하여 퇴원하였고 증상은 완전히 호전되었다. 이후 2012년 9월, 환자는 5일전 갑자기 발생한 좌측 편마비로 왔다. 환자는 시신경염으로 2차례 입원치료 한 것 외엔 특이과거력이 없었으며 최근 바이러스감염력이나 예방접종력이 없었다. 좌측편마비 외에 시력저하, 두통, 현훈, 오한, 근육통 등 다른 증상은 호소하지 않았고 신체진찰에서 열, 발진 등의 이상이 관찰되지 않았다.
신경학적 진찰에서 근력은 좌측 상하지근력이 Medical Research Council (MRC) 4등급이었고 좌측의 세갈래근, 두갈래근, 무릎, 발목반사가 모두 항진되어 있었다. 이외에 색각이상, 시력저하, 얼굴마비, 구음장애, 감각이상, 병적반사 등의 다른 신경계증상은 관찰되지 않았다. 혈액검사에서 항Ro 및 항La항체, 항중성구세포질항체, 항핵항체, 류마티스인자, 항카디오리핀항체, 루푸스항응고인자, 항인지질항체, 보체C3와 C4, 유리C단백질과 S단백질, 항사구체기저막항체, 페리틴, 트랜스페린, 적혈구침강속도, C-반응단백질, 갑상샘자극호르몬, 삼요오드 티로닌, 유리T4, 항갑상샘글로불린항체, 항갑상샘미세소체항체검사에서 이상소견을 보이지 않았다. 뇌척수액과 매독혈청검사, 혈청사람면역결핍바이러스항체, 엡스타인-바바이러스항체, 거대세포바이러스항체, 볼거리바이러스는 검출되지 않거나 음성이었고 간접면역형광반응법으로 검사한 항아쿠아포린4항체 또한 검출되지 않았다. 종양감별을 위해 암배아항원, 알파태아단백질, 암항원125에 대한 검사를 진행했고 기생충감염확인을 위해 간흡충, 폐흡충, 유구낭미충, 스파르가늄, 광동주혈흡충, 개회충에 대한 항체검사를 시행했으며 정상이었다.
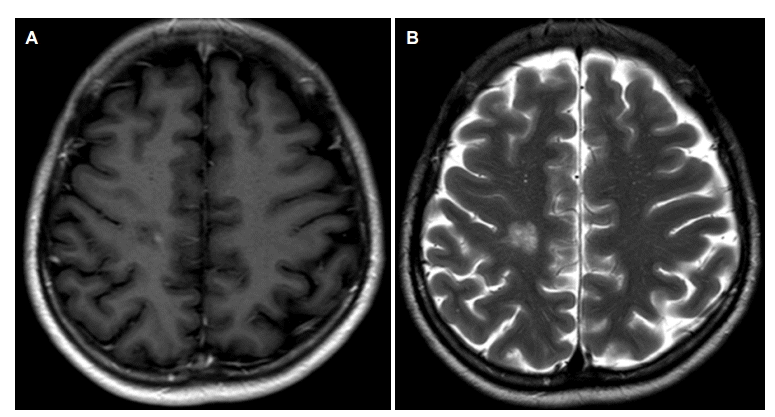
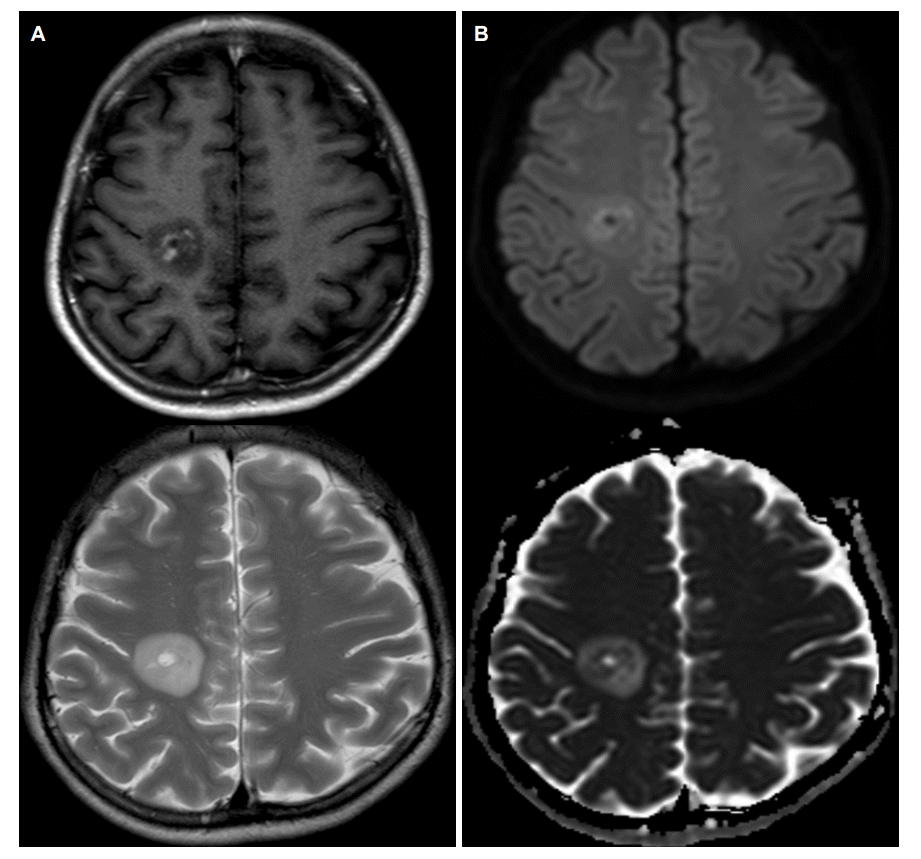
뇌척수액검사에서 뇌압 15 cmH2O, 백혈구 2/mm3, 단백질 17 mg/dL, 포도당 67 mg/dL였으며 올리고클론띠, 암세포는 관찰되지 않았고 IgG 지수는 0.32로 정상범주였다. 사지 신경전도검사는 정상이었으며 시각유발전위검사에서 양측 P100잠복기연장이 관찰되었다. 증상발생 후 촬영한 뇌자기공명영상에서 우측 전두엽백색질부위에 T1강조영상과 T2강조영상에서 지름 1.5 cm이며 고신호강도를 동반한 원심성의 고리모양과 층구조를 보이는 병변이 관찰되었고(Fig. 1-A) 확산강조영상에서 고신호강도를 보이는 원심성의 고리모양의 층구조를 보이는 병변과 함께 겉보기확산계수에서 이에 상응하는 부위에 저신호강도가 보였다(Fig. 1-B). 추가로 뇌자기공명분광검사와 뇌자기공명관류영상검사를 시행하였다. 뇌자기공명분광검사에서 N-acetyl aspartate/creatine비가 1.62로 감소되어 있었고 choline/creatine비는 1.19, choline/N-acetyl aspartate비는 0.73으로 증가되어 있었다(Fig. 2-A). 뇌자기공명관류영상에서 해당 병변에 관류증가소견은 보이지 않았다(Fig. 2-B). 환자는 메틸프레드니솔론 1 g을 5일간 정주 받았으며 치료시작 3일째부터 증상호전을 보이기 시작했고 1주일 후 모든 증상이 호전되었다. 치료 두 달 후 추적 뇌자기공명영상검사에서 해당 위치에 병변이 관찰되나 크기가 많이 줄어있었다(Fig. 3-A, 3-B). 이후 현재까지 환자의 증상 재발은 없었다.
(A) Initial brain MRI shows diffuse high signal intensities in the upper medulla, pons, midbrain, bilateral thalamus and multifocal scattered high signal intensities in both cerebral subcortex and cortex on FLAIR images (A-1) and ADC images (A-2). These lesions shows iso-signal intensity on diffusion-weighted images (A-3). (B) Follow-up brain MRI reveals nearly complete resolution of the lesions in the brainstem and cerebral subcortex and cortex on FLAIR images. MRI; magnetic resonance imaging, FLAIR; fluid-attenuated inversion recovery imaging, ADC; apparent diffusion coefficient.
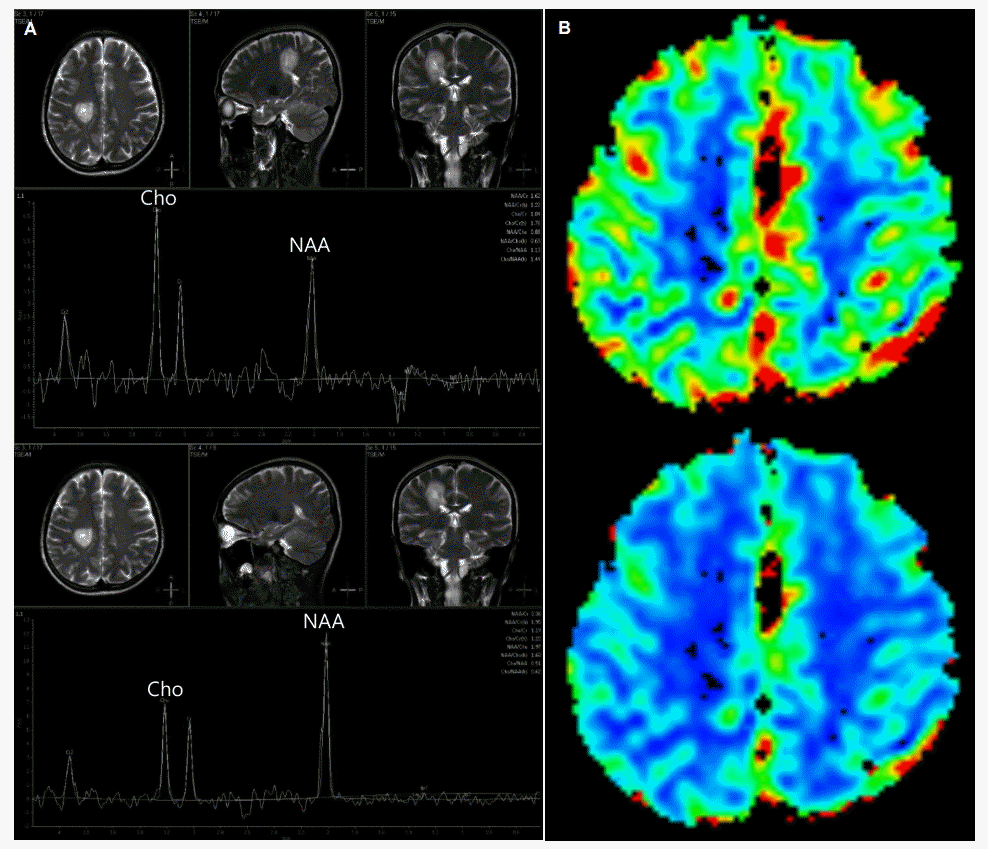
MRS and MR perfusion images. (A) MRS of the concentric lesion shows increased choline peak and decreased N-acetyl aspartate peak. (B) MR perfusion shows no evidence of perfusion increase in right frontal white matter lesion. MRS; magnetic resonance spectroscopy, MR; magnetic resonance, Cho; choline, NAA; N-acetyl aspartate.
고 찰
본 증례는 뇌자기공명영상, 뇌자기공명분광검사와 뇌자기공명관류영상검사 등의 결과를 종합해 봤을 때 중추신경계탈수초질환의 범주로 생각된다. 중추신경계탈수초질환에는 다발경화증, 실더병(Schilder disease), 마르부르크병(Marburg disease), Balo동심경화증, 데빅병, 급성파종뇌척수염 등이 있다. 이 중 Balo동심경화증은 드문 질환으로 다발경화증의 아형으로 알려져 있다. 평균 발병나이는 34세이지만 3세에서 62세까지 다양하고 아시아인 여성에서 호발하는 것으로 보고되고 있다[5,6]. 국소적 근력 저하, 실조증, 감각이상, 복시와 같은 전형적인 다발경화증의 증상을 보일 수도 있으나 대다수는 두통, 인지기능저하, 행동변화, 무언증, 소변실금, 경련, 실어증, 편측 마비와 같은 뇌내종괴에 의한 증상들을 보인다[5]. 자기공명영상에서 병변은 뇌백색질에 호발하며 이외에도 기저핵, 교뇌, 소뇌에 발생한 보고가 있다[7]. 스테로이드가 1차 치료로 알려져 있으며 스테로이드에 효과가 없을 경우 명확한 근거는 없으나 2차 치료로 혈장교환술을 시도해 볼 수 있다. 예후는 완전한 호전을 보이는 경우에서 심각한 후유장애 또는 사망에 이르기까지 다양하며 약간의 후유장애를 남기면서 호전되는 경우가 가장 흔하다[4].
본 증례의 경우 성인이며 병변이 편측에만 있었기 때문에 주로 소아에서 양측성으로 발생하는 실더병의 가능성이 낮다. 또한 스테로이드치료에 좋은 반응을 보이며 경과가 양호한 점으로 보아 스테로이드에 반응이 좋지 못하고 치명적인 경과를 보이는 마르부르크병의 가능성도 낮다. 데빅병의 경우 항아쿠아포린4항체의 특이도가 98%이므로 항아쿠아포린4항체가 검출되지 않은 본 증례의 경우 데빅병의 가능성도 낮다. 또한 예방접종력, 바이러스감염 등의 선행요인이 없었으며 병변이 다발성으로 발생하지 않은 점으로 보아 급성파종뇌척수염의 가능성도 낮다. 스테로이드에 좋은 반응을 보이면서 증상재발이 없었고 뇌자기공명관류영상에서 관류증가를 보이지 않아 일반적으로 스테로이드에 반응이 좋지 않거나 일시적인 반응을 보이고 뇌자기공명관류영상에서 관류증가를 보이는 종양성병변의 가능성도 낮다. 본 증례의 경우 병변의 지름이 1.5 cm로 보통 지름이 2 cm 이상이며 조영증강되는 열린 고리모양이 특징적인 tumefactive다발경화증의 가능성도 낮다[5,8].
본 증례는 뇌자기공명영상에서 관찰되는 병변이 Balo동심경화증에서 특징적으로 관찰되는 동심성의 층판구조와 유사하며 다른 탈수초질환 및 종양성질환에서 보이는 뇌자기공명관류영상의 관류증가가 보이지 않았고 스테로이드치료에 좋은 반응을 보인 점으로 보아 Balo동심경화증의 가능성이 가장 높다고 생각된다.
본 증례는 Balo동심경화증 진단 당시 32세의 한국인 여성으로 평균 발병나이 및 호발인종, 성별에서 기존의 역학과 유사했다. 편측 마비증상이 있었으며 자기공명영상에서 뇌백색질에 병변이 관찰되었고 스테로이드에 대한 효과가 좋아 이 역시 기존의 보고들과 일치하는 소견이었다. 하지만 스테로이드치료 후 완전한 호전을 보였으며 올리고클론띠양성소견을 보인 점에서 기존 증례의 일반적인 소견들과 차이가 있었다.
현재까지 Balo병변과 다발경화증과의 연관성이 정확히 밝혀지지는 않았다. 기존 보고들에서는 재발-완화형다발경화증의 경과 중에 Balo병변이 관찰되는 경우, 약 55%의 Balo동심경화증 환자에서 전형적인 다발경화증의 병변이 관찰되었던 보고도 있었고 처음 Balo병변을 보였던 환자가 이후 전형적인 다발경화증으로 재발하는 경우도 있었다[5]. 또한 뇌척수액검사에서 올리고클론띠양성소견을 보였던 Balo병변을 지닌 환자가 다발경화증으로 진행하는 경우도 있었으나[7] Balo병변을 보이는 다발경화증 환자 11명 중 1명에서만 올리고클론띠가 관찰되었던 보고도 있었다[9]. 이 외에 Balo병변이 있는 시신경척수염, 시신경척수염범주질환의 보고에서 Balo병변의 아쿠아포린4결핍이 발견되어 시신경척수염 또는 시신경척수염범주질환과 Balo동심경화증 간에 공통되는 면역기전이 존재할 가능성을 시사하기도 했다[10]. 본 증례의 경우 2번째 시신경염으로 입원치료 했을 당시 뇌척수액올리고클론띠가 양성소견을 보였다. 하지만 Balo병변을 보였을 때에는 올리고클론띠가 음성소견을 보였고 이후 증상의 재발이 없었으며 추적 뇌자기공명영상에서 전형적인 다발경화증병변도 보이지 않았다. 또한 두 차례의 시신경염이 있었으나 항아쿠아포린4항체가 음성이었고 횡단척수염의 증거가 없었으며 시신경척수염을 시사하는 뇌영상소견도 보이지 않았다. 하지만 Balo병변과 다발경화증, 시신경척수염 또는 시신경척수염범주질환과의 연관성을 고려할 때 향후 시신경염 또는 횡단척수염이 재발할 경우 재발-완화형다발경화증 또는 시신경척수염범주질환 등의 다른 진단에 대해서도 고려해야 하겠다.