파킨슨병 환자에서 심혈관계 지표를 이용한 자율신경기능 평가
Evaluation of Autonomic Dysfunction in Parkinson Disease by Cardiovascular Autonomic Indexes
Article information
Trans Abstract
Background:
Cardiovascular autonomic dysfunction is one of the most frequent non-motor symptoms in idiopathic Parkinson disease (IPD). Several cardiovascular autonomic indexes (CAIs) have been reported to represent the degree of autonomic dysfunction in various neurodegenerative diseases. However, quantitative assessment by autonomic function tests in IPD has not been fully evaluated yet. The aim of this study is to investigate the usefulness of the quantitative autonomic test for detecting subclinical cardiovascular autonomic dysfunction and their correlation to the clinical severity of motor symptoms in IPD.
Methods:
Four parasympathetic and sympathetic indexes during cardiovascular autonomic tests were compared between patients with IPD (n=31, age=65.8±9.14, Hoen&Yahr (H&Y) stage=2.1±0.68) and age matched healthy controls (n=30, age=63.2±7.56). Parasympathetic indexes include expiration:inspiration ratio (E:I ratio), valsalva ratio, 30:15 ratio, and vagal barosensitivity. Sympathetic indexes are pressure recovery time, sympathetic index 1, sympathetic index 3 and adrenergic baroseneitivity. To demonstrate the correlation between severity of clinical motor symptoms and the autonomic abnormality, we also compared the H&Y stage and the abnormalities of those CAIs.
Results:
E:I ratio (p=0.009) and Valsalva ratio (VR) (p<0.001) were significantly different between IPD and control groups. Among the parameters, E:I ratio (r=-0.466, p=0.005) showed significant negative correlation with severity of clinical motor symptoms in IPD (H&Y≤3).
Conclusions:
Among the CAIs, E:I ratio, VR are useful in detecting subclinical autonomic cardiovascular dysfunction in IPD. E:I ratio may be the possible evaluation method revealing the severity of clinical motor symptoms in IPD.
서 론
파킨슨병에서 보이는 비운동증상 중 자율신경계 기능 이상은 그 빈도가 높을 뿐만 아니라 파킨슨병 환자의 사망률에 영향을 미칠 수 있어 중요한 증상이다[1-3]. 이전 보고에서, 파킨슨병에서 자율신경계 증상의 유병률은 다양하며(14-80%) 나이 및 질병의 진행 정도와 증상의 정도와의 연관성은 일관된 결과를 보여주지 못하였다[3,4]. 또한, 파킨슨병 환자에서 병이 진행함에 따라 교감신경계 및 부교감신경계 각각의 기능 저하에 대한 여러 보고가 있으나, 어느 기능이 선행하여 저하되는지 또는 좀더 심하게 저하되는지 여부에 대해서는 불분명하다[3,5-8]. 이러한 결과는 자율신경계의 기능을 생리적으로 검사할 수 있는 방법이 연구자마다 다르고, 검사 결과의 표준화가 되지 않았기 때문으로 생각된다.
파킨슨병 환자에서 질병의 임상 진행 양상과 자율신경기능검사에서 얻어진 여러 지표(index)와의 연관성 여부를 확인한 보고는 있으나[5,9], 정량적으로 운동 증상의 진행 정도와 각 자율신경검사지표와의 상관성 여부를 확인한 보고는 없다. 최근에는 파킨슨병 외에도 여러 가지 신경계 질환과 당뇨병, 또는 약제에 의한 자율신경 장애의 임상적 중요성이 인식되어, 그에 대한 객관적인 검사 방법 및 지표가 연구되어 왔다.
저자들은 이러한 교감신경계 및 부교감신경계 기능검사의 여러 지표들을 이용하여 파킨슨병 환자의 심혈관계 자율신경기능이상 유무를 정량화하고, 파킨슨병에서 각 심혈관계 자율신경지표와 운동 증상 진행 정도의 연관성을 분석하고자, 본 연구를 시작하였다.
대상과 방법
1. 대상
본 연구는 2010년 6월부터 2013년 9월까지 순천향대학교 부천병원 신경과에 입원하거나, 외래를 방문하였던 특발성파킨슨병(idiopathic Parkinson disease, IPD) 환자 중 본 검사에 응한 31명을 대상으로 하였다. IPD는 United Kingdom Parkinson’s Disease Society Brain Bank의 진단기준에 따라 임상적으로 합당한(clinically probable) IPD 환자만을 포함시켰다. 치매, 만성폐쇄성 폐질환, 심부전 등으로 인한 전신 쇠약으로 발살바수기를 효과적으로 수행할 수 없었던 환자는 연구대상에서 제외되었으며, 발살바수기를 제대로 수행할 수 있는 Hoehn and Yahr stage (H&Y)가 3 이하인 환자를 대상으로 하였다. 항파킨슨약을 복용하는 환자의 경우 약의 효과가 있을 때 검사를 진행하였다. 또한 본 연구 진행 당시, 기립저혈압 등의 심혈관계 자율신경증상이 동반되지 않은 IPD 환자를 대상으로 하였다. 대조군은 동 연구기간 중에 순천향대학교병원 신경과에 입원하거나 외래 방문하였던 유사한 연령대의 사람들 중에서 파킨슨 증상이 관찰되지 않고 의식이 명료하며 보행에 지장이 없는 30명을 선택하였다. 대조군의 임상 진단명은 반사성실신(reflex syncope)으로 복합자율신경중증도점수(composite autonomic severity score, CASS) [10]의 심혈관계 지표가 정상인 환자만을 포함시켰다. 자율신경기능검사를 시행하는 당일에는 모든 환자군과 대조군이 금식을 하였고, 복용중인 약물을 중단하였다.
2. 방법
1) 각 자율신경지표의 측정(Fig.)
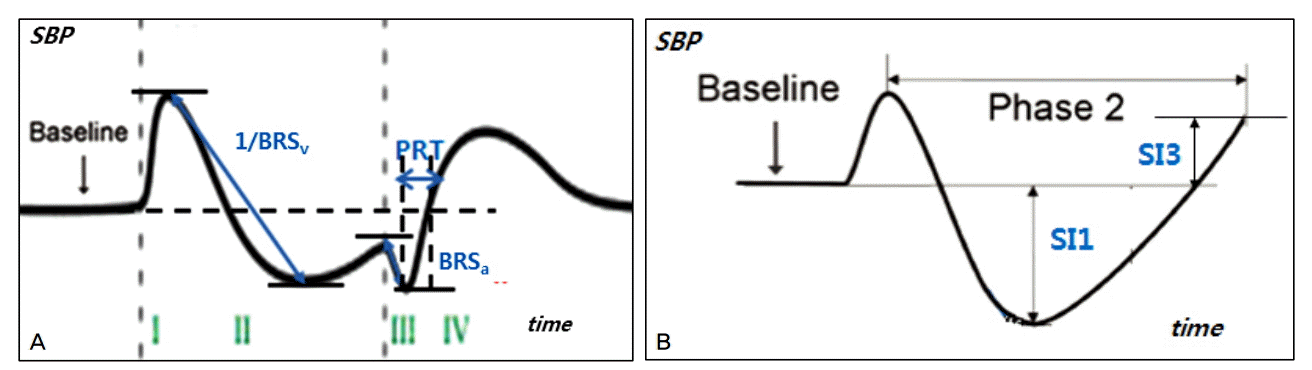
Parasympathetic and sympathetic indexes. (A) A typical 4-phases of SBP profile evoked by valsalva maneuver and several cardiovascular autonomic indexes. (B) Sympathetic indexes (SI1, SI3) are calculated from phase II of valsalva maneuver. BRSv; vagal baroreflex sensitivity, PRT; pressure recovery time; BRSa; adrenergic baroreflex sensitivity
심혈관 계통의 자율신경기능검사는 지속적으로 혈압 및 심박수를 기록하기 위해 Finometer® Pro (Finapros Medical System® Inc., Amsterdam, Netherlands)를 사용하였으며, 이전의 문헌에 서술된 대로 시행하였고, 간략히 기술하면 아래와 같다[11-13].
(1) 부교감신경계 지표
① Expiration:inspiration (E:I) ratio
환자가 편안하게 누운 자세에서 심전도 전극을 부착하고 일정하게 호흡을 유도한 후 1분간 기준값을 기록하였다. 그 후 분당 6번의 호흡속도(들숨 5초, 날숨 5초)로 8회의 규칙적인 호흡을 시키면서 기록하였다. 1차 검사 시행 후 2분간 휴식을 취한 다음 1차 검사와 동일한 방법으로 2차 검사를 진행하였다. 2차례의 검사 중 효과적으로 수행된 검사를 채택하여, 평균 호기시 심박동–흡기시 심박동 비율을 측정하였다.
② 30:15 ratio
환자를 20분 동안 안정된 상태로 쉬게 한 후 기준 혈압과 심박동을 기록하였고, 일어난 후에 1-3분 동안 연속적으로 혈압과 심전도를 기록하였다. 결과는 30번째 박동 주위의 가장 긴 R-R 간격을 15번째 주위의 가장 짧은 R-R 간격으로 나누어서 구하였다.
30:15 ratio=30th beat (가장 긴 R-R 간격)/15thbeat (가장 짧은 R-R 간격)
③ 발살바비(Valsalva ratio, VR)
안정된 상태에서 환자의 머리를 30°정도 올린 상태로 1분 동안 기준값을 기록하였다. 환자에게 깊게 숨을 한번 들이쉬게 한 후 40 mmHg로 15초 동안 유지할 수 있게 마우스피스를 불게 하였다. 부는 것을 멈추고 1분 동안 심박동수와 혈압을 기록한 후 환자를 3분간 휴식을 취하게 하였다. 어느 정도 휴식을 취한 후에 3회 이상 반복해서 검사를 시행하였으며 효과적으로 시행한 발살바수기를 채택하였다. VR은 가장 빠른 심박동수를 가장 느린 심박동수로 나누어서 계산하였다.
VR=maximum HR/lowest HR occurring within 30 s of peak HR
④ Cardiovgal barosensitivity (BRSv)
Fig. 1-A는 발살바수기를 시행하는 동안 수축기 혈압을 기록한 그림으로 BRSv는 early phase II에서 millisecond (ms) 당 수축기 혈압이 떨어지는 역기울기(regression slope)로 측정하였다.
(2) 교감신경계 지표
효과적으로 시행한 발살바수기를 이용하여 각 교감신경계지표를 측정하였다.
① Pressure recovery time (PRT)
Fig. 1-A에서 표기한 바와 같이 PRT는 phase III의 가장 낮은 수축기 혈압이 기저의 혈압 수준으로 돌아올 때까지 걸린 시간(ms)으로 측정하였다.
② Adrenergic barosensitivity (BRSa)
Fig.1-A에서 표기한 바와 같이 phase III에서 수축기 혈압이 떨어진 정도를 PRT로 나눈 값으로 계산하였다.
③ Sympathetic index 1 (SI1)
Fig. 1-B는 발살바수기 중 phase II 기간의 수축기 혈압을 기록한 그림으로, SI1은 phase II에서 수축기 혈압이 떨어진 정도로 측정하였다.
SI1=baseline systolic blood pressure (SBP)-lowermost SBP in phase II
④ Sympathetic index 3 (SI3)
Fig. 1-B에서 phase II가 끝나는 지점의 수축기 혈압과 기준치의 수축기 혈압의 차이로 측정하였다.
SI3=baseline SBP-SBP in the end of phase II
2) IPD 환자의 운동 증상 진행 정도의 측정
IPD 환자에서 운동 증상의 진행 정도는 H&Y를 이용하여 평가하였다. 자율신경기능검사를 시행할 당시 환자마다 동일한 신경과 의사가 H&Y를 측정하고 기록하였다.
3. 자료분석
통계분석은 Statistical Product and Service Solutions (SPSS) 17.0 (SPSS Inc., Chicago, IL, USA)를 이용하였다. IPD 환자군과 대조군에서 각 지표의 차이 여부는 독립표본 T검정과 Levene의 등분산 검정을 이용하여 유의성을 검정하였다. 또한, IPD 환자에서 각 지표와 H&Y의 상관관계 여부를 평가하기 위하여 Spearman의 순위상관분석을 이용하였다. p값이 0.05 미만인 경우에만 통계적으로 유의한 것으로 판정하였다.
결 과
본 연구의 대상이었던 IPD 환자 31명(남자 5명, 여자 26명)은 평균 연령은 65.8세였고 유병 기간은 30.2개월이었다. 연구는 발살바수기를 제대로 수행할 수 있는 환자를 대상으로 하였기에 H&Y 4, 5에 해당하는 환자는 포함되지 않았으며, 일일레보도파등가 용량(daily levodopa equivalent dose)과 약의 효과가 있을 때의 H&Y 지표를 조사하였다(Table 1). 대조군 30명(남자 17명, 여자 13명)의 평균연령은 63.2세로 IPD 환자와 대조군 사이에 연령은 유의한 차이가 없었다(p value=0.229).
IPD 환자와 대조군의 교감신경계 및 부교감신경계 지표에 따른 두 군간의 평균 차이는 Table 2에서 보는 바와 같다. 각 지표 중 E:I ratio (p value=0.009)와 VR (p value<0.001)만이 IPD 환자와 대조군에서 유의한 차이가 관찰되었다. 그러나, 그 외 30:15 ratio, BRSv, PRT, BRSa, SI1, SI3는 두 군 사이에서 유의한 평균차이를 보이지 않았다.
IPD 환자의 임상적 운동 증상의 진행 정도에 따른 자율신경기능 저하를 관찰하기 위하여 H&Y 와 각 자율신경기능지표들의 상관관계를 비교하였다. IPD 환자에서 H&Y 증가에 따라 E:I ratio (p=0.005)만이 유의하게 감소하였다(Table 3).
고 찰
파킨슨병 환자를 대상으로 한 자율신경기능검사에서 이상 소견이 자주 관찰된다는 것은 이미 여러 저자에 의해 보고된 바 있으며, 심혈관계 자율신경기능의 검사는 여러 방법이 이용되고 있다. 그러나, 현재까지 보고들은 파킨슨병의 진행 과정에서 교감신경계 또는 부교감신경계 검사 지표의 이상에 대해 일치된 결과를 보여주지 못했다[3,6-9,14-20]. van Dijk 등[9]은 파킨슨병(H&Y 1: 7명, H&Y 2: 28명, H&Y 3: 21명, H&Y 4: 10명, H&Y 5: 1명) 환자를 대상으로 Ewing battery [9,21]를 이용하여 심혈관계 자율신경 지표를 측정하였고, 임상적으로 진행된 파킨슨병 환자에서만 자율신경기능검사에서 이상 소견을 보이며 그 중 교감신경계 지표의 이상만이 관찰된다고 하였다. 하지만 직접적으로 파킨슨병 환자의 운동 증상의 정도(H&Y)에 따라 각 자율신경기능지표를 비교하지는 않았다. 한편, 초기 파킨슨병 환자(H&Y≤2)를 대상으로, 123I-metaiodobenzylguanidine을 이용한 심장의 노르에피네프린 수용체를 측정한 보고[16]와 저산소증을 유발한 후 심박동수, 맥파전달시간(pulse transit time), 분당 환기량(minute ventilation)을 측정한 보고[14]에서는 운동 증상이 경미한 파킨슨병 환자에서도 교감신경계 기능이 저하됨을 확인함으로써 초기 파킨슨병에서도 교감신경계의 침범이 있음을 증명하였다. 하지만, 상기 보고들은 대조군의 연령에 대한 보정이 이루어지지 않았으며 검사에 참여한 환자수가 적은 문제점이 있었다. 또한, 자율신경기능검사에서 이미 기립저혈압이 확인된 상당수의 파킨슨병 환자를 연구대상에 포함시켜, 결과의 신빙성은 논란이 될 수 있으며[16], 저산소증을 유발하여 연구를 진행한 점은 윤리적 문제를 야기시킬 수 있다[14].
반면, 운동증상이 경미한 파킨슨병(H&Y≤1.5, 7명) 환자를 대상으로 한 연구[8]에서는, 심초음파 및 24시간 동안 심박동수와 혈압을 기록한 후 Pathfinder 700 software (Delmar Reynolds, Spacelabs Healthcare® Inc., Snoqualmie, WA, USA)를 사용하여 7가지 부교감신경계 지표를 측정하고, 이소프로테레놀(isoproterenol)과 에피네프린(epinephrine)을 환자에게 주입 후 심장의 수축력 및 심장박출량(cardiac output)을 구하여 교감신경계 지표를 측정하였다. 결과로 운동증상이 경미한 파킨슨병 환자에서 부교감신경계 지표의 이상만이 확인되었다. 저자들은 부교감신경계의 기능 저하가 교감신경계 기능 저하보다 선행한다고 주장하였으며, 교감신경지표의 이상이 보이지 않는 것은 파킨슨병 초기에는 교감신경계가 완전히 손상되지 않아 남아있는 교감신경 섬유가 충분히 자율신경조절을 담당할 수 있기 때문이라고 추론하였다. 하지만, 연구대상의 수가 적고, 교감신경계 및 부교감신경계 지표를 측정하기 위해서 많은 시간과 장비가 필요한 점, 검사가 침습적이며 환자의 활력징후에 영향을 주는 약물을 주입한 점은 임상 의사가 이용하기에 어려움이 있다.
본 연구는, 비침습적이고 간단하게 Finometer® Pro (Finapros Medical System® Inc., Amsterdam, Netherlands)를 이용하여 연속적으로 혈압과 심박수를 기록하고 수치화하여 심혈관계의 교감신경과 부교감신경의 기능을 측정하였다. 압반사(baroreflex)는 정맥환류(venous return)가 감소하는 상황에서 심박수와 말초저항(peripheral resistance)을 조절하여 혈압을 일정하게 유지하는 기능을 한다[22]. 발살바수기를 이용한 이러한 압반사의 감수성(baroreflex sensitivity, BRS) 측정은 심혈관계의 자율신경기능을 나타내는 가장 좋은 지표가 될 수 있다. 그 중에서 BRSv는 미주신경감수성 정도를 정량화하는데 널리 쓰여지고 있으며, 그 값이 클수록 부교감신경계의 기능 저하가 심함을 의미한다. 압반사에서 교감신경감수성 정도를 정량화하기 위해서는 PRT [11]를 이용하여 BRSa를[13] 측정하며, 값이 작을수록 교감신경계 기능 저하가 심함을 의미한다. PRT (sympathetic index 5, SI5), BRSa (sympathetic index 6, SI6)를 포함한 여섯 가지 교감신경지표(sympathetic index, SI)를 이용하여 교감신경계 기능 저하를 정량화하고, 임상적으로 기립저혈압의 정도와의 상관성 여부를 확인한 보고에 따르면[12], 모든 SI는 교감신경계 지표로서 의미가 있었고, 그 중에서 SI3이 임상적으로 교감신경계의 기능 저하와 상관성이 있었으며, SI1이 그 뒤를 따랐다. 본 연구에서 사용한 SI3와 SI1는 그 값이 클수록 교감신경계의 기능 저하가 심함을 의미한다.
본 연구에서는 위와 같은 교감신경계 및 부교감신경계 지표들을 이용하여 비교적 운동 증상이 심하지 않은 IPD 환자의 심혈관계 자율신경기능 저하에 대해 확인하고, 각각의 자율신경계 지표가 가지는 임상적 의미에 대해 확인하고자 하였다. H&Y 1-3의 IPD 환자를 대상으로 교감신경계 및 부교감신경계의 여러 지표들을 이용하여 비교한 결과, 부교감 신경계 지표인 VR, E:I ratio에서만 의미 있는 기능 저하가 관찰되었다.
IPD 환자의 부검 상 시상하부, 배측미주운동신경핵(dorsal motor nucleus of vagus), 청색반점(locus coeruleus), 척수의 중간외측세포기둥(intermediolateral cell column) 등 중추 자율신경계에서 루이체(Lewy body)가 발견되었다[23]. 또한, 교감 및 부교감신경절 신경원과 부신 수질에서도 루이체가 발견되었으며 연접 후의 효과기(effector)와 신경 말단에 있는 아드레날린 수용체의 과감수성 등 말초성 변화도 보고되었다[24,25]. 본 연구에서는 부교감신경계 지표만이 운동 증상이 경미한 초기 IPD 환자에서 대조군과 차이를 보였고, 이는 조직학적으로 초기 IPD의 자율신경계 침범은 부교감신경계를 담당하는 배측미주운동 신경핵의 퇴행성 변화가 다른 병변보다 두드러지게 발생할 가능성 및 파킨슨병 초기에는 교감신경계 기능 저하가 완전하지 못하여 남아 있는 교감신경섬유가 충분히 자율신경조절을 담당할 가능성[8]이 고려될 수 있다.
파킨슨병 환자에서 질병의 임상 진행 양상과 자율신경기능 지표와의 연관성 여부에 대해서는 보고되었으나[5,9], 정량적으로 운동 증상의 진행 정도와 각 자율신경기능지표와의 상관성 여부를 확인한 보고는 없다. 이에 본 연구에서는 IPD 환자에서 각 교감신경계 및 부교감신경계 지표를 이용하여 H&Y와의 상관관계 여부를 정량적으로 확인하려 하였다. 본 연구 결과로는, IPD 환자의 운동 증상이 진행할수록 E:I ratio는 유의하게 감소하였다. 이에 각 자율신경기능지표 중 환자의 운동증상의 진행 정도를 파악할 수 있는 지표는 E:I ratio로 유추할 수 있다.
본 연구는 다양한 자율신경계 기능 저하를 동반한 질환에서 사용되고 있는 교감신경계 및 부교감신경계 지표를 이용하여 비교적 운동 증상이 심하지 않은 IPD 환자의 심혈관계 자율신경기능을 확인하였고 IPD의 운동 증상의 진행 정도와 각 지표의 상관성 여부를 정량적으로 확인하였다는 점에서 그 의의가 있다. 또한 본 연구에서 사용한 발살바수기 등은 임상의사가 비침습적으로 비교적 쉽고 짧은 시간에 시행할 수 있다는 점에서 유용성이 있다.
하지만 이 논문에서도 여러 가지 제한점이 있다. 첫째, 항파킨슨약이 자율신경기능검사에 영향을 미치는 점을 고려하지 못하였다. 파킨슨병 환자에서 항파킨슨약이 자율신경계 이상을 초래한다는 이전 보고들이 있다[26,27]. 하지만 본 연구는 후향적으로 시행하여 항파킨슨약을 중단하고 자율신경기능검사를 시행 및 각 지표를 측정하는 것이 불가능하였다. 둘째, Scales for Outcomes in Parkinson's disease-Autonomic [28] 및 composite autonomic symptom scale [29]을 이용한 환자의 자율신경계 증상의 심한 정도가 이 연구에서 고려되지 않았다. 하지만 본 연구 진행 당시 간단한 문답을 시행하여 기립저혈압을 포함한 심혈관계 자율신경 증상이 없는 환자를 선별하여 연구를 진행하였다. 셋째, 반사성실신 환자를 본 연구의 대조군으로 하였으며, 이는 자율신경기능검사에 영향을 미쳤을 가능성이 있다. 하지만 반사성실신 환자 중 CASS에서 심혈관계 지표가 정상인 환자를 선별하여 자율신경 기능검사에 미치는 영향을 최소화하였다.
추후 전향적으로 많은 수의 파킨슨병 환자를 대상으로 각 자율신경기능지표와 자율신경계 증상, 그리고 임상적으로 운동 증상의 진행 정도와의 상관성을 확인하는 노력이 필요하다. 또한, 자율신경기능검사 및 지표에 영향을 주는 약물에 대한 보정이 필요하며 항파킨슨약이 각 교감신경계 및 부교감신경계 지표에 미치는 영향을 확인하고, 파킨슨병 환자의 자율신경계에 미치는 영향을 정량화하는 것이 추후 연구 과제이다.


