뢰플러심내막염과 연관된 급성 연수경색
Löffler Endocarditis Associated with Acute Lateral Medullary Infarction
Article information
뢰플러심내막염(Löffler’s endocarditis)은 말초호산구증다증과 함께 섬유성 심근염을 특징으로 하는 특발과다호산구증후군(Idiopathic hypereosinophilic syndrome)의 한 형태이다[1,2]. 이러한 뢰플러심내막염에서 혈관 내피세포에 대한 호산구의 독성과 심장내막근육의 섬유화는 혈전색전증을 유발하며 이는 뇌경색의 원인이 될 수 있다[3,4]. 저자들은 진행성 우측 눈꺼풀 마비와 어지럼을 주소로 내원한 44세 여자 환자에서 뢰플러심내막염과 동반된 급성 연수경색을 경험하여 이를 보고하고자 한다.
증 례
44세 여자 환자가 내원 4일 전부터 발생한 우안의 눈꺼풀 처 짐과 어지럼으로 병원에 왔다. 시행한 뇌자기공명영상(brain magnetic resonance imaging, brain MRI, Fig. A)에서 우측 외측 연수의 뇌경색이 관찰되어 항혈소판제 치료 중 입원 3일째 호 흡곤란이 발생하여 전원되었다.
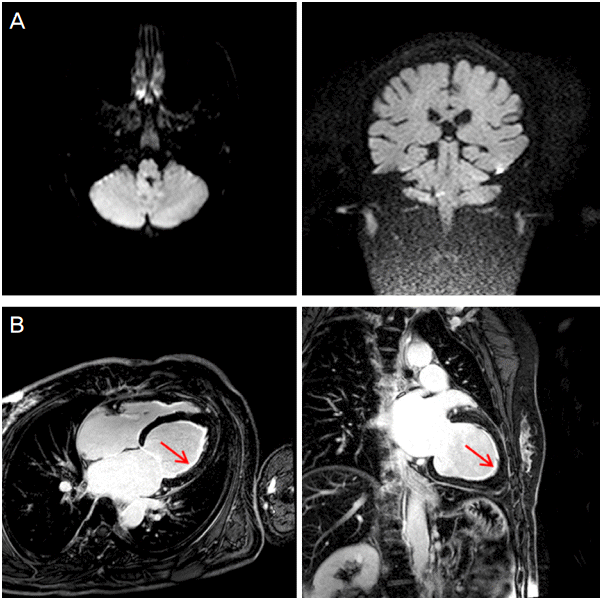
Brain and cardiac MRI of the patient. (A) Diffusion-weighted image shows high signal intensity at right lateral medulla. (B) Delayed enchancement MR image shows diffuse subendocardial enhancement of left ventricle (arrows).
과거력과 가족력에서 특이소견은 없었으며 복용약물 및 알레르기 병력도 없었다. 내원 시 신체활력징후는 혈압 130/90 mmHg, 맥박수 분당 80회, 호흡수 분당 20회, 체온 36.5℃였고, 의식은 명료하였다. 신경학적 진찰에서 우안의 눈꺼풀처짐과 우측 얼굴의 저린감, 롬버그 음성 소견이 관찰되었다. 혈액검사에서 호산구수 1530/uL, Ig E 517.3 IU/mL로 상승되었으며, 항핵항체(anti-nuclear antibody, ANA) 양성, 뇌나트륨이뇨펩티드(brain natriuretic peptide, BNP) 287.7 pg/mL로 증가되었고, 단순흉부방사선사진에서 양측의 흉막삼출액 소견이 관찰되었다. 자기공명혈관촬영(MR angiography)에서 뇌경색 관련영역의 뇌혈관 협착이나 폐색소견은 없었으며, 두개경유도플러감시(Trancranial Doppler monitoring, TCD monitoring)에서도 미세색전신호(microembolic signal)는 관찰되지 않았다. 심장초음파검사에서는 박출률(ejection fraction)은 67.5%로 정상이었으나 좌심실의 원심성 비대소견(eccentric hypertrophy)과 함께 좌심실의 첨부에 혈전으로 의심되는 덩이(mass)가 존재하였다. 이후 시행한 심장자기공명영상(cardiac magnetic resonance image, cardiac MRI)의 T2 흑혈류 단시간 타우반전회복영상(T2 black blood short tau inversion recovery image, T2 BB STIR)에서 좌심실의 지연된 조영증강소견과 함께 심내막하(subendocardium)의 선상모양의 경도의 고신호강도가 관찰되어 심내막염을 의심할 수 있었다(Fig.). 그 외 다른 장기의 침범유무를 확인하기 위해 실시한 복부컴퓨터단층촬영에서는 이상소견은 관찰되지 않았다.
환자는 호산구증가증과 함께 심내막염의 소견을 보여 뢰플러심내막염과 동반된 급성 뇌경색 진단하에 스테로이드와 항응고치료를 시행하였다. 치료 후 호산구는 감소하는 경향을 보여 입원 14일째 호산구 수는 320/uL였으며 현재 외래에서 스테로이드와 항응고요법으로 조절 중이다.
고 찰
특발과다호산구증후군이란 과다호산구증을 설명할 만한 알레르기, 기생충감염, 약물 등의 다른 원인이 없으면서 호산구수가 1500/uL 이상이고 호산구 침윤에 의한 장기손상이 있을 경우 의심할 수 있으며[1], 특히 호산구 침윤이 심장에 있을 경우, 뢰플러심내막염(Löffler’s endocarditis)이라 한다. 이러한 뢰플러심내막염은 심내막근육의 섬유화로 인한 제한성 심장근육병양상과 함께 심실내의 벽혈전(mural thrombus)이 특징이며, 임상적으로 심부전, 혈전색전증, 심방 및 심실세동을 일으킬 수 있고 특발과다호산구증후군의 주요한 사망 원인이다[2].
기존 보고에 따르면 뢰플러심내막염에서 동반되는 뇌경색은 심실 내 벽혈전에 의한 미세색전으로 인해 동맥경계영역의 다발성 병변이나 색전성 뇌경색이 주로 발생한다고 알려져 있다[3,4]. 하지만, 호산구과다증 자체에 의하여 호산구 핵안에 있는 조직인자(tissue factor)가 혈관내피와의 상호작용으로 인해 분비되고[5,6] 그와 함께 호산구에서 유래된 신경독성물질인 주요기초단백질(major basic protein)과 호산구양이온단백질(eosinophilic cationic protein)이 분비되어, 주요기초단백질은 혈관 내피세포를 손상시켜 혈전을 형성하고, 호산구양이온단백질은 과응고상태(hypercoagulable state)를 조장하여 혈관 내피세포의 혈전생성을 촉진하며 이로 인한 소동맥폐쇄에 의한 뇌경색 또한 발생할 수 있다[4,6]. 본 증례의 경우, 급성 외측연수경색은 병변의 크기와 성상, 자기공명영상촬영에서 뇌경색과 관련된 뇌혈관의 협착이나 폐쇄소견이 없는 걸로 보아 소동맥폐쇄(small artery occlusion)에 의한 뇌경색을 배제할 수 없었으며, 이는 미세색전에 의한 혈관폐쇄보다는 호산구과다증에 동반된 혈관 내피세포의 직접적인 손상에 의한 혈전생성으로 생각할 수 있다.
본 증례처럼 뢰플러심내막염에서 뇌경색 등의 합병증이 발생하는 경우, 다른 장기 침범에 의한 치명적 합병증을 예방하기 위해 호산구 수치를 떨어뜨리는 것이 중요하며[7], 기존의 뇌경색 치료와는 다르게 스테로이드와 항응고요법이 도움이 된다. 그러므로 원인에 따른 적절한 뇌경색의 치료가 필요하며, 호산구 증가의 원인에 대한 적절한 검사와 함께 치명적인 심내막 섬유화에 의한 심장침범이 발생할 수 있으므로 자세한 심장 평가가 이루어져야 할 것으로 생각한다.