2011년에 미국 국립노화연구소와 알츠하이머협회(National Institute of Ageing-Alzheimer Association, NIA-AA)가 발표한 임상 진단기준에 의하면 알츠하이머병 치매는 기억장애를 포함한 여러 영역의 인지장애와 이로 인한 일상활동장애를 보이는 원발퇴행치매로, 증상이 서서히 발생하여 지속적으로 악화되어야 하며, 치매를 유발할 만한 다른 원인이 없어야 한다[1]. NIA-AA 진단기준에서는 이런 임상 진단기준 외에, 베타아밀로이드단백질 침착과 신경퇴행의 각 범주에 대한 생물표지자를 연구 목적으로 활용하도록 권고하고 진단기준에도 포함시켰다. 최근에는 이 생물표지자들이 임상에서 처방이 가능해져 정확한 알츠하이머병 치매 진단을 위해 임상 현장에서도 많이 활용되고 있다. 특히 베타아밀로이드 단백질 침착에 대한 생물표지자는 뇌척수액 Aβ42와 아밀로이드양성자단층촬영(positron-emission tomography, PET)을 포함하는데, 실제 알츠하이머병 치매 진단에 많은 임상의들이 아밀로이드PET 결과에 의존하고 있다[2]. 그러나 아밀로이드PET에서 음성이더라도 뇌척수액 생물표지자에서는 양성인 예들(PET-/CSF+)이 치매 환자의 5%까지 이른다[3]. 저자들은 PET-/CSF+을 보인 조기발병 알츠하이머병 치매 환자 1예의 3년간 임상 경과를 보고하고자 한다.
증 례
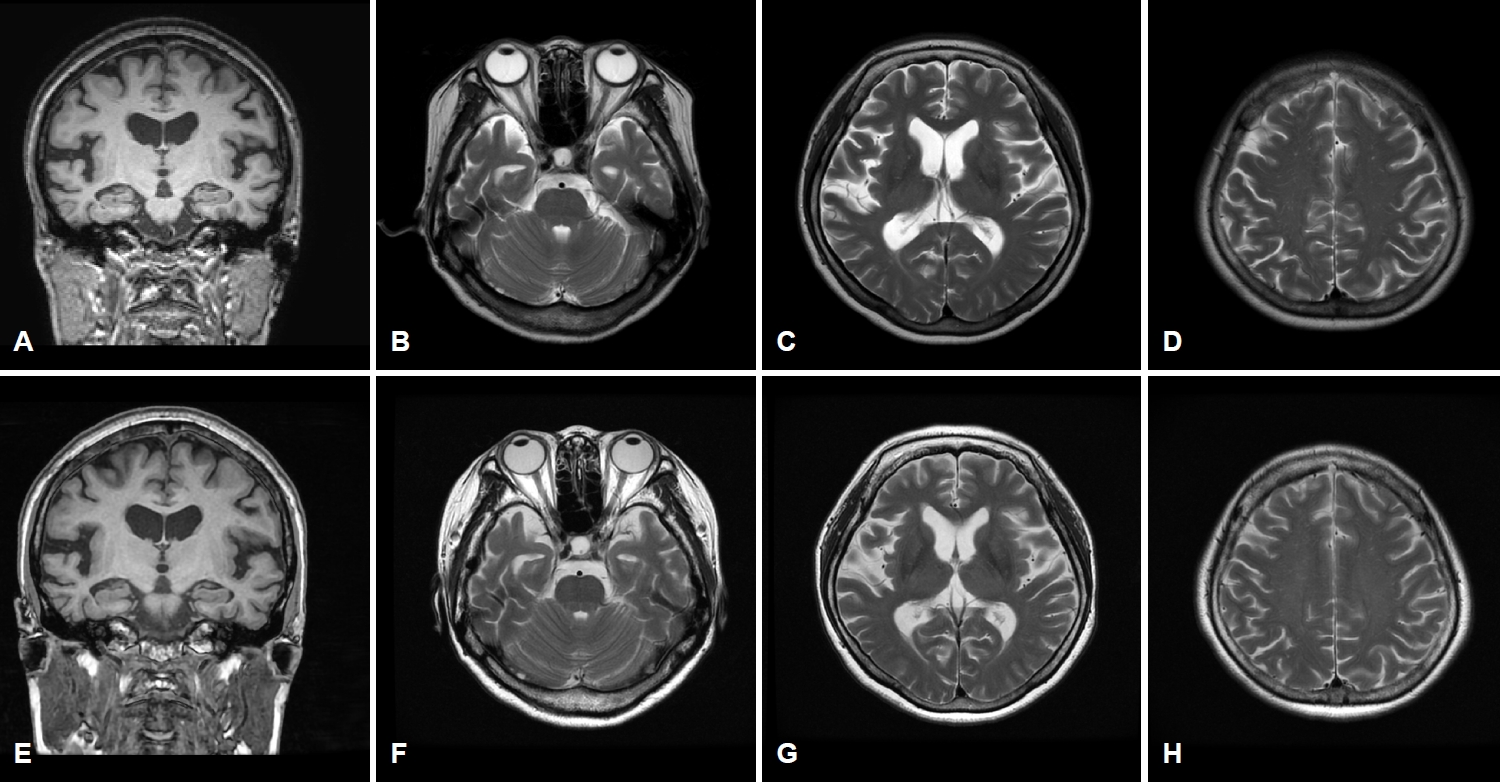
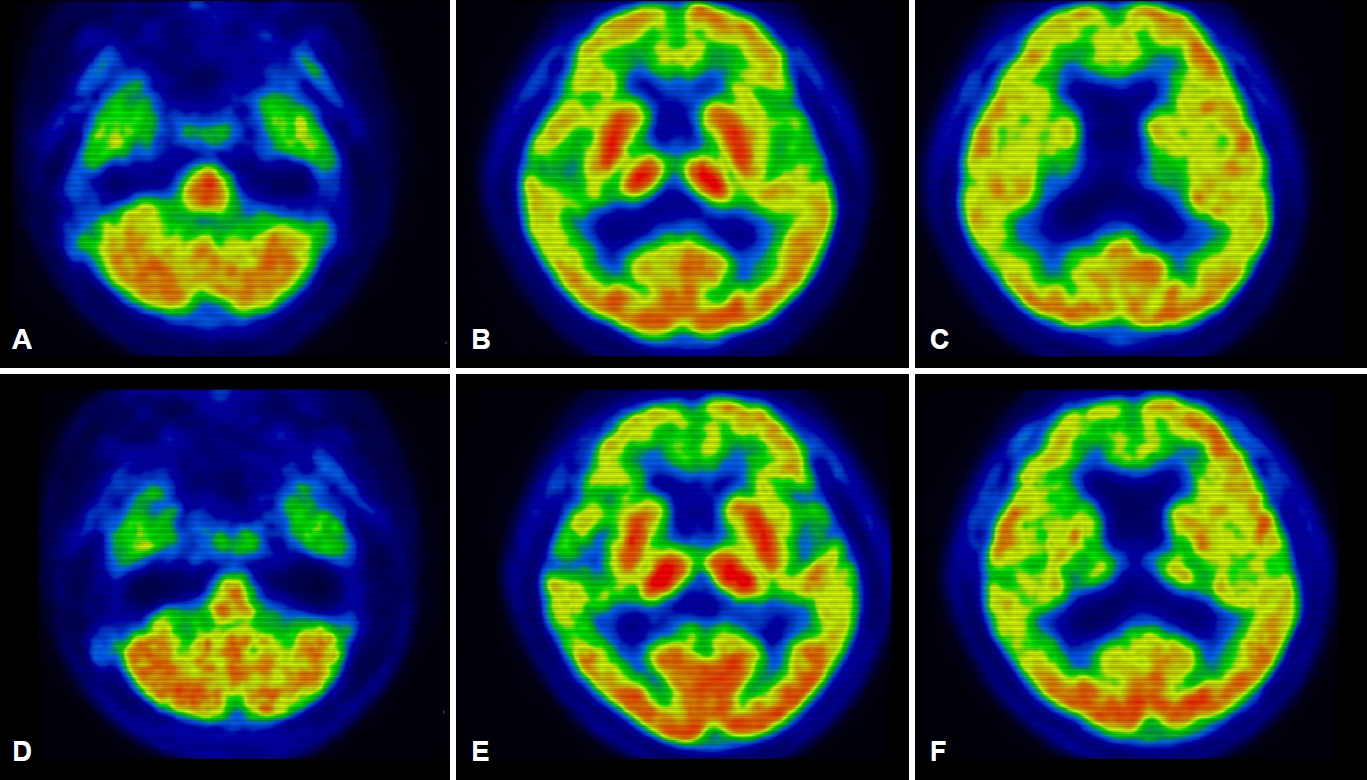
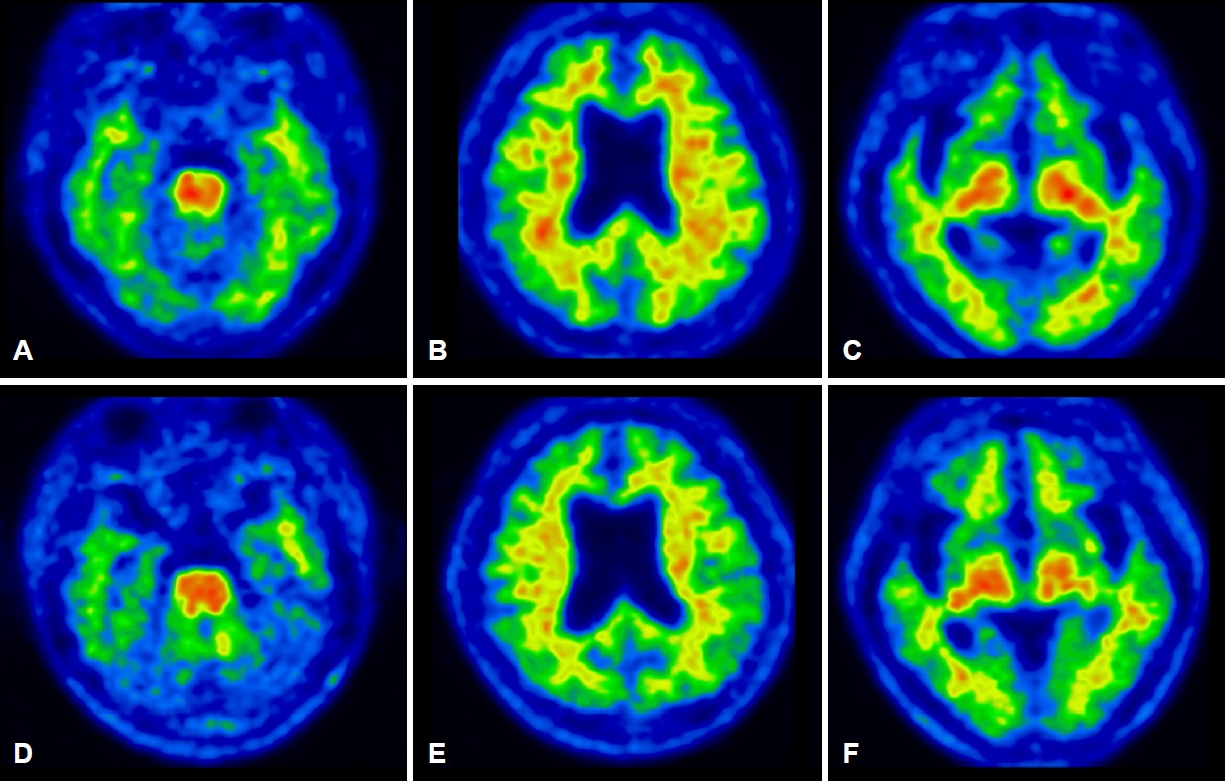
6년의 학력을 가진 오른손잡이인 61세 여자 환자가 서서히 시작된 기억력 및 언어능력저하로 지역 치매안심센터를 경유하여 2019년 6월 본원 신경과로 진료가 의뢰되었다. 한 달에 1-2번 정도 왕래하는 딸에 의하면, 환자는 약 1년 전부터 자신이 했던 일을 반복적으로 잊어버리는 경우가 많았고 물건의 위치를 기억하지 못하였다. 오래된 기억은 문제가 없었다. 그리고 대화할 때 단어를 쉽게 떠올리지 못하는 모습을 보였다. 길 찾기에는 문제가 없었고 성격 변화도 없었다. 집안 살림을 스스로 할 수 있었다. 과거병력과 치매 가족력에서 특이 소견은 없었다. 신경계진찰에서 운동, 감각 및 심부건반사는 정상이었다. 한국판간이정신상태검사(Korean-Mini Mental Status Examination, K-MMSE)는 17점, 임상치매평가척도(Clinical Dementia Rating, CDR)는 0.5점 그리고 임상 치매평가척도-총합점수(CDR-Sum of boxes, CDR-SB)는 1.5점이었다. 비문해노인특성반영 인지기능검사(Literacy Independent Cognitive Assessment)에서 나이와 학력에 비하여 기억력, 언어기능, 시공간기능, 집행기능 및 계산기능의 저하 소견이 관찰되었다. 뇌 자기공명영상(magnetic resonance imaging, MRI)에서는 전두측두엽과 해마의 위축이 관찰되었는데 우측에서 더 명확한 변화가 관찰되었다(Fig. 1-A-D). 18F-flutemetamol 아밀로이드양성자단층촬영(PET)도 시행되었다. 18F-flutemetamol 주입 10분 후에 얻은 초기 동적영상에서는 우측 전두측두두 정엽의 기능저하 소견이 관찰되었으나(Fig. 2-A-C) [4,5], 18F-flutemetamol 주입 90분 후 촬영한 지연 영상에서는 아밀로이드 침착이 보이지 않았다(Fig. 3-A-C; global standardized uptake value ratios, 1.33; cut-off value, 1.50). 뇌척수액에서 시행한 생물표지자 분석(INNOTEST ELISA kit; Fujirebio Diagnostics, Ghent, Belgium)에서 Aβ42 385 pg/mL (cut off value, 481 pg/mL), 총 타우(total tau) 524 pg/mL (cut off value, 326 pg/mL), p타우(p-tau)181 68 pg/mL (cut off value, 57 pg/mL)의 결과를 얻었다[6]. 뇌 PET검사에서 아밀로이드 축적을 보이지 않았으나, 환자의 임상 양상, 신경심리검사, 뇌 MRI, PET 초기 동적영상 및 뇌척수액생물표지자검사 결과를 종합할 때, 환자는 아밀로이드 양성, 타우 양성 및 신경변성 양성 상태의 조기발병 기억상실다중영역경도인지장애로 진단하였다. 환자는 검사 이후 1년 사이에 인지기능과 일상활동의 급격한 악화를 보였다. 환자는 전날 외식한 것을 기억하지 못하였다. 오후 3시에 남편에게 저녁을 먹으라고 차리기도 하였으며, 세탁한 것과 그렇지 않은 것을 구분하지 못하였다. 전혀 의사소통이 되지 않고 엉뚱한 행동을 하였다. 말을 할 때도 더듬거리면서 단어를 잘 말하지 못하였고 말수가 점차 줄어들었다. 집 근처에서조차도 방향을 헷갈려 하고 집안에서도 길을 헤매게 되었다. 금전 및 은행 업무는 전혀 할 수 없었다. 원래는 사교적인 성격이었으나 전혀 모임에 나가지 않았고 남편이 외출하면 불안해하였다. 반찬도 잘 못하고 하더라도 양이나 간 조절이 안되었다. 2020년 7월에 시행한 신경계진찰에서 운동, 감각 및 심부건반사는 정상이었다. K-MMSE는 13점, CDR은 2점, CDR-SB는 10점이었다. 뇌 MRI에서는 1년 전에 보이던 뇌위축이 더 진행된 소견을 보였다(Fig. 1-E-H). 18F-flutemetamol 아밀로이드 PET검사상, 초기 동적영상에서는 우측 전두엽과 양측 측두두정엽의 기능저하 소견이 관찰되었으나(Fig. 2-D-F), 지연영상에서는 여전히 아밀로이드 침착이 보이지 않았다(Fig. 3-D-F; global standardized uptake value ratios, 1.22). 환자는 이후로도 점차 악화되는 경과를 보여 2021년 4월에 시행한 검사에서는 K-MMSE 10점, CDR 2점, CDR-SB 11점을 기록하였다. 환자의 아포지단백질E (apolipoprotein E) 유전자아형은 ε4/ε4였다. 가족력은 없었지만 조기발병 치매 환자에서 비전형적인 알츠하이머치매의 생물표지자 발현을 보여 시행한 유전자검사(targeted exome sequencing; Dxome, Seongnam, Korea)에서 아밀로이드전구단백질(amyloid precursor protein, APP), 프레세닐린-1 (presenilin [PS]-1) 그리고 프레세닐린 -2 (PS-2)에는 원인 유전자변이(causative gene mutation)가 없음을 확인하였다.
고 찰
61세 여자 환자는 3년여에 걸쳐 기억장애를 포함한 여러 영역의 인지장애와 이로 인한 일상활동장애를 보였으며, 증상이 서서히 발생하여 지속해서 악화하였다. 뇌 MRI에서의 우측 전두측두엽의 뇌위축과 아밀로이드PET의 조기 동적영상에서 전두측두두정엽의 대사 저하 양상이 관찰되는 것은 감별진단으로 알츠하이머치매 외에 전두측두치매나 피질기저핵변성도 고려할 수 있다. 그러나 3년간의 임상 경과로 미루어 환자는 초기에 현저한 기억저하를 보였고, 두드러진 이상행동을 보이지 않았으며 운동질환과 관련된 신경계 이상을 보이지 않아 전두측두치매나 피질기저핵변성보다는 알츠하이머치매가 보다 적합한 임상진단명으로 생각되었다. 뇌척수액 검사에서는 Aβ42 감소, 총 타우 증가, p-tau181 증가가 관찰되어 알츠하이머병 병태생리 과정에 대한 증거가 생물표지자로 일치하는 소견이었으나 아밀로이드PET에서 음성이 관찰되었다. 환자는 PET-/CSF+ 알츠하이머치매의 가능성을 가장 높게 생각하였으나 1년 후 중기 치매 진행된 상태에서도 아밀로이드PET 결과가 여전히 음성으로 관찰되어 환자의 최종적인 진단명이 알츠하이머병인지 또는 알츠하이머병 외에 다른 병이 동반되어 있는지에 대해서는 뇌의 병리조직검사 결과가 뒷받침되어야 하는 제한점을 가진 증례이다.
2011년 NIA-AA 진단기준이나 2018년의 아밀로이드병증, 병적 타우 및 신경퇴행을 포함하는 ATN 분류체계 연구 진단기준[7]에서 제시한 아밀로이드병증을 확인하기 위한 생물표지자는 뇌척수액 Aβ42 또는 Aβ42/Aβ40 감소 혹은 아밀로이드PET 양성을 포함한다. 아밀로이드PET의 아밀로이드 축적 정도와 뇌척수액 Aβ42는 높은 수준의 음의 상관관계를 보이는 것으로 알려져 있으므로, 한국의 임상 현장에서는 두 검사 모두를 시행하기보다는 접근성이 좋은 아밀로이드PET가 주로 선택된다. 그러나 본 증례와 같이 PET-/CSF+ 알츠하이머치매 생물표지자를 가지는 예들이 치매 환자의 5%나 치매 전단계에서는 20% 정도까지 이르는 것으로 보고되었다. PET-/CSF+와 같이 생물표지자 결과의 불일치는 먼저 각 생물표지자가 반영하는 아밀로이드 단백질의 종류가 다른 것과 연관있을 수 있다. 대부분의 효소결압면역흡착층정 검사 도구(ELISA kit)가 단량체(monomer) 형태의 뇌척수액 Aβ42를 측정하는 반면, 아밀로이드PET는 뇌에 축적된 아밀로이드판을 검출하는 것이므로 뇌척수액 농도 변화가 PET보다 이른 시기에 확인될 수 있다. 그러나 본 증례의 환자는 이미 중기 치매에 이른 상태에서도 PET 음성이었고, 축적되는 아밀로이드 단백질의 차이로 PET-/CSF+ 치매를 보이는 예로 알려진 Arctic APP (APParc)변이는[8] 본 환자에서는 확인되지 않아서 본 증례에서는 축적되는 단백질의 차이에 대한 증거는 찾을 수 없었다. 환자의 상황을 설명할 수 있는 또 다른 기전으로는 환자의 낮은 뇌 탄성력(resilience)을 들 수 있다. 환자는 아밀로이드 병리가 뇌척수액에서만 관찰되는 초기 알츠하이머 병리 단계임에도 불구하고 환자의 뇌 탄성력이 낮아 심한 신경변성과 임상 악화를 보였을 수 있다. 마지막으로 당연히 뇌척수액 생물 표지자에 반영된 초기 알츠하이머 병리에 다른 병리 기전이 합병되었을 가능성도 고려해야 한다. 임상적으로 알츠하이머병으로 진단된 예들에서 흔히 부검에서 동반되는 질병인 레비소체치매, TDP-43단백병증 그리고 argyrophilic grain병을 들 수 있다[9]. 그리고 환자의 뇌 영상 소견에서 우측의 위축과 대사저하가 더 현저히 나타난 점을 미루어 피질기저핵변성이나 PGRN변이도 염두에 둘 수 있다[10]. PET-/CSF+ 알츠하이머 생물표지자를 가진 중기 치매 환자에서 결국 뇌 병리 소견 확인을 통해 이러한 가설을 검증할 수 있을 것이다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




