서 론
고혈압은 우리나라 성인 인구 3명 중 1명에서 발생하는 국민 만성질환이지만 적절히 치료하기만 하면 그로 인한 심뇌혈관 합병증 및 사망 위험을 감소시킬 수 있는 질환이다. 즉 수축기 혈압을 10 mmHg 낮추면 심근경색증을 17%, 뇌졸중은 27%, 심부전은 28%, 전체 사망률은 13%까지 줄일 수 있다는 과학적 근거가 충분하므로 고혈압 환자의 혈압을 목표치 미만으로 낮추고 유지하는 혈압 조절률을 개선하는 것이 무엇보다 중요하다[1,2]. 2017-2018년을 기해 전 세계적으로 고혈압 진단 및 치료 가이드라인이 발표되었고, 대한고혈압학회에서도 우리나라 실정에 맞는 고혈압 진단 및 치료지침을 2018년 발표하였다. 따라서 이 글에서는 2018년 대한고혈압학회의 고혈압 진료지침을 기준으로 우리나라 성인에서의 정확한 고혈압 진단 및 적절한 치료에 대하여 살펴보고자 한다.
본 론
1. 진료실에서 혈압의 측정법
혈압 측정은 청진기를 사용하여 혈압을 측정하는 청진법이 표준적인 측정 방법이다. 하지만 수은주혈압계가 2020년 이후로 생산 및 유통이 금지되어 있고 이를 대비하여 다양한 혈압계가 여러 임상연구 등을 통하여 검증되어 이용되고 있다. 따라서 수은주혈압계 및 아네로이드 혈압계, 전자혈압계 등도 모두 사용이 가능하다(http://www.dableducational.org). 하지만 심방세동과 같은 부정맥 질환에서는 이러한 전자혈압계의 정확성이 떨어지므로 청진법을 사용하는 것이 추천된다.
처음 병원에 방문하는 환자의 혈압을 측정할 때에는 양팔의 혈압을 모두 측정하며, 더 높은 혈압 측정값을 보이는 팔에서 혈압을 측정한다. 만약 양팔의 혈압 차이가 15 mmHg 이상 차이가 난다면 심혈관질환의 위험도가 증가와 관련이 있다[3].
혈압을 측정할 때에는 등받이가 있는 의자에 등을 기대어 앉도록 하고, 다리를 꼬지 말아야 하며, 위팔은 심장 높이에 위치시켜야 한다. 최소한 5분간 안정된 상태를 취한 다음에 1-2분 간격으로 2회 측정하며 만약 두 측정치가 10 mmHg 이상 차이가 난다면 재측정을 하도록 한다. 마지막에 측정한 두 번의 측정값을 평균하여 기록한다. 가정혈압은 검증된 자동혈압계를 이용하여 위에 기술한 바와 같은 방법으로 2회 측정한다. 아침 기상 후 1시간 이내, 소변을 본 후, 고혈압 약을 복용하기 전에 1회 측정하고, 저녁 잠자리에 들기 전에 1회 측정한다. 처음 진단할 때에는 적어도 외래 방문 직전 5-7일은 꼭 혈압을 측정하도록 권고한다.
2. 고혈압의 역학
2018년 발간된 Korea hypertension fact sheet에 따르면 2016년 기준 우리나라 30세 이상 성인 인구의 평균 혈압은 수축기 118 mmHg, 이완기 77 mmHg으로 지난 10년간 크게 변하지 않았지만[4], 인구 고령화의 영향으로 고혈압 유병자는 계속 증가하는 추세이다. 2016년 기준 우리나라의 고혈압 인지율은 65%, 치료율은 61%이지만 조절률은 44%로 캐나다의 2007-2013년 조사된 고혈압 인지율이 84%, 치료율 80%, 조절률 68%에 비하면 훨씬 낮은 수치로 이의 개선이 필요하다. 노년기 고혈압 환자는 인지율, 치료율, 조절률이 다른 연령대와 비교하여 비교적 높은 편이기는 하지만 인구 구조의 고령화로 인하여 노인 고혈압 환자의 수가 빠르게 증가하고 있고, 이들 대부분이 다른 만성질환을 함께 가지고 있다는 점에 대하여 유념해야 한다. 즉, 아직 관리가 잘 안되고 있는 젊은 고혈압 환자를 적극적으로 발견하여 치료를 시작하는 것과 빠르게 증가하고 있는 고령의 고혈압 환자에 대한 적절한 관리 대책을 마련하는 것이 중요하다.
4. 고혈압 환자의 약물 치료 시작과 목표 혈압
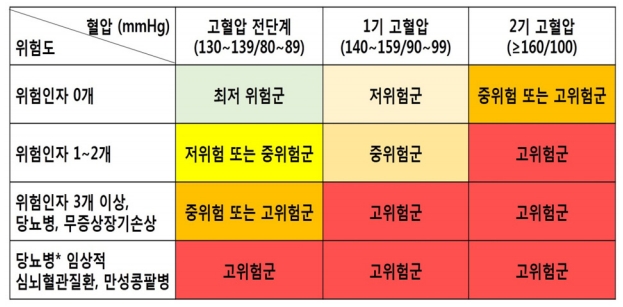
고혈압으로 진단된 환자에서 고혈압 치료의 효과는 기저혈압의 높이, 심혈관 위험도, 당뇨병, 만성 콩팥병, 연령, 성별 및 인종에 무관하다고 보고되고 있으나 대부분의 임상연구가 고위험군 환자를 대상으로 시행되었으므로 개별 위험도를 무시하고 모든 고혈압에 대하여 곧바로 약물 치료를 시작하는 것은 적절하지 않다. 따라서 심뇌혈관질환이 없는 군과 있는 환자의 치료 시작 시점은 다르다.
2) 심혈관질환이 동반되지 않은 고혈압 환자
이들 환자는 일차적으로 혈압을 낮추기 위한 임상시험에서 도출된 근거에 따라 고위험군은 140/90 mmHg 이상이면 모두 약물 치료를 시작해야 한다. 그러나 중위험군 또는 저위험군에서는 1기 고혈압일 때 약물 치료를 시작하는 것에 대한 임상근거가 다소 빈약하다. 우리나라 진료지침에서는 중국에서 시행된 The Felodipine Event Reduction (FEVER) 연구와 중위험군에서 시행된 Heart Outcomes Prevention Evaluation-3 (HOPE-3) 연구 결과를 근거로 중위험군에서는 과거와 달리 처음부터 약물 치료와 생활 요법을 동시에 시행하도록 권고하고 있다[6,8,9]. 다만 저위험군에서는 2기 고혈압일 때만 바로 약물 치료를 시작할 수 있다. 저위험군이면서 1기 고혈압 환자는 처음에 생활 요법을 먼저 시행한 후 조절되지 않을 때 약물 치료를 시작하도록 권고한다.
일차적으로 혈압을 낮추기 위한 목적으로 항고혈압약을 복용한 환자에서 목표 혈압에 관한 연구는 매우 드물다. Action to Control Cardiovascular Risk in Diabetes (ACCORD) 연구에서도 적극적인 강압 치료의 효과를 입증하지 못하였기 때문에 일반적인 고혈압 치료의 목표 혈압은 140/90 mmHg 미만이다[10]. 최근의 메타분석에서는 심혈관질환이 없는 고위험군 환자를 140/90 mmHg 이상의 혈압에서 약물 치료를 시작하였을 때 혈압을 130 mmHg 가까이 낮추는 것이 심혈관질환에 대한 예방 효과가 가장 뛰어났기 때문에 심혈관질환이 없는 고위험군에 대하여 혈압을 130/80 mmHg까지 낮추도록 권고하였다[5].
3) 심혈관질환이 동반된 고혈압 환자
항고혈압약의 종류와 임상 적용 영역을 고려해보면 대부분의 심혈관질환 환자는 혈압이 높아서가 아니라 심혈관질환 자체를 치료하기 위하여 레닌-안지오텐신계통(Renin-Angiotensin system, RAS)차단제나 베타차단제를 필수적으로 적극 처방하게 되고 일부 협심증 환자들도 증상 조절 목적으로 칼슘차단제를 복용하게 된다. 마찬가지로 단백뇨를 동반한 만성 콩팥병 환자들도 단백뇨 치료 목적으로 RAS차단제를 복용하게 된다. 따라서 이러한 환자에서는 항고혈압약의 치료 시작 시점을 논하는 것이 어렵다. 단지 목표 혈압에 비추어 추가적으로 혈압을 더 낮출 필요가 있는지 판단하는 것이 혈압 치료의 관점에서 중요하다 하겠다.
심혈관질환이 있는 환자는 대부분 해당 질환을 치료할 목적으로 항고혈압약을 복용하기 때문에 초기 상태에서 고혈압이 있었는지 명확하지 않다. 그럼에도 불구하고 혈압이 140/90 mmHg 미만으로 조절되지 않는다면 심혈관질환과 고혈압이 동반돼 있는 것으로 봐야 할 것이나, 약제 복용 중 혈압이 140/90 mmHg 미만이라면 원래 고혈압이 있었는지는 병력을 참고하지 않고서는 알 수가 없다. 심지어 RAS차단제를 복용하고 있는 심부전 연구에서 베타차단제의 효과를 본 연구에서는 기저혈압이 130 mmHg 미만인 경우도 있다. 따라서 이러한 심혈관질환 환자에 대한 추가적인 혈압 치료는 이미 필수 약제를 복용하고 있음에도 불구하고 목표 혈압에 도달하지 않는 환자를 대상으로 고려할 수 있다(Fig. 1-3).
다양한 심혈관질환을 동반한 환자에 대한 Ettehad 등[1]의 메타분석 결과에 따르면 혈압을 추가적으로 10 mmHg 낮춤에 따른 이득이 기저혈압이 120 mmHg 미만인 경우에도 관찰된다는 보고가 있었으나, 이 메타분석은 Systolic Blood Pressure Intervention Trial (SPRINT) 연구의 영향이 매우 컸고 기저혈압이 낮은 대부분의 연구가 고혈압을 목적으로 시작된 연구가 아니라 심부전 치료를 목표로 하는 연구라서 일반적인 고혈압 환자에 적용하기에는 어려움이 있다[1,11]. 다만 SPRINT 연구는 50세 이상의 관상동맥질환, 말초혈관질환, 대동맥질환, 심부전 또는 좌심실비대 환자에 대한 연구로서 진료실 자동혈압 기준으로 120 mmHg 미만, 즉 일반적인 진료실 혈압으로는 130 mmHg 정도로 혈압을 낮추는 것이 140 mmHg 정도로 혈압을 조절하는 것에 비하여 우월하다는 해석이 가능해 심혈관질환이 동반된 환자는 항고혈압약을 시작할 때의 상황과 무관하게 환자의 혈압에 따라 추가적인 강압 치료로써 혈압을 130/80 mmHg까지는 낮추도록 권고하고 있다[11]. 2018년 개정된 고혈압 진료지침 역시 고위험군과 심혈관질환 환자를 중심으로 목표 혈압을 130/80 mmHg까지 하향 조정함으로써 보다 적극적인 약물 치료를 지지하였다.
5. 고혈압의 1차 치료
고혈압 진단 초기에 2기 고혈압으로 진단받은 경우를 제외하면 고혈압의 약물 치료는 단일 치료제로 시작한다. 우리나라 고혈압 치료제의 처방 패턴 변화를 분석한 결과, 2002년에는 고혈압 치료자 중 57%가 한 가지 계열의 항고혈압약을 복용하였으나, 2016년에는 단일 치료제군이 40%로 감소하였다. 이를 토대로 40-50%의 고혈압 환자에서 단일 치료제를 투약하게 되는데, 단일 치료자 중에서는 안지오텐신수용체차단제(Angiotensin Receptor blocker, ARB)와 칼슘차단제가 각각 43%로 가장 많이 처방되는 항고혈압약이었으며, 베타차단제(7%), 이뇨제(4%), 안지오텐신전환효소(Angiotensin-Converting Enzyme, ACE)억제제(2%) 등은 빈도가 높지 않았다. 이들 약제의 전반적인 특성은 아래와 같다.
1) 베타차단제
1964년 James Black이 최초의 베타차단제인 프로프라놀롤(propranolol)을 개발한 이후 베타차단제는 1977년 미국 고혈압지침에서부터(Joint National Committee, JNC I) 고혈압 치료의 1차 약제로서 사용되어 왔다. 그러나 베타차단제는 뇌졸중 예방 효과와 좌심실비대 감소 효과가 다른 고혈압약에 비하여 열등하며, 당뇨 발생률을 증가시킨다는 여러 연구들이 발표되면서 미국 고혈압지침과 일본 고혈압지침에서는 고혈압 치료의 1차 약제로 제외되었다. 다만 유럽과 우리나라 고혈압지침에서는 1차 고혈압약으로 여전히 권고되고 있다[12-14].
베타차단제가 다른 약에 비하여 열등한 결과를 나타난 기전으로 베타차단제에 의한 심근수축력억제 및 이로 인하여 혈관 수축 증가로 만성 고혈압의 특징인 말초혈관저항을 오히려 증가시킨다는 점인데, the Conduit Artery Function Evaluation (CAFE) 연구에서 아테놀올(atenolol)의 상완동맥 혈압 감소 효과는 암로디핀(amlodipine)과 차이를 보이지 않았으나, 중심 동맥압은 오히려 증가하여, 말초혈관저항 증가가 뇌졸중 발생률 증가와 연관성이 있음을 시사하였다[15]. 또한 혈관 수축의 증가는 근육조직과 같은 말초조직의 혈류를 감소시켜서 지질대사, 당대사에 악영향을 주고 이것은 결국 내피기능 장애와 당뇨를 유발할 수 있다. 하지만 이러한 연구는 대부분 전통적 베타차단제를 대상으로 한 연구로서, 혈관 확장 작용을 가진 3세대 베타차단제는 과거 연구와 다른 효과를 나타낼 가능성이 있으며, 실제 소규모 연구에서 당뇨병 발생에 부정적 영향은 없다고 보고되고 있으나, 아직 심혈관 합병증에 대하여 직접 보고한 연구는 없다.
베타차단제가 여러 한계점은 있으나 협심증이나 심근경색증과 같은 허혈심장질환을 가진 고혈압 환자에서는 여전히 중요한 항고혈압약으로서의 역할을 하고 있다. 또한 심부전, 심방세동, 빈맥성부정맥, 60세 이하의 젊은 연령 또한 임신을 준비 중인 젊은 여성에서 권고되고 있으며, bisoprolol, metoprolol succinate, carvedilol은 좌심실부전이 있는 고혈압 환자에서 특히 유용하다[16]. Atenolol은 뇌졸중 발생의 예방 효과가 열등하므로 노인에게서 1차 약제로는 추천되지 않고 있다. 또한 혈당 이상과 지질대사 장애를 초래할 수 있어 혈당 이상, 당뇨, 대사증후군에서는 주의를 요한다.
2) 레닌-안지오텐신-알도스테론계통(renin angiotensin aldosterone system, RAAS)억제제
RAAS는 심장, 신장, 뇌 및 혈관 등 다양한 인체 조직에도 분포하며, 전신에 작용하여 전해질 및 체액량을 조절하여 항상성(homeostasis)을 유지하고 혈압을 조절한다. 안지오텐신 II는 심혈관계에 직접 작용하여 혈관 내 염증반응과 산화스트레스를 증가시켜 죽상동맥경화증을 촉진하고, 심비대 및 심부전의 발생과 밀접한 관련이 있다. 이러한 작용 때문에 RAAS억제제는 혈압 강하 이외에도 심혈관 및 다른 표적장기 보호 효과가 예상되고 실제 심근경색증, 심부전, 관상동맥질환, 당뇨병성 신증 및 만성 콩팥병 등에서 우수한 효과가 증명돼 현재 특별한 금기가 없는 한 고혈압 1차 약제로 널리 사용되고 있다[2,17].
고혈압에서 RAAS의 역할이 밝혀진 후 1970년대 말에 RAAS억제제로 처음 개발된 것이 ACE억제제인 캡토프릴(captopril)이다. 이후 1980년대부터 ACE억제제 투여 후 위약 대비 심근경색증 발생 억제, 심부전 사망 감소, 만성 콩팥병 진행 억제, 당뇨병 이환 감소 등 다양한 임상연구 결과들이 나오면서 항고혈압약의 주축이 되었다. 하지만 ACE억제제는 브라디키닌(bradykinin)의 분해를 억제하여 브라디키닌이 증가하고 혈관 부종, 기침 등의 부작용이 나타나 문제가 되었다. 이런 문제는 특히 동양인에서 빈번하게 높아서 한국에서 ACE억제제의 사용은 1995년에 Angiotensin II Type 1 Receptor (AT1R)차단제인 로살탄(losartan)이 개발된 이후 점차 감소하여, ARB가 고혈압 환자의 1차 치료제로 급부상하였다. ARB는 ACE억제제에 비하여 보다 선택적·특이적으로 AT1R에 작용하므로 브라디키닌에 의한 기침 등의 부작용이 적게 나타나고 다양한 임상 효과에서는 ACE억제제와 비슷한 연구 결과들이 보고되었다. ACE억제제나 ARB가 우선적으로 권고되는 경우는 당뇨를 동반한 고혈압 환자에서 알부민뇨가 있을 때이다. 또한 만성 콩팥병을 동반한 고혈압 환자에서 만성 콩팥병 3기 이상이나 1기, 2기 가운데 알부민뇨(≥300 mg/day 또는 알부민/크레아티닌 비 >300 mg/g)를 동반한 경우 신장질환의 진행을 낮추기 위하여 ACE억제제를 권고하였고, 이를 사용할 수 없는 경우 ARB를 권고하였다. 이런 신장 보호 효과에도 불구하고, ACE억제제 또는 ARB는 콩팥기능을 악화시켜서 혈청 크레아티닌이 상승할 수 있으므로 ACE억제제 또는 ARB를 투여하게 되면 처음 1-2개월 내에 혈액검사를 시행하여 크레아티닌이 30% 이상 상승하거나, 혈중 칼륨이 5.5 mEq/L 이상 증가하는지에 대한 모니터링이 필요하다. 특히 만성 콩팥병 환자처럼 혈청 크레아티닌이 3.0 mg/dL 이상인 경우 ACE억제제 또는 ARB 투여 후 고칼륨혈증의 발생에 주의해야 한다. ACE억제제 또는 ARB는 태아에 기형을 초래하는 것으로 알려져 있어서 임신부에게는 금기이며, 임신이 예정되어 있거나 가임부에서는 투약 시 주의해야 한다[13,14].
3) 칼슘차단제
60년간의 긴 역사를 가진 칼슘차단제는 2016년 이전까지는 국내에서 가장 많이 처방되는 항고혈압약이었고 현재도 1-2위를 다툴 정도로 사랑받고 있다. 심근세포, 평활근세포 혹은 신경세료에서 흥분수축(excitement contraction)을 담당하는 전압작동(voltagegated) 칼슘통로를 차단하여 혈관 수축을 조절함으로써 혈압을 떨어뜨린다. 칼슘차단제는 크게 dihydropyridine (DHP) 계열과 phenylalkylamine과 benzothiazepine을 포함하는 non-DHP 계열로 나뉜다. 최초로 칼슘차단제가 개발된 것은 1960년대 말로 non-DHP칼슘차단제인 베라파밀(verapamil)과 딜티아젬(diltiazem)에서 처음 혈관 확장과 음성수축촉진효과(negative inotropic effect)가 확인된 바 있다. 이후 최초로 개발된 DHP칼슘차단제는 짧은 작용 시간을 가진 니페디핀(nifedipine)인데, 니페디핀과 니카르디핀(nicardipine) 같은 1세대 칼슘차단제는 작용이 빠르지만 짧은 반감기를 가지고 있어, 빠른 혈압 강하 후 이로 인한 1차적인 압력반사(baroreflex), 레닌 방출 및 안지오텐신II에 따른 반사적인 교감신경 활성화 및 반사성빈맥(reflex tachycardia)이 두드러져 혈압 강하 효과가 상쇄되고 특히 관상동맥질환이 있는 환자들에서는 사용이 크게 제한되었다. 그래서 2세대 DHP칼슘차단제는 이러한 부작용들을 대폭 개선한 서방형 니페디핀으로 1970년대에 출시되었고 현재까지도 사용되고 있다. 3세대 DHP칼슘차단제들은 1980년대에 개발되었고 암로디핀(amlodipine)이 대표적이다. 이전 약제들에 비하여 더 지방친화성(lipophilic)으로 안정적인 약동학적 성질을 보이고 임상 결과도 더 우수하여 현재까지 널리 사용되고 있다. 가장 높은 지방친화성을 가지는 DHP칼슘차단제는 4세대인데, 1세대부터 1990년대 중반에 개발된 4세대에 이르기까지 지속적으로 작용 시간이 길고 안정적으로 주로 혈관에만 작용할 수 있는 DHP칼슘차단제들이 개발되어 왔다. 칼슘차단제는 혈압 강하 이후에 반사적인 교감신경활성화나 빈맥, 혈관 확장에 따른 다리 부종이 있을 수 있으므로 이를 잘 모니터링하는 것이 필요하다[12,14].
4) 이뇨제
이뇨제 계열의 고혈압약은 오래 전부터 사용된 1차 선택 항고혈압약이다. 주로 사용되는 약제로는 티아지드형(thiazide-type, hydrochlorothiazide계)과 유사티아지드(thiazide-like)형인 chlorthalidone과 indapamide가 있다. 이뇨제 계열 고혈압약의 초기 강압효과는 이뇨 작용에 의한 혈장량 감소와 이에 따른 심박출량 감소에 의하여 나타난다. 약제 반응군에서는 대개 1주일 이내에 혈압이 떨어지기 시작하여 최대 12주까지 서서히 혈압이 감소하게 된다. 이뇨제 투여에 이뇨 작용이 미미하거나 고염 식이를 하는 환자에서 혈압 강하가 미미할 수 있고, 이뇨가 충분히 이루어진 경우에도 급격한 혈장량의 저하에 따른 RAS의 활성화로 혈압 저하가 둔화될 수 있다. 장기간 투여하면 초기 감소되었던 혈장량 및 심박출량이 다시 거의 원상태로 돌아오는 것으로 알려져 있는데 이런 현상에도 불구하고 강압 효과가 지속되는 것은 혈관이 확장하고 저항이 감소하는 것에 기인하는 것으로 추정된다. 장기 투여 시 혈관 확장이 일어나는 현상은 작용 시간이 긴 유사티아지느형약에서 더 현저하다. 장기간의 이뇨제계 혈압약 투여가 내인디기탈리스유사나트륨이뇨호르몬(endogenous digitalis-like natriuretic hormone)을 감소시키고 이를 통하여 세포 Na-K ATPase 펌프의 활성도가 증가하고, 이는 세포 내 Na 농도를 감소시키는데, 이에 따라 Ca의 배출이 증가되고 세포 내 Ca 농도가 낮아져서 혈관 확장이 나타나는 것이 기전으로 추정된다[13,14].
우리나라에서 가장 널리 쓰이는 이뇨제계 항고혈압약은 티아지드형이다. 시판되는 가장 적은 용량이 1정 25 mg으로 대개 항고혈압약으로는 1/2정에 해당하는 12.5 mg을 기본 용량으로 사용하며 필요하다면 25 mg으로 증량하여 사용한다. 서구의 경우 50 mg까지 사용하기도 하지만 25 mg를 초과하여 투여하는 경우 강압 효과에 비하여 대사성 부작용이 발생할 가능성이 커서 주의를 요한다. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) 연구 결과 등을 기반으로 1차 고혈압 약제로 널리 쓰이고 있으며, 특히 ARB의 고정용량복합제(fixed dose combination)로 많이 쓰이고 있다[20]. 하지만 Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT), Avoiding Cardiovascular Events Through Combination Therapy in Patients Living With Systolic Hypertension (ACCOMPLISH) 등 대규모 전향 연구에서 칼슘차단제나 ACE억제제에 비하여 열등한 결과가 나타난 바가 있다[21,22]. 유사티아지드형약제는 chlorthalidone과 indapamide가 대표적이다. 티아지드형에 비하여 작용 시간이 길고 장기 사용 시 혈관 확장효과도 크다. 항고혈압약으로는 저용량이 주로 사용되며 chlorthalidone의 경우 하루 12.5-25 mg, indapamide의 경우 1.25-2.5mg이 사용된다. 보통 강압 효과가 티아지드형에 비하여 1.5-2배 정도 강하다고 알려져 있다. 따라서 일반적으로 티아지드형의 이뇨제를 써서 혈압이 조절되지 않을 때 chlorthalidone과 indapamide와 같은 약제로 변경하면 더 큰 강압 효과를 얻을 수 있다[23].
이뇨제는 저칼륨혈증, 저나트륨혈증, 고요산증, 혈당 증가, 고지혈증, 저마그네슘혈증, 고칼슘혈증 등 다양한 대사성 부작용을 유발할 수 있지만[24], 이러한 부작용은 대개 용량에 비례하여 나타나기 때문에 주로 혈압 강압 목적으로 쓰이는 저용량(hydrochlorthiazide/chlorthalidone 12.5-25 mg, indapamide 1.25 mg)에서는 그 발생 빈도가 비교적 낮다. 만성 콩팥병이 있는 환자, 특히 glomerular filtration rate (GFR) <30 mL/min/1.73 m2인 경우 티아지드의 효과가 제한적이므로 혈장량의 저류가 혈압 상승의 중요한 기전이 되는 환자에서는 고리작용이뇨제(loop diuretics)가 혈압 조절을 위하여 효과적으로 쓰일 수 있다[13,14]. 하지만 소규모 연구에서 3, 4단계의 만성 콩팥병에서도 티아지드형 항고혈압약이 효과적이라는 보고가 있다.
6. 고혈압 치료 약제의 복합 요법
복합 요법은 어떻게 시작하는 것이 좋을까? 한 가지의 항고혈압약으로 목표 혈압 이하로 조절되지 않거나, 고혈압 진단 초기에 2기 고혈압으로 진단받은 경우 2제 이상의 적절한 복합 요법을 생각해야 한다(Fig. 4). 우리나라 항고혈압약의 처방 패턴 변화를 분석한 결과, 단일 치료제 군은 2002년 57%에서 2016년 40%로 감소하였고 42%가 두 가지, 18%는 세 가지 계열 이상의 항고혈압약을 사용하고 있었다[4]. 이는 보다 강력한 혈압 조절의 임상적 이득이 많은 연구를 통하여 입증되면서 개정되는 고혈압 진료지침들이 더 적극적인 혈압 조절을 권고하고, 복합 요법의 필요성을 강조하기 때문으로 생각된다. 2018년도에 개정된 유럽 가이드라인에서도 초기 치료로 복합 요법을 강력히 권유하고 있다[14]. 과거 가이드라인에서도 고위험 고혈압 환자에서 초기부터 병합 치료로 시작할 수 있음이 권유되었지만, 이번 가이드라인에서는 저위험군의 1기 고혈압 환자는 80세 이상의 고령자에서만 초기 단일제로 치료를 시작하고 나머지 모든 고혈압 환자에서 RAAS차단제에 칼슘차단제 혹은 이뇨제가 결합된 단일 복합제로 치료를 시작하기를 권유하였다. 이론적으로는 단일 약제로 시작하여 효과를 평가하고 추가 강압이 필요한 경우 약제를 추가하는 것이 타당한 것 같지만, 초기 복합제 사용군이 단계적 증량군보다 장기적으로 혈압 조절률이 더 높았다는 임상연구와 일반적으로 50% 이상의 고혈압 환자가 140 mmHg 이하라는 통상적인 치료 목표에 도달하지 못한다는 점 등이 그 이유이다. 예컨대, 단일 약제로 시작한 환자에서 혈압이 143 mmHg에서 더 이상 낮아지지 않아도 140 mmHg 이하로 조절되도록 두 번째 약제가 추가되는 경우가 적기 때문이다. 초기 복합 요법의 장점인 더 나은 치료 목표 혈압을 달성하고, 50%가 넘는 환자에서 충분한 강압 효과를 얻기 위해서는 두 가지 이상의 고혈압약을 병용해야 한다는 사실을 상기하면 충분히 공감이 된다. 복합요법이 아니고 처음에 단일 요법으로 시작한 경우 단일 요법으로 가장 많이 사용되는 칼슘차단제나 ARB를 복용하다가 복합 요법이 필요하다고 판단되면 DHP칼슘차단제와 ARB 혹은 이뇨제의 복합 요법이 추천된다. DHP칼슘차단제 자체의 나트륨이뇨효과(natriuretic effect)에 의한 음성나트륨평형(negative sodium balance)이 ACE억제제 또는 ARB의 추가적인 항고혈압 효과를 증진시킨다고 알려져 있다. 또한, DHP칼슘차단제에 의한 반사적인 교감신경항진이 ACE억제제나 ARB에 의하여 저하되어 상호간의 상보적인 작용이 두드러진다. DHP칼슘차단제와 ACE억제제나 ARB의 병합 요법은 항고혈압 작용뿐만 아니라 심혈관질환 결과(outcome)에도 영향을 미쳐서 메타분석에서 심혈관질환 위험성을 유의하게 떨어뜨리는 것으로 밝혀져 있다. 다만 국내에는 DHP칼슘차단제와 ACE억제제의 병합 요법은 거의 사용되지 않으며, DHP칼슘차단제와 ARB 병합 요법이 상업적으로 더 널리 사용되고 있다. 특히 국내에서는 두 개 이상의 항고혈압약이 필요한 환자에서 DHP칼슘차단제와 ARB의 병합 요법이 항고혈압 복합제에서 가장 많이 사용되고 있는데, 국내 고혈압 치료제의 처방 패턴 분석에서 2계열 복합 요법 중에서는 ARB+칼슘차단제 병합 요법(54%)과 ARB+이뇨제 병합 요법(27%)의 빈도가 높은 것은 이를 입증한다고 하겠다[3]. 다만 ACE억제제/ARB는 심부전, 심근경색증 후 환자 및 일부 부정맥에서 베타차단제와 병용하는 경우가 있을 수 있다. 2계열 복합 요법으로 목표 혈압 이하로 조절되지 않은 경우 3계열 복합 요법을 고려해야 한다. 가장 많이 사용되는 3계열 복합요법은 국내에 ARB, 이뇨제, 칼슘차단제이다. 2계열 이상의 약제가 한 알에 함께 들어 있는 고정용량복합제(fixed-dose combination or single pill combination)는 투약 시 환자의 순응도를 개선하고 조절률을 향상시킬 수 있다. 현재 국내에서 고정용량복합제 사용이 급격히 늘어나면서 ARB+칼슘차단제, ARB+이뇨제, ARB+칼슘차단제+이뇨제와 같은 2계열 혹은 3계열 복합제를 국내에서 처방할 수 있다. 이들 복합 요법의 비중은 앞으로도 계속 증가할 것으로 예상된다. 2제, 3제 복합 요법을 고려할 때 혈압약 변경 후 2-3일 이내에 혈압이 다 조절되는 것은 아니므로 너무 자주 혈압약을 변경하지 말고 2-4주 간격으로 약제를 조절하는 것이 필요하다. ARB의 강압 효과는 동일한 용량이라고 하더라도 4주보다 8주에 혈압이 더 떨어진다고 입증된 연구 결과가 많다[13,14].
항고혈압약을 복합 요법으로 변경하거나 용량을 올렸음에도 불구하고 진료실에서 측정한 혈압이 지속적으로 높고 혈압 변동 폭이 커진다면 백의고혈압을 한번쯤 의심해봐야 한다. ‘백의고혈압’은 진료실 혈압이 140/90 mmHg 이상이고 가정혈압 또는 주간활동혈압이 135/85 mmHg 미만인 경우로, 대한고혈압학회의 활동혈압 모니터등록사업 자료에 따르면 고혈압 약물 치료 중에 진료실 혈압이 높으나 주간활동혈압이 정상인 환자의 비율은 전체 치료 환자의 13.5%였고, 진료실 혈압을 기준으로 조절되지 않는 고혈압 환자의 21.3%로 상당히 높다. 고혈압 진단에 있어서 백의고혈압이나 고혈압 치료 중 백의효과는 여성과 노인에서 더 자주 관찰되는데, 정확하게 진단하지 않으면 불필요한 약물 치료로 인한 부작용을 유발할 수 있으므로 진료실 자동혈압, 가정혈압 또는 활동혈압을 측정하여 약물 치료 시작 전에 가급적 배제하는 것을 권장한다. 따라서 가능한 모든 고혈압 환자에게 생활 요법을 권하고 주기적으로 가정혈압 측정을 권고하는 것이 필요하다. ARB와 칼슘차단제, 이뇨제 등 3가지 이상의 약제를 사용해도 조절이 되지 않는 소위 ‘저항성고혈압’의 경우 백의고혈압을 배제하기 위하여 혈압 측정이 제대로 된 것인지, 약을 제대로 복용하고 있는지, 2차 고혈압의 가능성은 없는지를 확인해보고 필요하다면 알도스테론 길항제인 스피로노락톤을 추가하여 혈압 조절을 시도해볼 수 있다. 다만, ARB와 알도스테론 길항제를 함께 복용하는 경우에 크레아티닌 상승과 고칼륨혈증의 위험이 증가하므로 혈액검사를 반드시 추적해야 한다. 한편 ACE억제제와 ARB를 함께 투여할 수도 있으나 고칼륨혈증의 위험과 말기 콩팥질환, 뇌졸중 등의 심뇌혈관질환 발생이 오히려 증가하므로 병용을 피해야 한다[13,14].
7. 노인 고혈압의 치료
고혈압은 노인에서 가장 흔한 만성질환 중 하나이며 심뇌혈관질환의 주요 위험인자이나, 초고령, 노쇠 환자를 포함한 모든 노인 고혈압 환자에서 항고혈압약을 사용하여 혈압을 낮추면 합병증의 발생을 효과적으로 줄일 수 있어 예후를 개선시킬 수 있다. 하지만 노인 고혈압 환자 관리에 있어 문제점은 이들의 치료율은 높지만, 치료 조절률이 낮다는 점이다. 따라서 보다 적극적인 혈압 조절과 동반된 위험인자의 관리를 통하여 심뇌혈관 합병증 발생을 줄일 수 있도록 노력해야 하겠다. 노인 고혈압의 특징은 주로 수축기 혈압만 상승되는 단독수축기고혈압으로 나이가 들수록 비중이 크다. 이전 연구 및 약제 작용기전을 볼 때 이러한 경우 칼슘차단제와 함께 이뇨제 계열 고혈압약이 1차 선택 약제로 추천되기도 한다. 하지만 노인의 경우 이뇨제 고혈압약으로 인한 대사성 부작용의 발생률이 높기 때문에 이에 대하여 더 세심한 주의 및 모니터링이 필요하다.
2017년 미국심장학회·심장협회(American College of Cardiology/American Heart Association, ACC/AHA) 고혈압 진료지침에서 지역사회에 거주하는 65세 이상 노인 환자는 수축기 혈압을 130 mmHg 미만으로 조절할 것을 추천하였다[13]. 이렇게 강력한 권고안이 나온 근거는 노인 환자의 대다수가 심뇌혈관질환의 발생 위험이 높은 고위험군이고, 미국의 국민건강영양조사(National Health and Nutrition Examination Survey, NHANES)에 따르면 65세 이상 노인의 88%가 10년 죽경화성심혈관질환(atherosclerotic cardiovascular disease, ASCVD) 위험도가 10% 이상이거나 심뇌혈관질환을 동반하고 있고, 75세 이상 노인의 경우 100%에서 ASCVD 위험도 10% 이상 또는 심뇌혈관질환을 동반하고 있기 때문이다. 또한 SPRINT 연구의 75세 이상 하위 분석에서 노쇠한 노인을 포함한 모든 노인 환자에서 보다 강력한 강압이 보다 효과적인 것으로 나타남으로써 노인 환자에서 다른 목표 혈압을 제시할 이유가 없게 되었다[25]. 따라서 고위험군에서 보다 강력한 강압을 강조한 이번 진료지침에서 모든 노인 환자의 목표 혈압을 수축기 혈압 130 mmHg 미만으로 제시한 것은 논리적으로 당연한 결과이다.
하지만 같은 노인 환자라고 하더라도 서구와 다른 연구 결과가 일본에서 발표되었다. JATOS 연구에 의하면 강력한 강압군에서 유의한 이득이 없으며, 오히려 75세 이상에서 뇌혈관질환이 증가하는 경향이 관찰되었다[26]. 더구나 노인에서는 백의효과 및 기립저혈압, 식후저혈압 등이 보다 흔하기 때문에 수축기 혈압 130 mmHg 미만의 강력한 강압이 임상시험 환경이 아닌 실제 진료 환경에서도 안전한지에 대한 문제가 제기되고 있다.
한편 2018년 발표된 대한고혈압학회와 유럽고혈압학회·심장학회 진료지침에서는 65세 이상에서 수축기 혈압이 140 mmHg 이상이면 약물 치료를 시작하고, 목표 혈압은 140 mmHg 미만(유럽의 경우 130-139 mmHg)을 유지하는 것으로 하였는데, 이전에 비하여 목표 혈압 수치가 낮아진 것은 최근의 임상시험 결과 및 노인 환자의 심혈관질환 위험도를 고려한 변화다[14]. 이러한 권고안은 노인 환자에서도 적극적인 혈압 관리가 필요함을 입증하지만 앞서 언급하였듯이 노인 환자의 경우 같은 연령이라도 환자의 건강 수준에는 차이가 있기 때문에 환자 상태에 따른 맞춤형 치료가 필요하겠다. 강력한 강압을 일률적으로 제시한다기보다 노인 환자의 특징인 동반질환이 많거나 기대 여명이 길지 않은 경우를 고려하고, 기립저혈압, 낙상, 보행속도 저하, 노쇠, 전해질 불균형 등 보다 강력한 강압으로 인하여 초래될 수 있는 부작용의 발생 위험을 잘 모니터링 하는 것이 필요하다.
8. 당뇨병 환자의 고혈압 치료
당뇨병 환자에서 고혈압의 발생은 일반 인구 집단에 비하여 2배 이상 높다고 알려져 있으며, 고혈압 환자도 당뇨병 발생이 약 2배 증가한다고 알려져 왔다. 어느 것이 먼저 있었든 고혈압과 당뇨병이 같이 있는 경우 단독으로 있는 경우보다 뇌졸중을 비롯한 심뇌혈관질환과 콩팥질환 발생 및 진행을 가속화하므로 매우 위험하다. 예전부터 당뇨병 자체는 심뇌혈관질환의 상당히 중요한 위험인자로 고려되었기 때문에 다른 일반 고혈압 환자에 비하여 130/80 mmHg로 더 낮은 치료 목표 혈압을 권고하였는데, 당뇨병이 있는 환자의 혈압을 더 낮게 유지하였을 때 심뇌혈관 사건의 발생을 줄인다는 근거가 부족함에 따라서 비용과 부작용을 고려하여 같은 당뇨병을 가졌더라도 동반질환에 따라 치료 목표 혈압이 달라지는 변화가 있었고, 이는 최근 발표된 대한고혈압학회 진료지침을 통해서도 알 수 있다.
최근 대한고혈압학회를 비롯한 진료지침은 당뇨병을 동반한 고혈압 환자의 치료 목표 혈압은 140/85 mmHg 미만으로 권고한다. 이전 진료지침에서는 단순 고혈압에 비하여 목표 혈압을 130/80 또는 140/80 mmHg 미만으로 더 낮게 유지하도록 권고하였지만, 혈압을 더 낮게 유지한 환자에서 심뇌혈관 사건의 발생을 효과적으로 줄이지 못하였으며, 오히려 더 많은 약제의 사용으로 인한 비용과 부작용 발생을 고려하여 최근 치료 목표 혈압이 140/85 mmHg 미만으로 권고되고 있다. 다만, SPRINT 연구 대상의 고위험군 당뇨병 환자의 연구 결과와 ACCORD 연구의 뇌졸중 예방에 대한 효과를 고려할 때 심혈관질환이 동반된 당뇨병 환자는 예전과 같이 130/80 mmHg 미만으로 혈압을 조절하는 것이 심뇌혈관계 보호에 효과적일 수 있다. 따라서 당뇨병을 동반한 고혈압 환자의 치료 목표 혈압은 고위험군이면 130/80 mmHg 이하로, 그렇지 않은 저위험군의 경우 140/85 mmHg 이하로 조절하면 된다. 저위험군이라고 하여 무조건 130-140 mmHg를 유지하는 것은 아니며, 고혈압약의 개수가 많지 않고 큰 부작용이 없다면 고위험군과 마찬가지로 수축기 혈압을 130 mmHg 이하로 조절하는 것도 바람직하다.
당뇨병을 동반한 고혈압 환자의 약제 선택은 1차 약제로 ACE 억제제, ARB가 선호되는데 여러 가지 동반질환을 고려하여 고혈압약을 선택할 수 있다. 특히 미세단백뇨나 단백뇨를 동반한 환자의 경우 콩팥 보호 효과가 있는 ACE억제제와 ARB를 우선적으로 투약한다. 치료 목표 혈압에 도달하기 위하여 최근 강조되고 있는 복합 요법을 활용하는 것이 반드시 필요하다. 당뇨병을 동반한 고혈압 병용 치료에서 신중을 기해야 하는 조합은 베타차단제와 thiazide이뇨제의 병용으로 이는 인슐린 저항을 증가시켜 당뇨병 조절을 악화시킬 수 있으므로 주의가 필요하고, ACE억제제와 ARB 복합 요법은 콩팥기능 손상과 전해질 이상 등이 우려되므로 금기된다[13,14].
9. 뇌졸중 환자의 고혈압 치료(이차 예방)
뇌졸중(stroke)은 주요 심혈관 사건 중 하나이며 뇌졸중 이후의 이차 예방을 위한 고혈압 치료는 사망률과 뇌졸중 및 혈관질환의 재발을 유의하게 감소시킨다. 몇몇 대규모 임상 연구들에서 혈압이 140/90 mmHg 이상이고 과거 뇌줄중이나 일과성허혈발작(transient ischemic attack)이 있었던 환자에서 항고혈압약의 사용은 약제를 사용하지 않은 대조군(placebo controlled)에 비하여 뇌졸중의 재발을 낮추었다고 보고하였다[27-29]. 또한 고혈압의 과거력 유무에 상관없이 뇌졸중 이후의 고혈압 치료는 사망률과 합병증을 감소시킨다. 고혈압 과거력이 없는 환자가 뇌졸중 또는 일과성허혈발작이 발생하고 수일 경과 후에도 혈압이 140/90 mmHg 이상으로 지속되면 이차 예방 목적으로 항고혈압약을 투약해야 한다. 비슷하게 기존의 고혈압 환자가 뇌졸중 또는 일과성허혈발작이 발생하면 허혈뇌졸증의 경우 수일 경과 후, 일과성허혈발작의 경우 즉시 이차 예방 목적으로 항고혈압약을 다시 투약해야 한다. 항고혈압약의 선택은 환자의 상태(두개강외 폐색성 뇌혈관질환, 콩팥질환, 심장질환, 당뇨병)를 고려하여 개별화한다. 열공뇌경색(Lacunar stroke) 환자에서는 The Secondary Prevention of Small Subcortical Strokes (SPS3) 연구의 결과를 근거로 수축기 혈압을 120-130 mmHg으로 낮추는 것을 권고한다[28]. 경동맥죽경화증은 죽종의 색전으로 인한 뇌졸중(atheroembolic stroke) 및 심뇌혈관질환의 고위험인자이다. 일부 연구에서 혈압을 낮추는 것이 질환의 진행을 낮출 수 있음이 보고되어 있으며 칼슘차단제와 ACE억제제가 추천된다[30,31]. 중증의 양측 경동맥협착이 있는 경우 적절한 항고혈압약 사용에 대한 임상 연구는 보고된 바 없으나 일반적으로 혈압을 너무 낮추는 경우 뇌경색의 위험이 증가하여 항고혈압약의 선택 시 단일제로 시작하는 것을 권고한다.
뇌졸중의 예방을 위하여 여러 항고혈압약을 사용하였을 때 얻는 이득은 많은 대규모 임상 연구에서 입증되었으나 앞서 기술한 바와 같이 베타차단제는 다른 계열의 고혈압약에 비하여 효과적이지 못한 것으로 보고되어 있다. 이러한 연구에서 사용된 베타차단제는 atenolol이며 최근 개발되어 사용되고 있는 베타차단제들도 여전히 충분한 근거가 부족한 실정이다. 고혈압 약은 The perindopril protection against recurrent stroke (PROGRESS) 연구 결과에 의하여 RAS억제제와 이뇨제(thiazide-like diuretic)의 병용 요법을 추천하며, 메타분석 결과를 통하여 칼슘차단제의 사용을 추천한다[1,27].
10. 인지기능 장애가 있는 환자의 고혈압 치료
중년기에 발생하는 고혈압은 노년기 알츠하이머치매(Alzhemier’s dimentia) 및 혈관치매(vascular dementia) 발생에 중요한 원인이다. 조절되지 않은 고혈압은 뇌혈류의 저하와 관련이 있으며 대뇌 소혈관 질환과 백질고신호병변(white matter high signal intensities)의 주요 위험인자이고 이들은 대뇌 신경회로를 손상시킴으로써 인지기능장애를 초래할 수 있다[32,33]. 이와 관련된 연구들을 살펴보면 한 연구에서 160 mmHg 이상의 수축기 혈압을 가진 환자들에서 혈압을 조절하였을 때 뇌백질병변(white matter lesion)의 진행 및 인지기능 저하를 늦추었다고 보고하였다[34]. 또한 메타분석을 통하여 혈압 조절이 인지기능 장애 및 치매의 위험을 9% 정도 감소시켰다고 보고한 바 있다[35]. 대부분의 관찰 연구에서 수축기 혈압이 잘 조절되면 알츠하이머치매 및 기타 치매가 적게 발생하였고, 60대 이후에 치료를 받은 환자보다 50대부터 치료를 받기 시작한 환자군에서 치매 예방 효과가 더 큰 것으로 보고하였다[32]. 고혈압 치료가 치매 발생에 미치는 효과를 관찰한 무작위 배정 임상 연구들에서 인지기능 장애 및 치매 발생에 대하여 고혈압 치료가 부정적 영향은 없었으나 효과 면에서 일관된 결과를 보이지는 못하였다[36-39]. 하지만 전체적인 임상 연구 결과들을 고려할 때 고혈압의 조절은 인지기능 장애에 긍정적인 효과가 있다고 볼 수 있겠다.
11. 고혈압 환자에서 기립저혈압에 대한 고려
기립저혈압은 서있는 자세에서 1분 및 3분에 혈압을 측정하였을 때 수축기 혈압이 20 mmHg 이상 혹은 이완기 혈압이 10 mmHg 이상 차이가 나면 진단할 수 있다. 특히 노인 고혈압 환자나 당뇨를 동반한 경우에서 많이 나타난다. 기립저혈압은 사망률 및 심혈관질환에 의한 사망, 관상동맥질환의 증가와 관련이 있는 것으로 알려져 있으나 여러 연구에서 일관된 결과를 보이지는 않는다[36-38]. 이는 연구 방법론(기립저혈압 측정 방법) 차이 및 환자군의 차이 등에 따른 것으로 보인다. 한 연구에서는 기립저혈압이 야간혈압이 주간혈압보다 월등히 높은 revere dipper 환자에서 많이 관찰됨을 보고하였다[40]. 일관된 결과를 보이고 있지는 않지만 고혈압 환자에서 발생하는 기립저혈압은 심혈관질환 발생의 예측인자로서 고려될 수 있어 24시간 활동혈압검사 및 무증상 장기 손상에 대한 평가와 같은 추가적인 검진을 하는 것이 도움이 될 수 있으며 동반 질환이 많거나 기대 여명이 길지 않은 노인 고혈압 환자에서 발생시에는 이로 인한 부작용을 줄이기 위한 면밀한 모니터링이 필요할 것으로 생각된다.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




