| J Korean Neurol Assoc > Volume 42(1); 2024 > Article |
|
70세 남자가 6개월 전부터 시작된 오른손의 안정떨림(resting tremor)을 주소로 내원하였다. 환자는 고혈압과 심부전으로 베타차단제를 포함한 약물을 복용 중이었으며, 수십년 전에 양극성장애를 진단받고 9개월 전부터 올란자핀(olanzapine)과 발프로산(valproate)으로 약물을 변경하여 복용한 것으로 확인되었다.
신경계진찰에서 경도의 가면얼굴(masked face)이 확인되었고, 중증의 오른손의 안정떨림과 함께 경도의 양손의 체위떨림(postural tremor)이 관찰되었다. 전신에 경도의 경축(rigidity)이 있었으며, 우측 상지에 경도의 운동완만(bradykinesia)이 보였다. 보행 시에 양팔휘젓기운동(arm swing)이 감소되어 있었으며, 오른손의 안정떨림이 더욱 악화되었다. 통합 파킨슨병 척도 중 운동 척도(unified Parkinson’s disease rating scale part III motor scale)는 21점이고 호엔야 척도(Hoehn and Yahr scale)는 stage 2였다. 입원 후 뇌 magnetic resonance imaging (MRI), 18F-fluorinated-N-3-fluoropropyl-2-b-carboxymethoxy-3-b-(4-iodophenyl) nortropane (18F-FP-CIT) 양전자방출단층촬영(positron emission tomography, PET)을 시행하였다.
81세 여자가 5개월 전부터 시작된 양손의 안정떨림을 주소로 병원에 왔다. 환자는 협심증으로 약물을 복용 중이었으며, 약 9개월 전부터 어지럼증을 호소하여 플루나리진(flunarizine) 을 장기간 복용 중이었던 것으로 확인되었다. 환자는 타원에서 파킨슨병(Parkinson’s disease, PD)으로 의증하에 레보도파(levodopa), 프라미펙솔(pramipexole), 라사길린(rasagiline) 등의 약물을 몇 주간 복용한 적이 있었으나, 효과는 없었다고 하였다.
신경계진찰에서 중등도의 가면얼굴과 함께 중증의 양손의 안정떨림이 왼손에서 더욱 심하였고, 경도의 양손의 체위떨림이 같이 관찰되었다. 전신에 경도의 경축이 있었으며, 좌측 상하지에 경도의 운동완만이 보였다. 보행 시에 굽은 자세를 보였고, 보폭은 유지되었으나 속도가 느렸으며 양팔휘젓기운동이 감소되어 있었고 양손의 안정떨림이 더욱 악화되었다. 통합 파킨슨병 척도 중 운동 척도는 28점이고 호엔야 척도는 stage 2였다. 이후 뇌 MRI와 18F-FP-CIT PET를 시행하였다.
환자의 뇌 MRI에서 의미 있는 구조적인 병변은 관찰되지 않았고, 18F-FP-CIT PET는 정상으로 확인되었다(Fig. 1-D-F). 이후 플루나리진 복약을 중단하였으며, 2개월 이후 외래 진료에서 양손의 안정떨림과 다른 파킨슨 증상들이 모두 호전되었다.
파킨슨증(Parkinsonism)은 운동완만, 경축, 떨림과 체위불안정(postural instability)의 임상적 증상을 보이는 현상을 통칭해서 일컫는 용어다. 파킨슨증의 원인은 흑질선조체 경로(nigrostriatal pathway)의 변성 등을 포함한 일차성 신경퇴행질환일 수도 있고, 망간 독성이나 윌슨병과 같이 금속침착증(metal deposition disease)에 해당하는 이차성 원인일 수도 있다. 또한 도파민수용체를 차단하거나 시냅스전(presynaptic) 에 저장된 도파민을 고갈 혹은 유리(release)를 방해하는 약물에 노출되어 흑질선조체 경로의 변성은 일어나지 않지만, 선조체(striatum)의 도파민 신경전달을 방해하고 PD와 유사한 증상을 일으키는 약물 유발 파킨슨증(drug-induced Parkinsonism, DIP)처럼 의인성으로부터 초래될 수 도 있다[1].
흑질선조체 경로의 표시물과 결합하는 리간드(ligand)를 사용하는 PET 또는 단일광자방출컴퓨터단층촬영(single photon emission computed tomography) 뇌 영상은 이 경로가 정상적인지 확인하는 데 도움이 된다. 특발 파킨슨병처럼 시냅스전파킨슨증후군에서는 선조체에서 플루오로도파(fluorodopa) 혹은 도파민운반체(dopamine transporter)의 리간드 섭취가 감소된 양상을 보이게 된다. 하지만 DIP에서는 도파민수용체차단제(dopamine receptor blocking agents)에 의하여 일반적으로 시냅스후(postsynaptic)수용체가 자극된다. 이러한 시냅스후파킨슨증후군에서는 흑질선 조체 경로가 정상이고, 유발 약제들이 도파민운반체에 미치는 영향이 거의 없기 때문에 상기 영상 검사들에서는 모두 정상 결과를 보인다[2]. 일부 DIP 환자에서 도파민운반체 영상이 비정상으로 나올 경우에는 상기 환자에게 PD의 병리 기전 또한 공존하고 있음을 시사하고, 이 경우 유발 약제를 중단한 이후에도 파킨슨증이 지속되거나 악화되는 것으로 알려져 있다. 기존의 한 연구에서 유발 약제를 중단한 이후에 증상이 모두 호전된 두 명의 DIP 환자들의 병리 검사에서 루이소체(Lewy bodies)가 발견되었다는 보고는 증상만으로는 진단된 DIP 환자들 중에서 실제 DIP 환자를 감별하기가 어렵다는 사실을 증명한다[3]. 이에 도파민운반체 영상은 DIP 환자를 진단하고 향후 예후를 예측하는 데 있어서 유용하게 사용될 수 있다. 또한 경두개초음파(transcranial sonography)를 이용한 한 연구에서는 유발 약제에 노출된 후 파킨슨증이 지속된 환자에서는 흑질(substantia nigra)의 고에코음영(hyperechogenicity)을 보이지만, 유발 약제를 중단한 후 증상이 모두 호전된 DIP 환자에서는 흑질의 정상 에코음영(echogenicity)을 보여서 DIP와 퇴행 파킨슨증을 감별하는 데 도움을 줄 수 있다고 하였다[4].
DIP가 발생하면 보통은 원인 약물을 중단하고 경과 관찰을 하게 되고, 경우에 따라서는 일시적으로 PD 치료제가 사용되기도 한다. DIP의 정의에 따라서 유발 약제가 중단된지 6개월 이내에 파킨슨증은 호전되어야 하고[5], 보통 유발 약제를 중단하고 수개월 이내로 파킨슨증은 70% 이상 호전된다고 알려져 있다. 약제 중단 이후에 증상이 즉각 좋아지지 않는 이유는 유발 약제의 긴 반감기로 인하여 체내 조직에서 일정 기간 잔존하는 경향이 있기 때문이다. 특히 정형 항정신병약물의 경우 계면 활성 작용이 강하고 지용성이어서 세포막에 쉽게 침착하는 성질을 가지고 있다[1]. DIP의 예후에 따라서 환자를 세 가지 유형으로 분류해 보면 다음과 같다. 첫째, 약물을 중단하면 파킨슨 증상이 완전히 없어지고 재발하지 않는 경우(pure DIP), 둘째, 약물을 끊은 후에도 파킨슨 증상이 계속 진행되거나 오히려 악화되는 경우(DIP unmasks PD), 셋째, 약을 끊고 증상이 사라진 후 약물과 관계없이 이후에 파킨슨 증상이 나타난 경우(DIP antedates PD)이다[2]. 이처럼 일부 케이스에서는 유발 약제의 중단 이후에도 파킨슨증이 지속되거나 오히려 악화되는 경우도 볼 수 있다. 그 이유는 다음과 같은 가설로 설명할 수 있다. 도파민수용체차단제는 산화 스트레스(oxidative stress)를 증가시키고 미토콘드리아 호흡사슬(mitochondrial respiratory chain)을 억제하며 자가포식용해소체(autophagolysosome)의 형성을 막음으로써 신경 독성을 가진 유리기(free radical)를 생성한다. 그리고 도파민 수용체차단제는 흑질선조체의 도파민신경세포에서 도파민의 합성과 분비를 증가시키며, 따라서 도파민수용체차단제에 장기간 노출될 경우 도파민수용체에 손상을 입혀서 도파민 신경 전달을 방해하게 된다. 이러한 효과가 PD의 병리 기전을 동시에 갖고 있는 DIP 환자들의 신경세포를 더욱 취약하게 만들어서 PD의 임상 증상이 가속화되어 나타나게 되는 것이다[6].
DIP는 특발 파킨슨병 다음으로 흔한 파킨슨증이다. DIP는 하기의 세 가지 특징을 가진 파킨슨증으로 정의된다. 첫째, 도파민을 차단하거나 혹은 도파민을 고갈시키는 원인 약제를 복용한지 6개월 이내로 증상이 발생하였다. 둘째, 원인 약제 복용 이전에는 파킨슨증이 없었다. 셋째, 원인 약제를 중단하고 나서 6개월 이내로 증상이 호전되었다[5]. 하지만 도파민운반체 영상에서 정상 결과를 보인 DIP 환자가 유발 약제의 중단 이후로 9개월 동안 파킨슨증이 지속되었다는 한 보고에서는, 유발 약제의 중단 이후 경과 관찰을 하는 기간을 최소 1년 정도로 잡아야 한다고 주장하였다[7].
나이가 들수록 도파민의 농도가 감소하고 흑질 세포가 변성되기 때문에 나이는 DIP의 가장 분명한 위험인자이다. 그리고 에스트로겐이 도파민수용체의 표출을 억제하기 때문에 여성이 위험인자로 알려져 있다. 또한 도파민수용체차단제를 복용하는 모든 환자에서 DIP가 발생하지는 않기 때문에 일부 유전인자도 관여하는 것으로 알려져 있다[8]. 조현병 환자들을 대상으로 한 유전자 전체 검사(genome-wide screening)에서 감마아미노부티르산(gamma-aminobutyric acid, GABA)수용체의 신호전달과 연관된 유전자들이 도파민수용체차단제로 유발된 지연이상운동증(tardive dyskinesia)을 발생시킨다는 보고는 특정 유전인자가 DIP와 지연이상운동증에 잘 걸리게 한다는 사실을 입증한다[9].
DIP는 처음에는 정형 항정신병약물을 사용하는 환자의 4-40%에서 발생한다고 여겨졌으나 그 외에도 칼슘채널길항제, 비정형 항정신병약물, 항구토제, 항경련제, 항우울제, 항부정맥약 등 다양한 약제들에서도 보고되고 있다(Table 1) [6,10]. 정형 항정신병약물과 칼슘채널길항제에 의한 DIP의 발생 빈도가 줄어들고 있음에도 불구하고, 최근 DIP의 발생률은 전 세계적으로 계속 상승하고 있다. 최근에 보고된 전 세계적 역학 연구에 의하면, DIP는 유럽 대륙의 75세 이상의 남자에게서 흔하게 발생하였고, 설피라이드(sulpiride)와 할로페리돌(haloperidol)이 가장 흔한 유발 약제로 밝혀졌다[11]. 국내에서 가장 많이 사용되는 유발 약제로는 항구토제와 위장관운동조절제(레보설피리드[levosulpiride], 메토클로프라미드[metoclopramide], 이토프리드[itopride], 68.40%), 비정형 항정신병약물(리스페리돈[risperidone], 38.21%), 정형 항정신병약물(할로페리돌[haloperidol], 23.66%) 순으로 보고되었다[10]. 이전의 전향적 연구에서 유발 약제에 노출된 환자가 DIP의 증상을 나타내기까지 걸리는 시간을 조사하였는데, 정형 항정신병약물에 노출된 환자가 가장 짧은 시간이 소요되고 칼슘채널길항제에 노출된 환자들이 가장 오랜 시간이 걸린다고 하였다. 또한 파킨슨증이 지속되는 기간 또한 칼슘채널길항제에 노출된 환자들이 가장 긴 것으로 보고하였다[12].
DIP가 발생하는 기전은 특발 파킨슨병에서 기저핵회로(basal ganglia circuit)의 변화가 일어나는 것과 비슷하다. 도파민수용체차단제에 의해서 선조체의 D2도파민수용체가 차단되면 직접 경로(direct pathway)에는 변화가 없이 GABA와 enkephalin을 포함한 선조체신경을 통한 간접 경로(indirect pathway)가 탈억제(disinhibition)되고 이어서 시상하핵(subthalamic nucleus)이 탈억제된다. 이는 내측 창백핵/흑질그물부(globus pallidus interna/substantia nigra pars reticulata)의 억제성 투사(inhibitory projection)를 강화시켜서 시상-피질 투사(thalamo-cortical projection)의 GA BA를 생산하 는 신경세포의 억제(GA BAergic inhibition)를 증강시키고, 이는 파킨슨증을 유발하게 된다(Fig. 2) [8].
DIP를 PD와 임상적으로 구분하기는 쉽지 않다. 우선 병력 청취상에서 짧은 시간 내에 유발 약제에 노출된 병력을 찾아낸다면, 이후의 감별 진단에 있어서 많은 도움을 얻을 수 있다. DIP는 PD보다 고령의 여성에게서 흔하게 발생한다. 흔히 DIP에서는 떨림이 없고 대칭적인 운동완만과 경축이 대표적인 증상이라고는 하지만, 임상 현장에서는 반드시 그렇지만은 않다. 실제로 30-50%의 DIP 환자들은 비대칭적인 파킨슨증과 안정떨림을 보인다[8]. 그 외 파킨슨병과 구별할 수 있는 증상으로는 체간(axial) 강직, 체위 혹은 활동떨림을 포함한 다양한 양상의 떨림, 하반신보다는 상반신 증상이 심하다는 특징, 보행장애보다는 가면얼굴이 흔하다는 특징이 있을 수 있다. 또한 떨림은 선택 도파민수용체차단체보다는 아미오다론(amiodarone)이나 칼슘채널길항제에서 더 흔하게 발생하는 경향이 있다. DIP에서 가장 특징적인 증상은 입혀저작증후군(bucco-linguo-masticatory syndrome), 국소근긴장이상증(focal dystonia), 상동증(stereotypy), 좌불안석(akathisia) 등의 다른 지연이상운동증이 장기적으로 지속될 수 있다는 점에 있다.2 비운동 증상 또한 DIP와 PD를 감별하는 데 일부 도움을 줄 수 있다. DIP 환자와 비교하였을 때에 PD 환자에게서 비운동 증상 척도(non-motor symptoms scale) 점수가 유의하게 더 높았고,13 세부 항목으로는 소변 증상, 주간과다졸림증, 렘수면행동장애, 하지불안증후군, 집중력 저하, 후각 저하, 성기능 저하, 변비 증상 등이 PD 환자에게서 유의하게 높은 것으로 나타났다[13,14]. 이 중 여러 연구에서 밝혀졌듯이 DIP와 PD를 구별할 수 있는 가장 명확한 비운동 증상은 후각 저하인 것으로 나타났으나, 이 역시 진단적 확실성을 보장하는 생체표지자(biomarker)로 보기에는 어렵다[1].
DIP의 징후는 유발 약제를 시작한 이후로 아주 빠르면 젊은 환자에서는 24시간에서 48시간 이내에, 노인 환자에서는 96시간 이내에 발견할 수 있는 것으로 알려져 있다. 통상 DIP의 증상은 유발 약제를 시작한 초기에 나타나기 때문에, 임상적 추적 관찰의 주기는 유발 약제를 시작한 후 첫 3개월이 지나거나, 유발 약제의 용량을 증가시킨 이후로는 점차 줄여 나가도 되겠다[1].
DIP에서 가장 중요한 치료 방책은 반드시 필요하지 않은 원인 약물의 사용을 피하는 예방 요법이다. 이에 따라 임상의들은 DIP를 유발할 가능성이 있는 약제를 사용하는 환자들의 초기 이상 증상을 면밀히 추적 관찰해야 하며, 관련 증상이 발생하면 해당 약제를 감량 혹은 중단하거나 다른 약제로 바꾸는 등의 빠른 조치가 필요하다. 고령자, 다양한 약제의 장기 사용, PD와 관련된 유전자 이상이나 가족력을 가진 환자에서는 특별한 주의가 요구된다.
하지만 모든 DIP 환자가 유발 약제를 끊을 수 있는 것은 아니다. 특히 정신증(psychosis)이 심한 경우에는 약물을 줄이거나 끊는 것이 쉽지 않다. 정형 항정신병약물의 용량을 감량한 이후로 정신증이 심해지면 도파민수용체에 낮은 친화력을 갖는 비정형 항정신병약물로 대체하는 방법이 권장되고 있으나, 상대적으로 고가의 비정형 항정신병약물을 투여하는 일도 어려울 때가 있다. 그러한 경우에는 일반적으로 PD 치료제가 임상에서 이용되고 있는데, 레보도파나 도파민작용제(dopamine agonist)는 정신증을 악화시킬 수 있는 위험이 있으므로 잘 사용되지 않고 있으며, 항콜린성 약물(trihexyphenidyl, benztropine, procyclidine)을 대체로 사용해 볼 수 있다. 도파민수용체차단제는 도파민 회전율(dopamine turnover)을 증가시키는데, 항콜린성 약물은 티로신수산화효소(tyrosine hydroxylase)의 활성도를 감소시킴으로써 증가된 도파민 회전율을 억제할 수 있다. 또한 도파민을 신경말단으로 재흡수하는 것을 막아줘서 파킨슨증을 완화시킬 수 있다[1]. 하지만 노인에게서 항콜린 효과에 따른 부작용을 야기할 수 있기에 실제로 사용하는 데에는 여러 가지 제한점이 있다. 항콜린성 약물의 사용은 항정신병약물의 혈장 농도를 감소시키거나 효과를 방해할 수 있어서, 조현병 환자에서는 양성 증상을 악화시킬 수도 있다. 이러한 이유로 항정신병약물을 복용하는 환자들에게 DIP를 예방하기 위한 예방적 항콜린성 약물의 사용은 권장되지 않고 있다[15]. 아만타딘(amantadine)은 항콜린성 부작용을 견디기 힘든 노인의 DIP 환자에게 추천되는 약물이다. 기존의 여러 연구에서 항콜린성 약물과 아만타딘의 효과를 비교하였으나, 임상적 효과는 대부분 큰 차이가 없었고, 아만타딘이 항콜린성 약물에 비하여 부작용의 발생 빈도가 다소 낮은 것으로 보고되었다[1]. 따라서 항콜린성 약물의 중추성 이상반응 때문에 투약을 할 수 없는 노인에서는 비교적 항콜린성 효과가 약한 아만타딘의 투여가 대안이 될 수 있겠다. 하지만 DIP 환자들은 이러한 파킨슨병 치료제에 대한 반응성이 PD에 비해서는 좋지 않다. 또한 PD 환자에게서 운동 치료의 효과는 널리 알려진 사실이나, 아직 DIP 환자들에게 있어서는 그 효용성이 입증되지 않은 상태이다[1]. 그럼에도 불구하고 DIP의 약물적 치료 효과가 제한적이기 때문에 운동과 물리 치료 요법도 추천해 볼 수 있겠다.
이미 증상이 발생한 환자들이 앞서 기술한 바와 같이 몇몇의 가설을 토대로 유발 약제의 중단 이후에도 증상이 회복되지 않는 경우들이 있어서, 임상의들은 반드시 필요한 약제만 사용을 하고, 파킨슨증을 유발할 가능성이 있는 약제를 사용할 시에는 환자들에게 DIP에 대한 정보를 전달한 이후 해당 증상이 발생하였을 시에는 발빠른 조치가 필요하겠다. 특히 불안, 불면, 어지럼증, 소화불량을 가진 노인 환자들에게 부적절한 이유로 도파민수용체차단제나 칼슘채널길항제를 쉽게 처방하는 일은 피해야 한다. 특히 상기의 증례 보고에서 언급되었듯이 신경과에서 자주 사용하는 약물인 발프로산과플 루나리진 등도 DIP를 유발하는 약물이며, 신경과 의사 중에서도 DIP를 PD로 오진하는 사례가 많음을 고려하였을 때에, 파킨슨증을 유발할 수 있는 약제에 대한 올바른 인지가 사전에 반드시 필요하겠다. DIP가 진단된 이후에도 대략 46.6%의 환자들이 치환 벤즈아마이드계(substituted benzamides) 소화제(levosulpiride, metoclopramide, itopride)를 여전히 처방받고 있는 국내 실정을 고려하였을 때[10], 상기 질병에 대한 지속적인 교육과 홍보가 과를 불문하고 모든 임상의들에게 반드시 필요한 상태로 생각된다. 그리고 임상적으로 DIP와 PD의 구분이 어렵기에, 단순히 유발 약제만 끊으면 증상이 호전될 DIP 환자들에게 불필요한 PD 치료제를 장기간 처방하는 사례가 많으므로, 임상적으로 PD를 진단하기 전에는 반드시 환자가 복용 중인 약물에 대한 정확한 확인이 필요하겠다. 또한 임상의들은 필요시에 도파민운반체 영상 등의 적절한 진단적 도구를 이용하여 DIP를 제대로 진단할 수 있는 능력을 함양하여야 할 것이다.
1. DIP는 도파민수용체차단제에 장기간 노출된 환자에게 흔하게 발생할 수 있고, 임상 양상은 PD와 비슷하여 감별이 쉽지 않다.
2. 임상의들은 DIP의 증상을 조기에 인식하여 시기적절한 처치(유발 약제의 중단, 감량 혹은 대체)를 하여야 환자의 예후를 향상시킬 수 있다.
3. DIP라고 생각한 환자들이 유발 약제의 중단 이후에도 수개월간 증상이 호전되지 않는다면, PD의 병리 기전 또한 동시에 공존하는 DIP 환자에게서 임상 증상이 빨리 나타난 것으로 생각할 수 있다. 필요시에 도파민운반체 영상을 시행하거나 PD 치료제를 시도해 보면 진단에 도움을 줄 수 있다.
4. 현재 한국 사회에서 많은 임상의들이 무심코 장기 처방하는 수면제, 어지럼증약, 소화제의 일부가 DIP를 쉽게 유발하지만, 임상 증상이 나타난 이후에도 DIP임을 인지하지 못하고 지속적으로 유발 약제를 처방하는 사례가 많다. 따라서 이에 대한 대규모의 교육과 홍보가 필요하다.
REFERENCES
1. Feldman M, Marmol S, Margolesky J. Updated perspectives on the management of drug-induced Parkinsonism (DIP): insights from the clinic. Ther Clin Risk Manag 2022;18:1129-1142.



2. Tolosa E, Coelho M, Gallardo M. DAT imaging in drug-induced and psychogenic parkinsonism. Mov Disord 2003;18 Suppl 7:S28-S33.


3. Rajput AH, Rozdilsky B, Hornykiewicz O, Shannak K, Lee T, Seeman P. Reversible drug-induced Parkinsonism. Clinicopathologic study of two cases. Arch Neurol 1982;39:644-646.


4. Moreno JLLS, Alonso-Cánovas A, Catevilla JB, Barragán NG, Corral IC, Mimbrera ADF, et al. Substantia nigra echogenicity predicts response to drug withdrawal in suspected drug-induced Parkinsonism. Mov Disord Clin Pract 2016;3:268-274.



5. Bower JH, Maraganore DM, McDonnell SK, Rocca WA. Incidence and distribution of Parkinsonism in Olmsted County, Minnesota, 1976-1990. Neurology 1999;52:1214-1220.


6. Erro R, Bhatia KP, Tinazzi M. Parkinsonism following neuroleptic exposure: a double-hit hypothesis? Mov Disord 2015;30:780-785.


7. Lim TT, Ahmed A, Itin I, Gostkowski M, Rudolph J, Cooper S, et al. Is 6 months of neuroleptic withdrawal sufficient to distinguish druginduced Parkinsonism from Parkinson’s disease? Int J Neurosci 2013;123:170-174.


9. Inada T, Koga M, Ishiguro H, Horiuchi Y, Syu A, Yoshio T, et al. Pathway-based association analysis of genome-wide screening data suggest that genes associated with the gamma-aminobutyric acid receptor signaling pathway are involved in neurolepticinduced, treatment-resistant tardive dyskinesia. Pharmacogenet Genomics 2008;18:317-323.

10. Byun JH, Cho H, Kim YJ, Kim JS, Baik JS, Jang S, et al. Trends in the prevalence of drug-induced Parkinsonism in Korea. Yonsei Med J 2019;60:760-767.



11. de Germay S, Montastruc F, Carvajal A, Lapeyre-Mestre M, Montastruc JL. Drug-induced Parkinsonism: revisiting the epidemiology using the WHO pharmacovigilance database. Parkinsonism Relat Disord 2020;70:55-59.


12. Munhoz RP, Filho DB, Teive HA. Not all drug-induced Parkinsonism are the same: the effect of drug class on motor phenotype. Neurol Sci 2017;38:319-324.


13. Kim JS, Youn J, Shin H, Cho JW. Nonmotor symptoms in druginduced Parkinsonism and drug-naïve Parkinson disease. Can J Neurol Sci 2013;40:36-41.


Figure 1.
Imaging studies of two patients. (A-C) Patient 1, (D-F) patient 2. (A, B, D, E) T2-weighted magnetic resonance imaging scans revealed no structural abnormalities including basal ganglia, substantia nigra, and cerebral white matter. (C, F) 18F-fluorinated-N-3-fluoropropyl-2-b-carboxymethoxy-3-b-(4-iodophenyl) nortropane positron emission tomography scans showed normal dopamine transporter bindings in bilateral striatum.
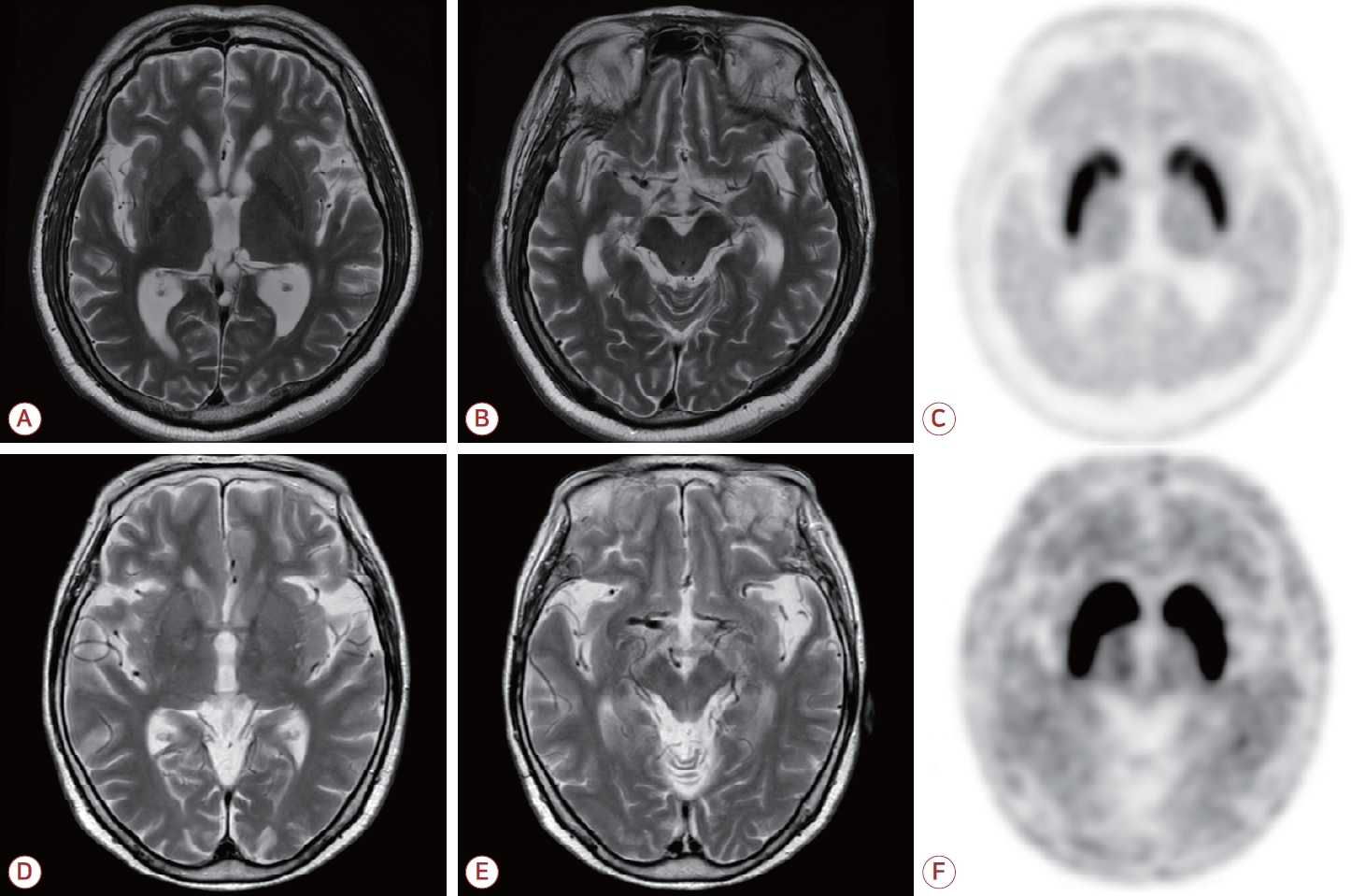
Figure 2.
Changes in basal ganglia-thalamo-cortical motor loop in drug-induced parkinsonism. The blockage of D2 receptors by dopamine receptor blocking agents in the striatum leads to disinhibition of GABA- and enkephalin-containing striatal neurons at the origin of the indirect pathway, followed by a disinhibition of the subthalamic nucleus. This leads to increased GABAergic inhibition of the thalamo-cortical projection by facilitation of the inhibitory projection from the GPi/SNr. Adapted from Shin et al [8]. Glu; glutamate, Ach; acetylcholine, GABA; gamma-aminobutyric acid, Enk; enkephalin, SP; substance P, Dyn; dynorphin, GPe; globus pallidus externa, DA; dopamine, SNc; substantia nigra pars compacta, STN; subthalamic nucleus, GPi; globus pallidus interna, SNr; substantia nigra pars reticulata.

Table 1.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 564 View
- 68 Download
- Related articles
-
Clinical Reasoning: Two Patients Presenting with Neuropathic Pain in Lower limbs2022 August;40(3)
Meningeal Carcinomatosis Presenting with Isolated Pseudotumor Cerebri2020 February;38(1)
Idiopathic Parkinson's Disease Presenting with Sleep Terrors2006 ;24(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



