기억력 저하와 보행장애를 주소로 내원한 모계유전당뇨와 난청 환자
Maternally Inherited Diabetes and Deafness Presenting with Memory Impairment and Gait Disturbance
Article information
Trans Abstract
Maternally inherited diabetes and deafness (MIDD) is a disorder characterized by the occurrence of diabetes mellitus and hearing impairment at a young age, caused by point mutations in mitochondrial DNA. MIDD can be accompanied by various neurological symptoms. In this patient, memory impairment and ataxia were the predominant neurological symptoms. Herein, we report MIDD patients with the m.3243A>G mutation who present with cognitive decline and gait disturbance at the age of 59.
Mitochondrially encoded tRNA leucine 1 (MTTL1)유전자의 m.3243A>G 병원성 변이(pathogenic variant)는 멜라스증후군(metabolic encephalopathy, lactic acidosis and stroke-like episodes syndrome, MELAS) 환자의 80% 정도에서 볼 수 있는 점돌연변이(point mutation)이다[1]. m.3243A>G 변이는 MELAS 이외에도 모계유전당뇨와 난청(maternally inherited diabetes and deafness, MIDD), 레이증후군 그리고 진행외안근마비(progressive external ophthalmoplegia, PEO) 등 다양한 종류의 미토콘드리아 증후군의 유전적 원인이 될 수 있다[1,2]. Medical Research Council의 mitochondrial diseases patient cohort 연구에 따르면 MELAS보다 MIDD가 더 흔하며, m.3243A>G 변이는 MIDD의 가장 주요한 원인이다[1].
MIDD는 젊은 나이에 발생하는 당뇨와 청각 소실을 주 증상으로 하는 유전성 미토콘드리아증후군으로 m.3243A>G 변이 외에 20여 개의 미토콘드리아 점돌연변이들이 확인되었다[3]. m.3243A>G 변이가 원인이 되는 MIDD 환자는 저신장(short stature), 망막증, 심장질환과 위장장애 등 비신경계 증상뿐만 아니라 근위부근육병(proximal myopathy), 실조증(ataxia), 편두통, 경련(seizure) 등 다양한 신경계 이상을 보일 수 있다[1,4]. MIDD 환자에서 대뇌와 소뇌를 포함한 광범위한 뇌위축을 보고한 증례,5 소뇌위축과 실조증을 보인 증례[6], 뇌영상 소견은 없으나 인지장애를 보고한 증례[6] 등이 있다.
그러나 m.3243A>G 변이에 의한 MIDD 환자에서 실조증과 치매가 동반되어 나타난 증례에 대한 보고는 국내외적으로 거의 없어서 저자는 이를 보고하고자 한다.
증 례
59세 여자 환자가 1년 전부터 심화된 기억력장애를 주소로 2022년 1월 병원을 방문하였다. 환자는 음주를 하지 않았으며 흡연력은 없었고 32세 때 당뇨병 진단을 받았다. 당뇨병 진단을 받고 얼마 후부터 난청이 매우 심해졌다고 하였다. 과거력상 고지혈증과 관상동맥질환으로 스타틴과 항혈소판제를 복용 중이었다. 2008년부터 시력 저하로 안과에서 망막증 진단을 받았고 당시 발의 감각도 떨어져서 신경전도 검사를 하였으며 감각운동다발신경병증(sensorimotor polyneuropathy) 으로 진단되었다. 2018년 심근병증과 관상동맥질환 진단을 받고 심장 스텐트 시술과 투약을 시작하였다. 환자는 1남 4녀 중 3녀이며 모친이 40대 중반 사망하였는데, 키도 매우 작았고 근육에 힘이 없어서 물건도 못 드는 경우가 많았다고 한다. 환자의 형제자매 모두 40대 초반까지 당뇨병 진단을 받았다. 환자에게는 1남 1녀가 있었으며, 첫째인 딸은 30대 중반에 당뇨병 진단을 받았고 경한 난청이 있었다. 둘째인 아들은 신장이 160 cm로 10대 후반에 당뇨병 진단을 받았으며 20대부터 난청이 심해진 상태이고 신기능의 악화로 현재 투석 중이다(Fig. 1).
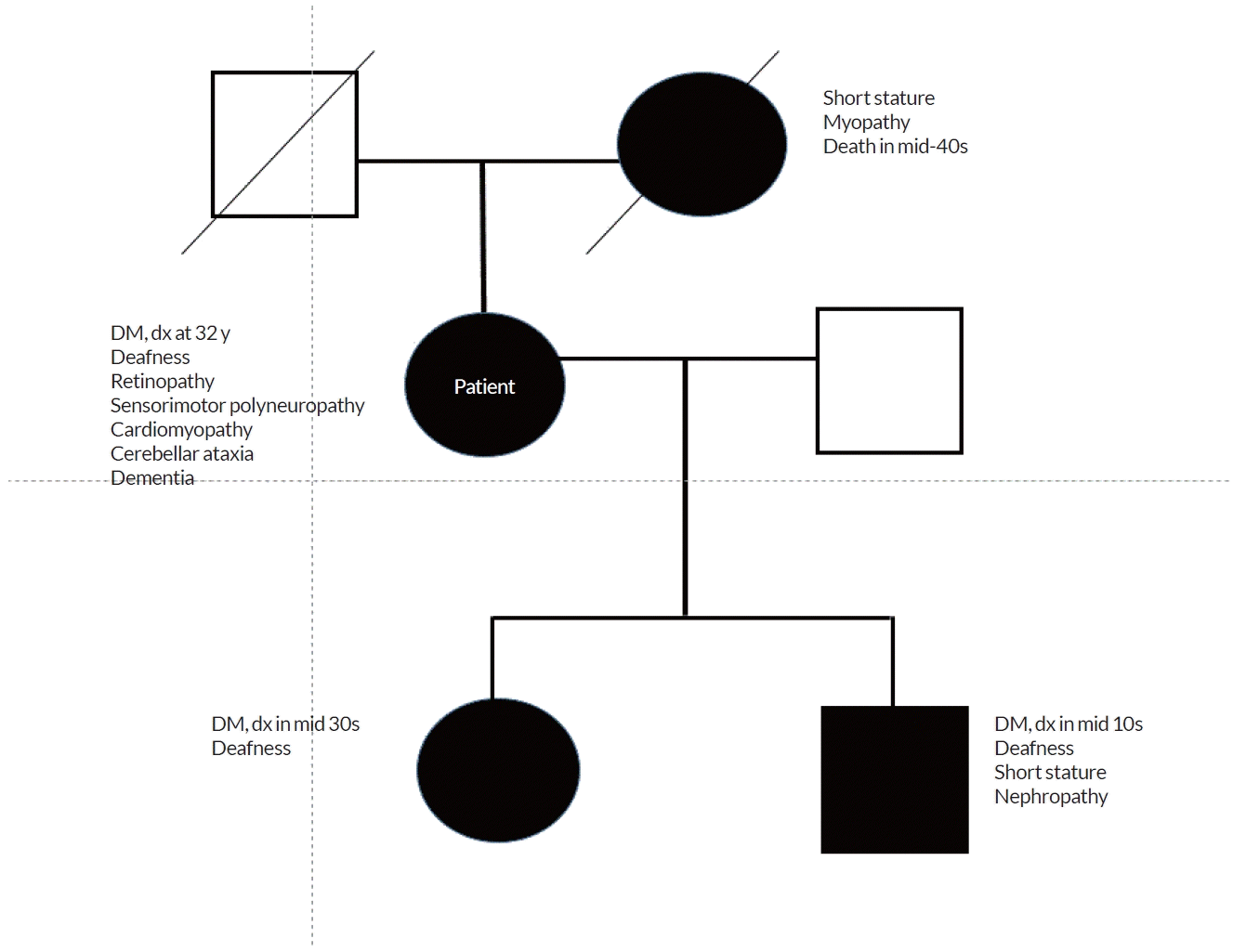
Pedigree of a family with MIDD. MIDD; maternally inherited diabetes and deafness, DM; diabetes mellitus, dx; diagnosis.
환자는 9년 학력이었으며 2022년 2월에 시행된 서울 신경심리선별 종합 검사(Seoul neuropsychological screening battery, SNSB) 결과 기억력을 포함한 모든 인지영역의 저하 소견과 일상생활 능력의 저하 소견을 보이는 임상치매평가(clinical dementia rating, CDR) 1단계 치매 상태였다. 간이 정신상태 검사(mini-mental state examination, MMSE)는 28점이고 CDR-sum of box (SB)는 4.5점이었다. 2022년 2월 시행된 뇌 magnetic resonance imaging(MRI)은 해마를 포함한 전반적인 대뇌위축과 소뇌위축을 보였다(Fig. 2). T1강조축영상에서 소뇌위축(Fig. 2-A), 양측 해마위축(Fig. 2-B), 양측 마루엽위축(Fig. 2-C), T1강조시상영 상에서 전반적인 대뇌와 소뇌위축(Fig. 2-D, E) 그리고 액체감상샘 검사와 비타민B12, 혈중 엽산 농도는 정상이었으며 매독 혈청(venereal disease research laboratory test, VDRL)검사는 음성 소견을 보였다. 2022년 4월 18F-florbetaben 아밀로이드 양전자방출단층촬영(amyloid positron emission tomography, amyloid PET)을 시행하였고 음성 소견을 보였다(Fig. 3). 환자는 2022년 6월부터 걸음걸이가 느리고 이상하다고 하였으며 목소리도 아기처럼 변했다고 하였다. 당시 시행된 신경계진찰에서 사지실조증(limb ataxia)과 보행실조증(gait ataxia)을 보였고 실조성 조음장애가 있었다. 환자의 딸에 따르면 모친이 심한 난청이어서 목소리가 이상했는데 최근 들어서 뚜렷이 더 악화되었다고 하며 보행도 오래전부터 다른 사람보다 느리고 서툴렀는데 요즘은 비틀거리는 양상이 훨씬 심해졌다고 한다. 환자의 자율신경계 기능 검사를 시행하였으며 기립성 저혈압이나 특별한 자율신경계 이상 소견은 보이지 않았다. 환자와 환자 가족들이 보이는 젊은 나이에 발생한 당뇨와 심한 난청, 모계 유전을 보이는 점, 뇌 MRI에서 보이는 대뇌와 소뇌의 심한 위축, amyloid PET 음성인 점을 고려하여 미토콘드리아질환을 의심하였고 미토콘드리아DNA (mitochondrial DNA, mtDNA)에 대한 검사에서 m.3243A>G 변이가 확인되었다.

Brain magnetic resonance imaging (MRI) of the proband (I-1). Axial T1-weighted image (A-C) shows severe cerebellar atrophy (A), both hippocampal atrophy (B), and cortical atrophy, worse on the left parietal lobe (C). Sagittal T1-weighted image demonstrates both cortical and cerebellar atrophy (D-E). Fluid attenuated inversion recovery (FLAIR) image shows extensive white matter hyperintensities (F).
고 찰
미토콘드리아질환은 특성상 모든 기관이 이환될 수 있으나, 신경계가 가장 흔한 이환 기관이다. 1개의 세포 내에는 세포의 특성에 따라 수십 개에서 수천 개 가까이 미토콘드리아가 존재하기 때문에 미토콘드리아의 유전자에 병원성 변이가 생기더라도 정상 유전체와 병원성 변이가 혼재하게 되는데 이것을 이종질(heteroplasmy)이라고 한다. 변이가 생긴 미토콘드리아가 많을수록 heteroplasmy가 높아지고 증상이 심하게 나타나게 된다. 따라서 유전성 미토콘드리아질환은 임상적 다양성을 나타나게 되며 MELAS, 레이증후군, 그리고 PEO 등과 같이 특정 증상을 모아서 진단하는 경우보다 훨씬 더 많은 다양한 조합이 나타날 수 있다[1].
m.3243A>G 변이에 의한 MIDD는 1992년에 처음 발표되었다[7]. m.3243A>G 변이에 의한 MIDD 환자의 50% 이상에서 MELAS에 해당되지는 않지만 뇌영상에서 전반적인 대뇌위축, 소뇌위축, 양측 기저핵 부위 칼슘 침착 그리고 피질하백질 변성이나 기저핵 부위 신호증가 병변을 보이며, 중추신경계와 근육질환 이외에도 망막증, 심근병증, 만성신부전 그리고 심한 위장장애의 증상이 나타난다[8]. 본 증례의 경우 MIDD, 대뇌위축와 소뇌위축에 의한 CDR 1단계 치매 상태와 소뇌실조증, 다발신경병증, 망막증과 심근병증이 있었다. 그리고 본 증례의 아들은 MIDD, 만성신부전, 일반인에 비하여 작은 키를 보였다. MIDD에 의하여 발생하는 만성신부전은 국소분절사구체경화증이 가장 흔한 원인으로 상당수의 환자에서 당뇨 진단 전에 신장 손상이 와서 투석하는 경우가 발생하며 일부 환자에서 당뇨의 합병증으로 만성신부전이 발생한다. 당뇨병이 없는 심한 난청 환자가 황반변성에 의한 망막증과 안검하수를 주 증상으로 신경과에 내원하여 m.3243A>G 변이를 진단받은 증례도 있다[9]. 본 증례의 모친은 일반인에 비하여 매우 작은 키, 근육병 추정 소견 그리고 40대 중반 사망의 소견을 보였는데 환자와 환자의 딸은 평균적인 키였다. Heteroplasmy에 의하여 같은 가족 내에서도 이처럼 다양한 증상을 보였다. 환자의 모친, 환자, 환자의 형제자매 그리고 환자의 자녀들에게서 뚜렷한 모계유전 성향의 가족력을 보이며 비교적 젊은 나이에 광범위한 다기관 이환을 보였으나 개별적인 질환의 진단만 받았을 뿐 유전성 미토콘드리아질환에 대하여 진단받은 바가 없다.
본 증례의 경우 첫 신경계 증상은 2021년 초부터 악화된 기억력 저하를 포함한 인지기능의 저하와 일상생활 능력의 저하였다. 뇌 MRI에서 해마 위축 소견을 보여 조발형 알츠하이머병을 의심하였으나 amyloid PET 음성이었으며 2022년 2월에 시행된 MRI에서는 소뇌위축 소견이 보였으나 소뇌실조증의 증상 및 징후는 뚜렷하지 않았다. 그러나 2022년 6월부터 보행장애의 악화와 조음장애가 뚜렷해졌다. 다계통위축증(multiple systemic atrophy) 등의 감별을 위하여 자율신경계 기능 검사를 시행하였으나 음성 소견이었고 파킨슨증후군의 증상도 없었다
따라서 50대 후반부터 악화되는 원인 미상의 대뇌위축과 소뇌위축에 따른 신경퇴행질환이 환자의 주된 신경계 증상이었다. 30대에 발생하는 당뇨와 심한 청력 저하의 가족력이 환자를 MIDD로 진단하는 데 결정적인 도움을 주었다. 그러나 다른 형제자매들에게서는 아직까지 m.3243A>G 변이에 대한 유전자 검사가 시행되지 않았다. 유전 치료 방법이 없는 상태에서 가족력이 노출되는 것에 대한 거부감이 있기 때문이다.
MIDD는 유전성 미토콘드리아질환 가운데 가장 흔한 증후군 중 하나이며[10] m.3243A>G 변이에 의한 MIDD의 경우 소뇌 이환이 10% 이상, 치매 발생이 약 5% 정도에서 보고되고 있다. 그러나 치매나 소뇌실조증의 다른 원인에 대하여 평가를 시행한 증례는 국내외적으로 거의 없다. 본 증례에서는 amlyoid PET과 자율신경계 기능 검사를 통하여 알츠하이머병이나 다계통위축증 가능성을 명확히 제외하여 환자에서 보이는 대뇌위축에 의한 치매 증상과 소뇌실조증의 원인이 m.3243A>G 변이에 따른 MIDD에 의한 것임을 알 수 있었다.
Acknowledgements
This work was supported by the 2023 Education, Research, and Student Guidance Grant funded by Jeju National University.
