젊은 성인 여성에서 OTC유전자의 c.386+5G>A 돌연변이로 발생한 고암모니아뇌병증
Hyperammonemic Encephalopathy Caused by the c.386+5G>A Mutation in OTC Gene in a Young Adult Woman
Article information
Trans Abstract
Noncirrhotic hyperammonemia as a cause of acute confusion remains diagnostic challenge. Deficiency of ornithine transcarbamylase (OTC) is the urea cycle disorder, inborn errors caused by a defect of the enzymes in the urea cycle, leading to an accumulation of ammonia mainly in newborn. There were very few cases, in which OTC deficiency result in hyperammonemia in adulthood. Herein, we report a young adult woman of hyperammonemic encephalopathy with OTC deficiency, diagnosed by high blood ammonia, glutamine and low plasma levels of citrulline. Next generation sequencing showed the c.386+5G>A mutation of the OTC gene.
고암모니아혈증은 신경독성을 일으켜 뇌병증을 유발하며, 의식 변화와 함께 구토, 발작이 발생할 수 있고 심하면 뇌부종, 뇌압 상승 및 사망에 이를 수 있다[1]. 성인에서는 대부분 중증 간질환의 결과로 간성 고암모니아혈증이 발생하는데, 그 외에 도 혈액암, 문맥전신션트, 장관내출혈, 비경구 영양, 약물 중독 등이 비간경화성 고암모니아혈증을 유발할 수 있다[1]. 요소회로 대사장애(disorder of urea cycle metabolism)는 대개 출생 직후부터 고암모니아혈증으로 인한 중추신경계의 손상이 발생하는 선천성 대사질환으로, 치명적인 경우가 많아 건강한 성인에서 처음 진단되는 경우는 매우 드물다[1].
저자들은 기저질환이 없는 건강한 19세 여성이 갑작스럽게 발생한 혼돈 증상으로 내원하여 ornithine transcarbamylase (OTC) 결핍증으로 추정 진단된 비간경화성 고암모니아 뇌병증 1예를 경험하였기에 이를 보고하고자 한다.
증 례
19세 여자가 갑자기 발생한 의식 변화를 주소로 응급실에 왔다. 의식은 멍하고 정신기능의 속도가 저하되어 반응이 느렸으며 상황에 적절한 대답을 하지 못하는 혼돈 상태를 보였다. 신경계진찰에서 퍼덕떨림(flapping tremor)을 보였고 다른 이상 소견은 없었다. 가족력에서 의식 변화를 유발할 만한 특이 병력은 확인되지 않았다. 과거력상 4-5세경 수일 동안 멍하고 반응이 떨어지는 증상을 보였으나 특별한 조치 없이 회복된 적 있었고, 당시 특별한 진단은 받지 못하였다고 하였다. 이후 현재까지 정상적인 발달 과정을 거쳤으며, 특이 병력이나 현재 복용 중인 약물은 없는 상태이다. 뇌 조영증강 전산화단층촬영 및 뇌 조영증강 자기공명영상에서 구조적 이상 소견은 없었으며(Fig. 1), 뇌척수액 검사에서 뇌압은 150 mmH2O, 백혈구 1/mm3, 총 단백질 28.3 mg/dL, 포도당 71 mg/dL, 혈청포도당 118 mg/dL로 중추신경계 감염 및 염증의 증거는 없었다. 혈액 검사에서는 간기능은 정상이나 혈중 암모니아 농도가 290 μg/dL로 정상 수치의 4-5배가량 상승하여 있었다. 이에 대해 복부 조영증강 전산화단층촬영을 시행하였으나 간 및 간문맥 등의 구조적 이상은 보이지 않았다(Fig. 2). 뇌파 검사에서는 전반적인 세타파(theta slowing, 4-7 Hz) (Fig. 3-A)를 보여 고암모니아혈증으로 인한 대사 뇌병증(metabolic encephalopathy) 진단하에 경구 락툴로스(lactulose) 투약을 시작하였다. 그 외 국소 시작발작이 발생하였을 가능성을 배제할 수 없어 레비티라세참(levetiracetam) 투약도 같이 시작하였다. 입원 2일째 추적 혈액 검사에서 혈중 암모니아 수치는 174 μg/dL로 감소하였으며, 의식 수준도 명료하게 평소와 같은 수준으로 회복되었다. 추적 뇌파 검사도 정상이었다(Fig. 3-B).
Brain magnetic resonance imaging of the patients. (A) T1-weighted axial image, (B) T2-weighted axial image, (C) T2-weighted fluid attenuated inversion recovery image, (D) T1 gadolinium-enhanced axial image. There is no demonstrable lesion causing neurologic deficit such as confusion.

Abdomen-pelvis computed tomography (A) Pre-contrast phase, (B) arterial phase, (C) portal venous phase. There is no structural lesion such as liver cirrhosis, portosystemic shunt.
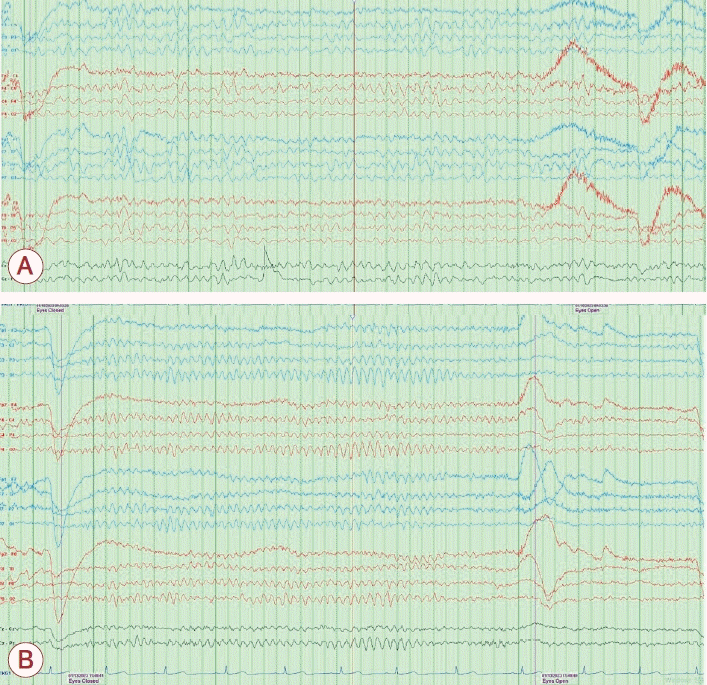
Electroencephalography (EEG). (A) Mild diffuse cerebral dysfunction. The background activity of both hemispheres was composed of 4-7 Hz theta activity, which is reactive to eye opening and closure. (B) Normal EEG. The background activity of both hemispheres was composed of 8-9 Hz theta to alpha activity, which is reactive to eye opening and closure.
특이 병력 및 유발 약물 복용력 없이 발생한 고암모니아혈증에 대해 환자가 여성인 점, 과거력상 명확하지 않지만 유아기에 의심되는 에피소드가 있었던 점을 고려할 때 X-연관 유전의 요소회로 대사장애 가능성을 고려하여 차세대염기서열분석법(next generation sequencing, NGS)을 이용한 선천대사장애 유전자패널 검사를 시행하였다. 환자의 NGS에서 OTC를 부호화하는 유전자 중 386번째 코돈에서 5번째 위치한 염기인 구아닌이 아데닌으로 치환된 유전자 변이를 확인할 수 있었다(c.386+5G>A). 또한, 시행한 혈중 아미노산 검사에서 시트룰린(citrulline)이 5.8로 감소하였으며 글루타민(glutamine)은 780.4로 증가하여 본 증례의 환자는 선천 대사장애 중 요소회로 대사장애인 OTC 결핍증에 의한 고암모니아혈증으로 추정 진단할 수 있었다. 추가로 시행한 어머니의 유전자 검사 결과에서 환자와 같은 변이는 발견되지 않았고, 다른 가족들은 유전자 검사를 시행하지 않았다.
환자는 입원 8일째 추적 혈중 암모니아 농도 27 μg/dL로 정상 범위 내로 감소하였으며 추적 뇌파 검사에서도 정상 뇌파를 보여 퇴원하였다. 이후 환자는 지속적으로 저단백 식이 및 약물 복용에 유의하며 보존 치료 중이고, 증상 재발 없이 외래에서 경과 관찰 중이지만 경구 락툴로스 감량이나 중단 시에는 다시 혈중 암모니아 농도가 증가하는 양상이 반복되고 있다.
고 찰
OTC는 요소회로(urea cycle) 중 오니틴(ornithine)과 카바밀인산염(carbamylphosphate)의 결합을 촉매하여 시트 룰린을 생성하는 효소로 OTC 결핍 시 혈중 시트룰린이 감소하며, 카바밀인산염 및 그 전구물질인 암모니아, 글루탐산염(glutamate), 글루타민, 알라닌(alanine) 등이 축적되는 X-연관(X-linked) 유전의 가장 흔한 요소회로장애이다[2,3]. 이에 따라 고암모니아혈증 및 고글루타민혈증을 보이게 되고, 전형적인 임상 양상으로는 주로 남성에서 출생 당시에는 특별한 이상이 없다가 생후 24-48시간 후부터 점차 심한 보챔, 반복적 구토와 함께 의식의 변화를 나타내며, 경련, 호흡부전, 혼수로 진행하여 사망에 이르기도 한다[3]. X 염색체의 p21.1에 위치하는 OTC유전자는 X-연관 유전을 보이므로 대개 남성과 여성에서 다른 임상 경과를 가진다. 이형접합자(heterozygote)인 여성 보인자(carrier)의 증상 발현은 드물지만 변이를 가진 맞섬유전자(allele)의 활성화 정도에 따라서 영아기부터 성인기까지 다양하게 발현 시기를 보이기도 하고, 간헐적으로 증상이 발현되기도 한다[4,5]. 간헐적인 증상의 발현을 보이는 원인은 명확히 밝혀지지 않았으나, 고단백 식이나 급성 스트레스, 외상, 감염 등에 의해 고암모니아혈증 삽화가 유도되며 신경계 증상을 일으키는 것으로 알려져 있다[2,6].
TC 결핍증은 확진을 위해서는 간 생검(liver biopsy)을 시행하여 OTC 활성도를 측정해야 하는데, 근래에는 OTC유전자의 DNA 분석을 시행하여 돌연변이를 확인하는 방법이 이용되고 있다. OTC유전자의 질병 유발 변이(disease-caus-ing mutation)는 보고된 공식 변이(public variant)만도 400여 개에 이르며 이는 증상의 다양성을 설명해 준다[7]. 본 증례에서는 말초혈액의 백혈구 DNA를 이용하여 NGS를 시행하였으며 X 염색체의 p21.1에 위치한 OTC 유전자의 c.386+5G>A로의 단일 염기 변이가 확인되었다. 이 변이는 인트론에 발생한 돌연변이로 cryptic 5’ 스플라이스 사이트(splice site)의 비활성화로 인한 전사(transcription) 과정에서 장애를 일으킨다. 간 혹은 장점막세포에서 아주 낮거나 거의 확인되지 않을 정도의 OTC 활성도를 보여 OTC 결핍증으로 확진할 수 있었던 환자에게서 발견된 변이로, likely pathogenic으로 알려진 변이다[8,9].
본 증례에서 혈중 아미노산 농도, 소변 유기산(orotic acid)에 대한 검사는 고암모니아혈증을 보일 당시에는 이루어지지 않았고 암모니아 수치가 정상화된 상태에서 진행되었다. 그럼에도 불구하고 혈중 아미노산 검사에서 시트룰린 감소와 글루타민 증가 그리고 소변 유기산 검사에서는 일반적으로 검출되지 않는 오로트산(orotic acid)이 검출되었다. 이는 OTC유전자의 변이로 인한 OTC 효소의 기능 변화를 간접적으로 시사할 수 있는 소견이다.
환자의 경우 환자의 어머니에게는 OTC유전자 돌연변이가 확인되지 않아 de novo 돌연변이로 추정되나, OTC 결핍증이 진단된 경우 환자의 어머니가 OTC유전자 돌연변이를 가지고 있는 무증상 보인자인지 알아보는 것이 유전 상담에 중요하다[3]. 치료는 고암모니아혈증이나 고글루타민혈증에 의한 신경계 증상의 발현 및 뇌 손상을 막는 것으로 암모니아의 축적을 막기 위한 저단백 식이, 암모니아 배설을 증가시키는 약물(genzoate, 페닐부티레이트[phenylbutyrate], 페닐아세테이트[phenylacetate])의 투여, 필수 아미노산인 아르지닌(arginine) 보충 등의 보존 치료를 시행한다[3].
본 증례의 환자는 기저질환이 없는 건강한 젊은 성인으로, 성인이 될 때까지 정상적인 발달을 보이며 중대한 신경계 증상의 삽화 없이 지내다 뒤늦게 OTC 결핍증으로 진단되었다. 이러한 환자를 신경과 의사가 처음 응급실에서 접하면 갑작스러운 의식 변화의 원인으로 고암모니아혈증을 추정하거나 선천 대사장애의 가능성을 고려하기는 쉽지 않다. 하지만 원인 불명의 고암모니아혈증이 반복되고 특히 환자가 여성인 경우에는 뒤늦게 성인에서 진단되는 요소회로 대사장애의 가능성을 고려하여야 하며 필요시 유전자 검사와 함께 적절한 치료 계획을 세워야 함을 제시하는 바이다.