고혈당 상태에서 국소 과관류와 연관된 가역동측반맹
Reversible Homonymous Hemianopia Associated with Focal Hyperperfusion in Hyperglycemic State
Article information
Trans Abstract
Hyperglycemic state frequently presents with neurologic manifestations including choreoathetosis, ballismus, dysphagia, seizures, and coma. Also, hyperglycemic hemianopia has been rarely reported to cause temporary damage to the visual cortex, resulting in homonymous hemianopia. A 65-year-old man was admitted because of right homonymous hemianopia accompanied by hyperglycemia. Brain single-photon emission computed tomography showed focal hyperperfusion in the left occipital lobe. Herein we report a case of reversible homonymous hemianopia with cerebral hyperperfusion associated hyperglycemia without seizure.
고혈당 상태의 환자에서 나타나는 신경계 증상으로 혼수의 빈도가 가장 많고 발작, 고혈당반무도병-반무도증 순서로 발생하며 이외에도 편마비 및 반맹이 나타날 수 있다. 일반적으로 뇌졸중의 경우 뇌조직의 허혈로 인해 나타나는 신경계 증상이 호전되지 않으나 고혈당에 의한 신경계 증상은 적절한 치료에 의해 호전된다.
고혈당반맹은 시각 피질에 일시적인 손상을 일으켜 동측반맹을 초래하는 것으로 드물게 보고되고 있다. 발작과 동측반맹의 연관성을 제안하고 있지만 아직까지 고혈당반맹에서 신경계장애와 뇌영상 소견의 연관성은 잘 알려져 있지 않다. 고혈당으로 인한 신경계 증상이 있는 경우 뇌 자기공명영상은 증상과 관련 있는 해당 부위에 고전적으로 T2강조영상에서 피질하부를 따라 저신호강도를 보이는데 이는 아교세포와 지지 조직의 세포 내 탈수 및 자유 라디칼의 축적의 결과로 여겨 진다[1].
당뇨 환자의 경우 만성 미세혈관허혈로 인해 대뇌반구 백색질에 뇌저관류를 보인다고 알려져 있다[2]. 저자들은 동측반맹을 주소로 내원한 환자에서 처음 당뇨로 진단하고 뇌 단일광자방출컴퓨터단층촬영술에서 좌측 후두엽 부위에 국소적인 과관류를 보이는 증례를 경험하였기에 이를 보고하고 고찰하고자 한다.
증 례
65세 남자가 내원 10일 전 아침 기상 시 발생한 시야장애를 주소로 내원하였다. 처음 증상 발생 당시 우측 바깥쪽이 잘 보이지 않다가 점점 심해졌다고 하였다. 환자는 고혈압, 당뇨를 진단받은 적은 없었고 고지혈증 과거력으로 피타바스타틴(pitavastatin) 을 복용 중이었으며 하지불안증후군으로 프라미펙솔(pramipexol)과 클로나제팜(clonazepam)을 복용 중이었다. 음주와 흡연은 하지 않았다. 환자는 동측반맹에 대한 원인 감별을 위해 입원하여 추가적 평가를 진행하기로 하였다.
환자는 내원 당시 활력징후는 정상이었고 신경계진찰상 의식은 명료하였으며 우측 동측반맹이 확인되었고 시야측정법(perimetry) 검사에서도 동측반맹이 확인되었다. 뇌 자기공명영상에서 확산강조영상(diffusion weighted image)에서는 특이 소견이 없었으나 좌측 후두엽 부위에서 T2강조영상과 액체감쇠역전회복영상(fluid-attenuated inversion recovery, FLAIR)에서 저신호강도가 확인되었고 겉보기확산계수(apparent diffusion coefficient) 영상에서도 저신호강도가 확인되었다(Fig. 1). 내원 당시 시행한 동맥혈 검사에서 혈액 산도(pH)는 7.372로 정상 범주 내였고 중탄산염은 22.8 mmol/L, 음이온차(anion gap)는 10.1로 확인되었으며 소변 검사상 케톤체는 약하게 양성을 보였다. 혈액 검사에서 혈당은 632 md/dL였으며 당화혈색소가 12.0%로 상승되어 있었고 혈청 삼투질 농도는 334 mOsm/kg으로 확인되었다. 이외 혈액 검사에서 류마티스인자(rheumatoid factor), 루푸스항응고인자(lupus anticoagulant), 항베타2-당단백질항체(anti-beta 2 glycoprotein antibody), 보체(complement C3, complement C4), 항핵항체(anti-nuclear antibody), 항 dsDNA항체(anti double stranded DNA antibody), 항RNP항체(anti RNP antibody), 항카디오리핀항체(anti-cardiolipin antibody), 항Sjogren's syndrome-related antigen A (Ro/SSA)항체, 항Sjogren's syndrome-related antigen B (La/SSB)항체, 항사구체기저막항체(anti-glomerular basement membrane antibody), 항시트룰린단백항체(anti-citrullinated protein antibody)는 정상이었다. 뇌파 검사에서는 정상으로 확인되었다. 뇌척수액 검사에서는 백혈구 1개/mm3, 단백치 50.1 mg/dL, 당수치 153 mg/dL 였으며 뇌척수액 세포 검사(cytology)상 암세포는 없었다.

Brain MRI and MRA of the patient. (A) Axial T1-weighted, (B) DWI shows no abnormality and (C, D) angiography shows no vascular malformation. (E) Axial T2-weighted (yellow arrow), (F) coronal T2-weighted (yellow arrow), (G) FLAIR (yellow arrow), and (H) ADC (yellow arrow) show low signal change in the left occipital lobe. MRI; magnetic resonance imaging, MRA; magnetic resonance angiography, DWI; diffusion weighted image, FLAIR; fluid-attenuated inversion recovery, ADC; apparent diffusion coefficient.
환자는 적절한 수분 공급과 더불어 인슐린 주사를 통해 엄격하게 혈당 조절을 시작하였으며 입원 3일째 시행한 뇌 단일광자방출컴퓨터단층촬영술에서 좌측 후두엽 부위 과관류가 확인되었다. 증상은 점차 호전되었으며 1주일 뒤 증상은 완전히 호전되었다. 퇴원 이후에도 인슐린으로 혈당을 엄격하게 200 mg/dL 이하로 조절하였고 퇴원 후 1주일 뒤에 시행한 뇌단일광자방출컴퓨터단층촬영술에서 과관류가 확인되었던 좌측 후두엽 부위는 정상화되었으며 시야측정법 검사에서도 반맹은 호전되었다(Fig. 2). 환자는 1달 뒤 시행한 혈액 검사에서 혈당과 혈청 삼투질 농도가 정상화되었고 국소 신경학적 결손 없이 3개월째 외래 추적 관찰 중이다.
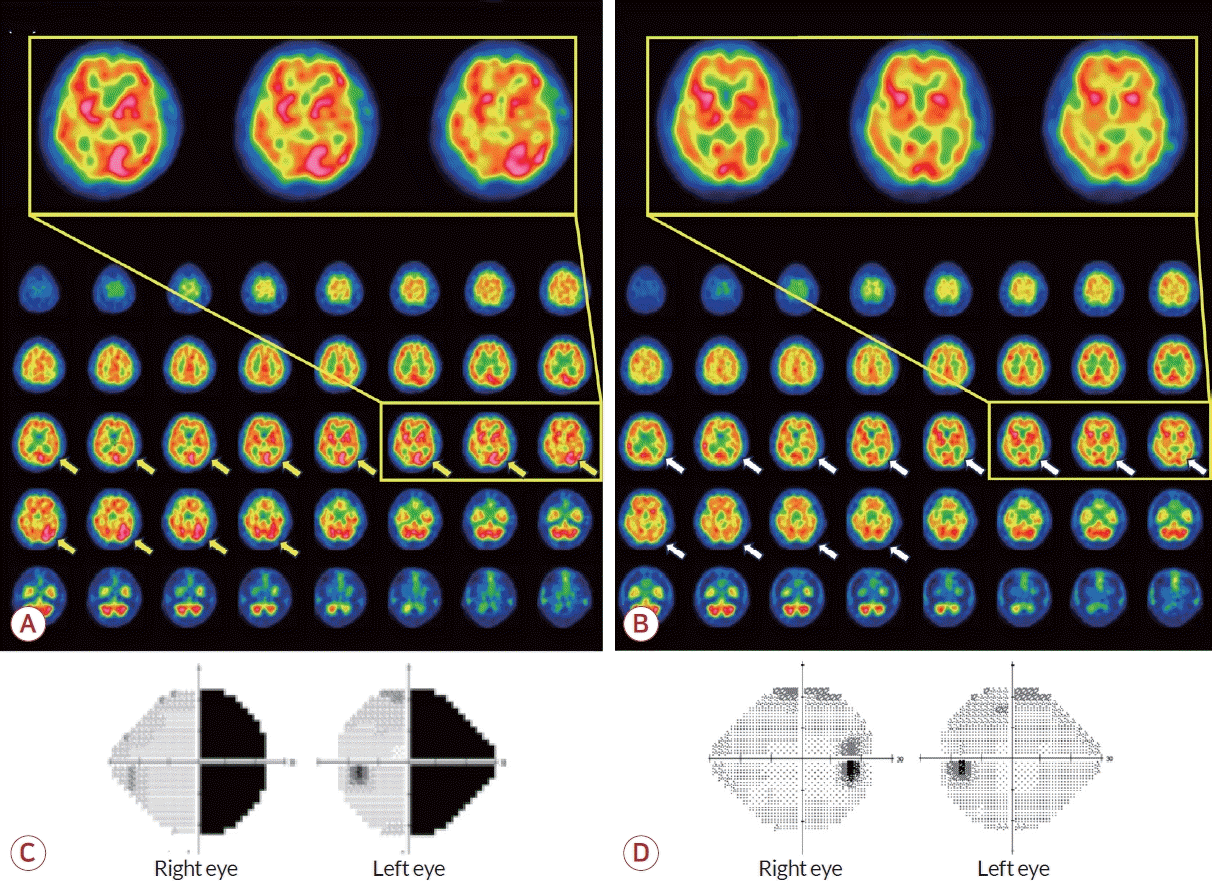
(A) Brain SPECT shows hyperperfusion (yellow arrows) in the left occipital lobe at 13 days after symptom onset, (B) which normalized (white arrows) at 23 days after symptom onset. Perimetry demonstrated (C) right homonymous hemianopsia at 10 days after symptom onset, (D) which improved at 23 days after symptom onset. SPECT; single-photon emission computed tomography.
고 찰
본 증례의 환자는 우측 동측반맹으로 내원하였다. 내원 당시 고혈당 상태였고 입원 후 시행한 뇌 자기공명영상에서 좌측 후두부 T2강조영상과 FLAIR에서 저신호강도를 보이고 뇌 단일광자방출컴퓨터단층촬영술에서 국소적인 과관류가 관찰되었다. 또한 적극적인 혈당 조절 후 임상 증상 및 뇌영상 소견이 호전되었다.
동측반맹의 경우 가장 많은 원인으로 뇌졸중이 있으며 후두엽에 병변이 있는 경우가 가장 흔하다. 뇌의 구조적 병변 이외에도 발작이 흔한 원인인데 본 증례에서 환자는 우측반맹이 있으나 뇌 자기공명영상에서 뇌졸중, 뇌종양은 없었으며 뇌파 검사상 발작의 근거는 없었다.
본 증례의 뇌 자기공명영상상 뇌경색을 시사하는 제한된 확산은 관찰되지 않았고 T2강조영상과 FLAIR에서 저신호강도가 관찰되었다. 부분 발작의 전형적인 소견은 T2강조영상과 FLAIR에서 관찰되는 회색질과 피질하백색질에 고신호강도이다. 본 증례와 같이 뇌 자기공명영상상 T2강조영상과 FLAIR에서 저신호강도를 보일 수 있는 급성 원인으로 바이러스뇌염, 뇌수막염, 연수막 전이, 출혈성경색, 저산소뇌 병변 등이 알려져 있으나[3] 본 증례의 경우 뇌 자기공명영상에서 연수막 조영증강이 없고 뇌척수액 세포 검사에서 이상이 없으며, 저산소 상태를 유발할 만한 병력이 없었고 뇌 자기공명영상상 저산소 뇌 병변을 시사하지 않았다.
이전 보고들을 보면 고혈당 상태에서 동측반맹을 보이는 경우 발작을 동반하며 국소적으로 과관류가 관찰되었으나 본 증례의 경우에는 고혈당 상태로 진단하였으나 발작의 근거 없이 뇌 단일광자방출컴퓨터단층촬영술에서 국소적인 과관류를 보였다. 뇌 단일광자방출컴퓨터단층촬영술에서 국소적으로 과관류를 보일 수 있는 질환으로는 편두통, 염증, 감염, 발작, 종양, 혈관 기형 등이 있지만[4] 뇌 자기공명영상, 뇌파 검사, 뇌척수액 검사 등으로 배제할 수 있었다.
고혈당이 있는 환자에서 뇌혈류가 증가한다는 연구가 소개되었는데 당뇨 환자에서 혈당이 높을 때와 정상일 때 두개 경유 도플러를 이용하여 혈류 속도를 측정하였고 고혈당인 상태에서의 뇌혈류는 혈당이 정상화되었을 때보다 높았다[5]. 이를 두 가지 기전으로 설명할 수 있는데 첫째, 고혈당증은 산화질소 생산을 감소시켜서 혈관 확장을 감소시키며 동시에 프로스타글랜딘과 에이코사노이드의 분비가 증가하여 혈관이 수축하고 이로 인해 혈관의 혈류 속도가 증가하게 된다. 둘째, 고혈당증으로 혈장 삼투압 농도가 증가하여 혈량과다증이 나타나 혈류 속도가 증가할 수 있다.
본 증례처럼 후백질뇌병증증후군도 후두엽에 영향을 미치는데, 이는 자율신경기능장애에 기인한다. 교감신경 분포는 혈압 증가에 반응하여 대뇌혈관 긴장도를 증가시키는데 후방 순환의 덜 풍부한 교감신경 분포는 후방 우세를 초래한다[6]. 또한 당뇨병 환자는 교감 신경의 자율신경기능장애 및 내피기능장애 때문에 자가조절 위험이 있을 수 있다[7]. 따라서 중증 고혈당증 환자에서 시각장애의 기본 기전은 후방 순환의 자동조절장애에 기인할 수 있다.
고혈당증으로 인해 발작, 의식 저하 등이 발생함은 널리 알려져 있으나 다른 증상 없이 동측반맹만 보이는 보고는 드물다. 고혈당 상태에서 발작의 근거 없이 동측반맹이 발생하는 병인은 현재 명확히 알려져 있지 않으나 고혈당증으로 인한 고삼투압 농도로 아교세포의 탈수가 일어나 동측반맹이 나타날 수 있다는 가설이 있다[8]. 다만, 본 환자의 경우 증상이 있을 때 시행한 뇌파 검사에서 발작의 근거는 없었으나 확실한 발작의 배제를 위해 24시간 뇌파 검사를 시행하지 못한 것은 제한점으로 남아 있다.
문헌 고찰을 통해 동측반맹을 주소로 내원한 환자 중 본 증례의 환자와 같이 고혈당이 있으며 뇌파 검사상 정상인 환자들을 확인하였다(Table 1) [1,9,10]. 본 증례의 환자를 포함하여 4명의 환자가 확인되었으며 성별은 모두 남성이었고 뇌 자기공명영상의 FLAIR에서 3명의 환자에서 저신호강도가 확인되었으며 2명의 환자의 뇌 단일광자방출컴퓨터단층촬영술에서 과관류를 보였다.

Clinical, laboratory, brain MRI, and brain SPECT findings of hyperglycemic homonymous hemianopia patients with normal EEG
본 증례와 다르게 고혈당증에 의한 비가역적 신경 손상을 받은 증례 보고에 따르면 1달 전 발생한 동측반맹을 주소로 내원한 고혈당증이 있는 환자에서 처음 당뇨를 진단하고 입원 직후 시행한 뇌 단일광자방출컴퓨터단층촬영술에서 과관류를 보였으며 인슐린으로 당뇨 치료를 하였으나 증상의 호전은 없었고, 증상 발생 3개월 후에 시행한 뇌 단일광자방출컴퓨터 단층촬영술에서는 뇌저관류를 보이고 지속적으로 증상은 호전되지 않았다[1]. 이 증례의 경우 증상 호전이 없었던 이유는 증상 발현 1달 후에 고혈당증을 확인하였고 이로 인해 1달 동안 지속적인 뇌과관류와 치료하지 않은 고혈당 상태 때문이라고 생각된다. 본 증례처럼 빠르게 고혈당증에 대한 치료를 할 경우 증상이 호전되며 뇌관류가 정상화될 수 있으므로 각별한 주의가 필요하다. 하지만 아직까지 심한 고혈당증에서 발생하는 신경학적 결손과 뇌과관류 사이의 연관성은 완전히 밝혀지지 않았다. 한 연구에서는 CO2를 이용한 두개 경유 이중 초음파 검사에서 혈관 운동 반응성이 고혈당반맹 환자에서 감소했다고 보고하였다[3].
저자들은 본 증례를 통해 동측반맹이 있는 환자에서 고혈당증이 있는 경우 이로 인한 증상일 수 있음을 간과하지 말아야 하며, 적극적이고 빠른 혈당 조절과 적절한 수분 공급이 증상의 회복과 뇌관류의 정상화에 중요함을 강조하는 바이다.