COVID-19 감염 후 발생한 시신경척수염범주질환
Neuromyelitis Optica Spectrum Disorder after COVID-19 Infection
Article information
Trans Abstract
Coronavirus disease-19 (COVID-19) infection may be accompanied by various neurological complications. Among them, demyelinating disease involving the central nervous system has rarely been reported in association with COVID-19 infection. Herein, we report a case of newly diagnosed neuromyelitis optica spectrum disorder (NMOSD) right after COVID-19 infection. From our case, autoimmunity induced by para- and post-infectious immunologic responses or direct viral invasion might contribute to the development of NMOSD.
Coronavirus disease-19 (COVID-19) 바이러스는 신경 친화 바이러스로, 바이러스 감염이나 백신 접종과 관련하여 후각 상실, 기앵-바레증후군과 같은 말초신경계질환에서부터 뇌수막염, 뇌혈관질환과 같은 중추신경계질환까지 다양한 신경계 합병증이 보고되었다[1]. 그중 중 추신경계를 침범하는 탈수초질환인 시신경척수염범주질환(neuromyelitis optica spectrum disorder, NMOSD)이나 다발경화증(multiple sclerosis, MS) 등도 드물게 발생할 수 있다고 알려져 있으나, 국내에는 아직 보고된 바가 없다[2,3]. 이에 본 저자들은 COVID-19로 진단되어 자가 격리 중 새로이 진단된 혈청항아쿠아포린-4 (anti-aquaporin-4, 항AQP4)항체 양성인 NMOSD 증례를 경험하여 가능한 기전과 함께 보고하고자 한다.
증 례
기저질환 없이 건강했던 50세 여자가 3일 전부터 두통이 발생하여 본원 응급실을 방문하였다. 환자는 과거력에서 특별한 부작용 없이 3회 COVID-19 백신 접종을 완료한 상태였으나, 병원 방문 5일 전부터 발열, 인후통 등의 증상이 있었고, 코인두 면봉 채취 후 중합효소사슬반응(polymerase chain reaction, PCR) 검사를 통해 COVID-19 감염으로 확진되어 자가 격리 중이었다. 응급실 진찰 시 발열이나 호흡기 증상은 저명하지 않았으나, 구역을 동반하는 머리 전체가 지거리는 양상의 중등도 이상 강도의 두통을 호소하였고, 목경 축이 확인되었다. 신경계진찰에서는 조음장애, 우측 사지 실조와 보행 실조를 확인하였다. 뇌 자기공명영상(magnetic resonance imaging, MRI)에서는 T2강조영상에서 왼쪽 속섬유막뒷다리(posterior limb of the internal capsule)와 대뇌다리(cerebral peduncle)를 침범하는 고신호강도 병터가 확인되었고, 해당 병터는 조영증강이 되지 않았다(Fig. 1). 그 외 뇌수막의 비정상 조영증강 등은 없었으며, 뇌 자기공명혈관영상에서도 이상은 없었다. 뇌척수액 검사에서 개방 압력은 15 cmH2O로 정상이었으나, 뇌척수액세포증가증(백혈구 427개/mm3, 림프구 비율 60.2%)과 단백질 증가(117 mg/dL)를 보였고, 혈액과 뇌척수액 포도당 비율은 0.5로 정상이었으며 세포 진단 검사에서 악성세포는 없었다. 그 외 전혈구계산, 간-신장기능, 전해질 등 기본적인 혈액 검사와 적혈구침강속도(erythrocyte sedimentation rate), C-반응단백질(C-reactive protein)과 같은 염증반응 관련 수치도 모두 정상이었다. 원인균 검출을 위해 시행한 세균 배양 검사, 바이러스 PCR 검사 결과는 모두 음성이었고, 뇌척수액을 이용한 COVID-19 PCR 검사 결과도 음성이었다. 뇌척수액 검사 결과 및 뇌 MRI 결과를 바탕으로, 바이러스뇌염에 준하여 경험적으로 정맥 내 항바이러스제(acyclovir, 10 mg/kg, 3회/day) 및 정맥 내 고용량 스테로이드(methylprednisolone, 1 g/day) 치료를 시작하였다. 한편 환자는 호흡 곤란과 같은 호흡기 증상이나 산소포화도 감소가 없어 COVID-19 감염과 관련하여 렘데시비르(remdesivir) 등은 사용하지 않았다.
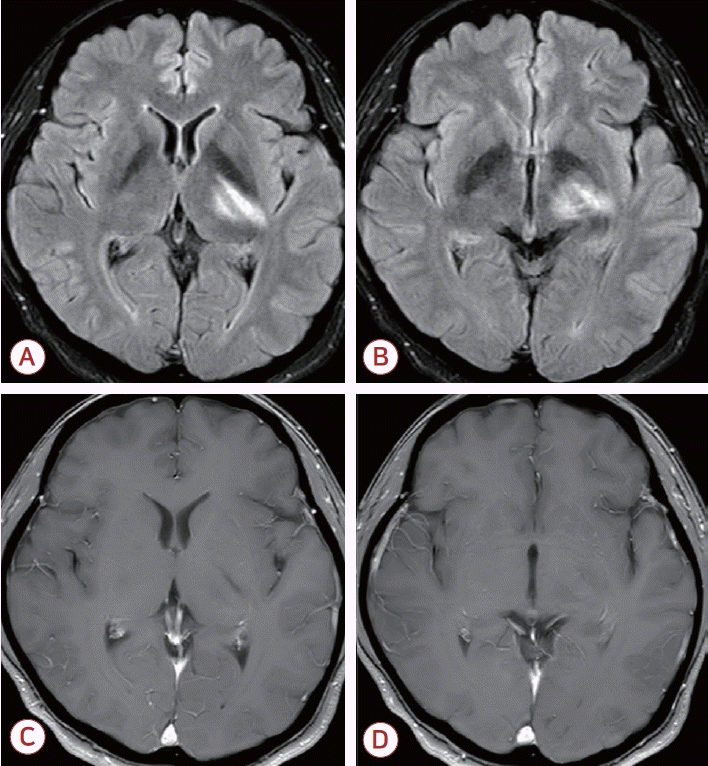
Initial brain magnetic resonance imaging of the patient. (A, B) Fluid attenuated inversion recovery images demonstrate high signal intensities in the left posterior limb of the internal capsule and the cerebral peduncle. (C, D) Gadolinium-enhanced axial T1-weighted images demonstrate no abnormal enhancement.
입원 4일째, 환자는 배뇨장애와 사지마비를 새로이 호소하여 척추 MRI 검사를 하였고, T2강조영상에서 4번부터 6번 경추 분절 부위의 경수(cervical cord)와 3번부터 10번 흉추 분절 부위의 흉수(thoracic cord)를 침범하는 다발 고신호강도 병터가 확인되어 긴광범위횡단척수염(longitudinally extensive transverse myelitis, LETM)으로 진단하였다(Fig. 2). 중추신경계 탈수초질환이 의심되어 추가로 한 검사에서 항AQP4항체가 양성(2+)으로 확인되었다. 그 외 항수초희소돌기아교세포당단백질(myelin oligodendrocyte glycoprotein, MOG)항체, 올리고클론띠(oligoclonal band)는 음성이었으며, 면역글로불린G 지수는 0.71 (참고치, <0.85)로 정상이었다. 또한 류마티스인자(rheumatoid factor), 항핵항체(anti-nuclear antibody), 항중성구세포질항체(anti-neutrophil cytoplasmic antibody)와 같은 자가면역질환과 관련된 인자들도 모두 음성이었다. 2015년 Wingerchuk 등이 제안한 NMOSD 진단 기준에 따라 핵심 임상 증상(core clinical characteristics)에 해당하는 LETM과 항AQP4항체 양성을 보였으므로 NMOSD로 진단할 수 있었다[4]. 환자는 재원 중 새로 발열이 생겨 시행한 제반 평가에서 요로감염이 의심되어 정맥 내 항생제를 투여하였기 때문에 NMOSD와 관련하여 정맥 내 면역글로불린 투여나 혈장 교환술 등은 하지 못하였고, 정맥 내 고용량 스테로이드 투여 후 경구용 스테로이드를 유지하면서 대부분의 증상들이 호전되어 퇴원하였다.
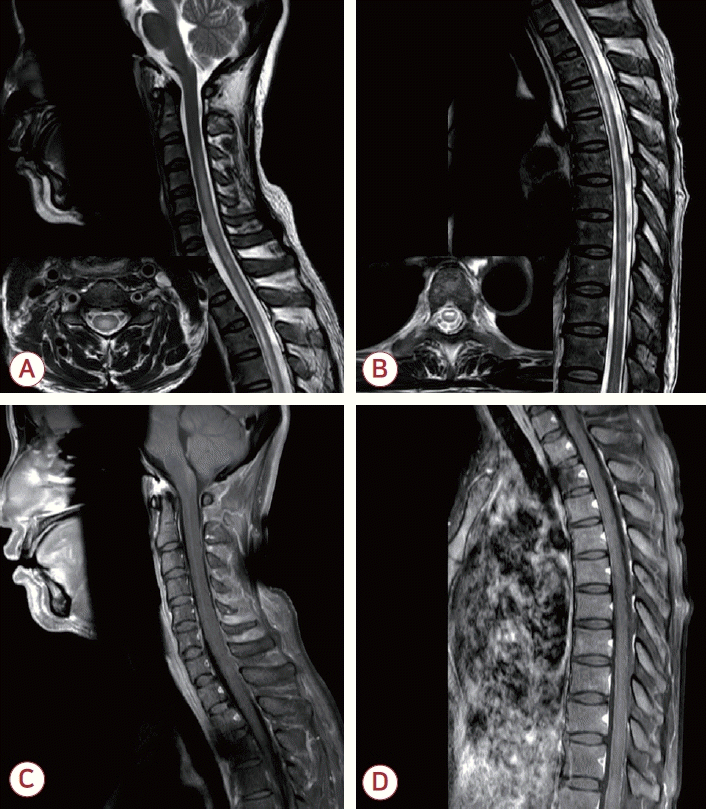
Spine magnetic resonance imaging of the patient. (A) Sagittal and axial T2-weighted images demonstrate high signal intensities in the cervical spinal cord from C4 to C6 vertebral segments, which predominantly involves the central gray matter of the cervical spinal cord. (B) Also, linear patchy high signal intensities are documented in the anterior aspect of the thoracic spinal cord from T3 to T10 vertebral segments. (C, D) Gadolinium-enhanced sagittal T1-weighted images demonstrate no abnormal enhancement.
퇴원 후 3개월째, 환자는 양안 수평복시, 졸음(somnolence) 등의 증상이 있어 시행한 뇌 MRI에서 유두체(mammillary body), 시상하부(hypothalamus) 등에 새로운 다발 고신호강도 병터가 확인되었다(Fig. 3-A, B). 당시 추적한 뇌척수액 검사에서 약간의 세포증가증(백혈구 19개/mm3, 림프구 비율 94.7%)과 단백질 증가(51 mg/dL)를 보였고, 혈청항AQP4항체는 여전히 양성(3+)이었으며 항MOG항체는 음성 을 보였다. 혈청 싸이아민(thiamine) 수치는 정상이었고, 영양 결핍 등의 병력이 없어 베르니케뇌병증보다는 NMOSD 재발로 생각되어 정맥 내 고용량 스테로이드 치료를 하였고 증상은 모두 호전되었다. 그러나 다시 3개월이 지난 시점에 환자는 조음장애가 발생하였고, 뇌 MRI 추적검사에서 중간소뇌다리(middle cerebellar peduncle), 뇌들보(corpus callosum) 등을 침범하는 다발 고신호강도 병터가 추가로 확인되었다(Fig. 3-C, D). 이 당시에도 추적한 혈청 항AQP4항체는 양성(3+)이었다. 정맥 내 고용량 스테로이드 치료 후 증상은 모두 호전되었지만 재발 방지를 위해 리툭시맙(rituximab)을 도입하였다. 이후 현재까지 6개월간의 추적 기간 동안 더 이상의 재발은 없었고, 경미한 우측 하지 쇠약과 저림 증세 외에 심각한 신경계 후유증 없이 외래 추적 관찰 중이다.
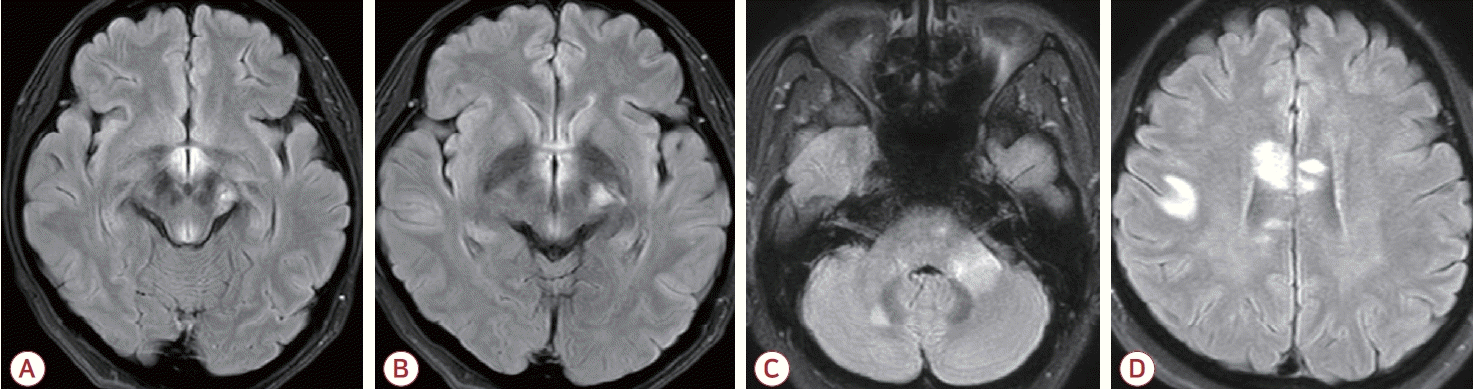
Follow-up brain magnetic resonance imaging of the patient. (A, B) FLAIR images taken 3 months after the initial hospitalization (1st recurrence) show newly developed high signal intensities involving the mammillary body, tuber cinereum, hypothalamus, and periaqueductal gray matter, along with high signal intensities in the left cerebral peduncle with a decreased extent when compared to the initial image from Fig. 1. (C, D) During the 2nd recurrence (6 months after the initial hospitalization), FLAIR images show another newly developed high signal intensities involving the right cerebellum, left middle cerebellar peduncle, corpus callosum, and subcortical white matter. FLAIR, fluid attenuated inversion recovery.
고 찰
306명의 COVID-19 감염 환자를 대상으로 한 국내 연구에 따르면, 약 60.8%에 달하는 높은 비율의 환자에서 신경계 증상을 보였고, 두통, 후각 및 미각 손상 등이 흔하였다[5]. 신경학적 결손은 주로 COVID-19 감염 초기에 나타났으며, 중추신경계 합병증으로 생각해 볼 수 있는 뇌졸중, 발작 및 의식 장애는 드물지만 중증 감염 환자에서 주로 발생한 것으로 확인되었다[5]. COVID-19 감염과 관련된 중추신경계 합병증 중에서 면역 기전과 관련된 것으로는 자가면역뇌염, 뇌병증(encephalopathy), 혈관염 그리고 NMOSD나 급성 파종뇌척수염(acute disseminated encephalomyelitis)과 같은 탈수초질환 등이 알려져 있는데, 국내에서는 탈수초질환의 경우 COVID-19 감염 이후 발생한 한눈시신경염 증례가 보고된 것 외에 재발성 질환인 MS나 NMOSD 등과 관련된 보고는 확인할 수 없었다[6,7].
COVID-19 바이러스는 시냅스경유(trans-synaptic) 경로를 이용하여 후각망울(olfactory bulb)을 통해 혈액뇌장벽(blood-brain barrier)을 통과함으로써 중추신경계를 침범하고 여러 가지 합병증을 일으킬 수 있다고 알려져 있다[3,6]. 손상 기전으로는 바이러스의 직접적인 침범으로 인해 발생하는 세포 손상과 염증세포 침윤 또는 바이러스가 면역 체계를 과활성화시킴으로써 사이토카인과 같은 염증 매개 물질이 과분비되고, 이들이 신경염증을 일으키거나 혈액뇌장벽을 손상시킴으로써 이차적인 신경 손상을 유발할 수 있음이 제시되었다[6]. COVID-19 감염 후 발생하는 중추신경계 합병증에서 대부분 뇌척수액 내 COVID-19 PCR이 음성인 점, COVID-19 감염으로부터 합병증 발생까지 대부분 수일에서 수주의 시간 간격이 존재하는 점, 그리고 스테로이드나 면역글로불린과 같은 치료에 반응이 좋은 점 등을 바탕으로 직접적인 바이러스 침범보다는 바이러스 감염 후 면역 매개 손상이 그 기전으로서 좀 더 우세하지만, 이에 대해서는 추가적인 대규모 연구가 필요하다[3,6,8].
한편, COVID-19 감염 후 발생하는 중추신경계 탈수초질환을 설명하는 기전으로는 COVID-19 감염이 수초특이 T세포(myelin-specific T cell)를 활성화시키는 면역반응의 유도, MS와 같은 중추신경계 탈수초질환의 발병 기전과 연관이 있다고, 특히, 알려진 interleukin (IL)-6, IL-17과 같은 사이토카인의 증가, 패턴인식수용체(pattern recognition receptor)로 작용하여 선천면역을 활성화함으로써 MS와 COVID-19 감염의 발병 기전에서 모두 중요한 역할을 할 것으로 생각되는 톨유사수용체(toll-like receptor)에 의해 별아교세포(astrocyte)와 미세아교세포(microglia)의 활성화, COVID-19 감염에 의한 선천면역의 과활성화와 면역조절장애(immune dysregulation)가 발생하면서 수초에 대한 항체 생성 등이 제시되었다[3,8].
COVID-19 감염 이후 진단된 11명의 NMOSD 증례들을 분석한 과거 문헌 고찰 연구에 따르면, 대개 COVID-19 감염 후 5-14일 정도 간격을 두고 시력 저하, 감각 이상 등의 NMOSD를 시사하는 증상이 발현되었으며, 4명의 환자에서 10-27개의 뇌척수액 세포증가증이 확인되었다[3]. 6명의 환자에서 항AQP4항체 양성을 보였지만, 뇌척수액 COVID-19 PCR에서 양성을 보인 경우는 없었다.3 그리고 대부분 스테로이드, 면역글로불린, 혈장교환술, 면역억제제, 리툭시맙과 같은 치료에 좋은 예후를 보였다(10명 중 8명, 80%) [3].
본 증례는 일반적인 중추신경계 탈수초질환이나 과거 보고 된 COVID-19 감염 후 발생한 NMOSD 증례들에 비해 뚜렷한 뇌척수액 세포증가증을 보였다(백혈구 427개/mm3) [3]. 이는 비록 뇌척수액 COVID-19 PCR에서 음성을 보였으나, 두통과 목경축 등의 전형적인 뇌수막염 증상을 보인 점, COVID-19 감염 확진 후 자가 격리 중에 증상이 발생한 점(짧은 시간 간격)을 함께 고려할 때, 본 환자의 경우 COVID-19 바이러스의 직접적인 중추신경계 침범이 뇌수막염 및 NMOSD의 발병에 영향을 미쳤을 가능성이 있는 것으로 추측되며, 이를 검증하기 위한 후속 연구가 필요하겠다.
최근 COVID-19 감염의 유행이 소강 상태에 접어들고 있다고는 하나, 여전히 하루 1만 명 이상의 새로운 확진자가 나오고 있으며, 그중 신경계 증상을 호소하는 환자도 속출하고 있다. 따라서 의료진이 COVID-19 감염으로 인한 다양한 신경계 합병증을 인지하고, 환자가 호소하는 증상에 대해 면밀한 평가를 통해 조기에 진단하고 치료하는 것이 환자의 예후에 있어 무엇보다 중요하겠다.