무도증은 지속적, 불규칙적, 비정형화된 이상운동증상으로, 뇌혈관질환, 대사, 퇴행성 뇌질환, 감염, 독성, 면역이상에 의해 발생할 수 있다[1]. 비케토산고혈당 상태에서 나타나는 무도증은 주로 편측에 증상이 나타나고 뇌 컴퓨터단층촬영(computed tomography, CT)에서는 반대쪽 바닥핵에 고음영, 뇌 자기공명영상(magnetic resonance imaging, MRI)에서는 T1강조영상에서 고신호, T2강조 영상에서 저신호가 관찰된다. 또한 18F-불소탈산소포도당양전자단층촬영( 18 F-fluorodeoxyglucose positron emission tomography, 18F-FDGPET) 검사에서 같은 부위에 포도당 대사저하 소견이 관찰되기도 한다[2].
본 증례는 당뇨병 환자에서 편측 상하지에 무도증이 발생하고, 증상 발생 3일째에 시행한 18F-FDG PET검사에서 바닥핵에 대사 저하를 보이나 뇌 MRI 및 CT에서 정상 소견을 보인 비케토산고혈당 환자를 경험하였기에 보고한다.
증 례
89세 남자가 2일 전부터 갑자기 발생한 왼쪽 팔다리에 불수의적인 이상운동으로 응급실 통해 내원하였다. 불수의운동은 왼쪽 팔다리에 손목, 팔꿈치, 어깨, 허벅지, 무릎관절을 불규칙적으로 구부렸다 폈다를 반복하고 휘젓는듯한 모습이 반복되었다. 오른쪽 팔다리에서는 이상운동 증상이 관찰되지 않았다. 수면 시에는 증상이 소실되었으나 스스로 멈추려고 해도 지속되었다. 환자는 고혈압, 당뇨병을 20년 전에 진단받고 약물 치료 중이었다. 환자는 위장관운동개선제, 향정신약물, 항경련제 등의 약물은 복용하지 않고 있었다. 최근 당뇨약은 잘 복용하였으며 식습관, 신체기능에 변화는 없었으나 혈액검사를 시행한지 매우 오래되었다고 하였다.
내원 당시 혈당(마지막 식사 후 3시간 경과)은 630 mg/dL였고, 당화혈색소는 11.9%였다. 혈액요소질소는 26.1 mg/dL, 크레아티닌은 1.75 mg/dL로 신장기능저하가 확인되었다. 전해질, 갑상샘기능검사, 간기능검사는 정상이었으며, 소변검사에서 케톤체는 검출되지 않았다. 신경계진찰에서 의식은 명료하였으며 뇌 신경검사, 운동 및 감각기능검사는 정상이었으며, 병적반사는 없었다.
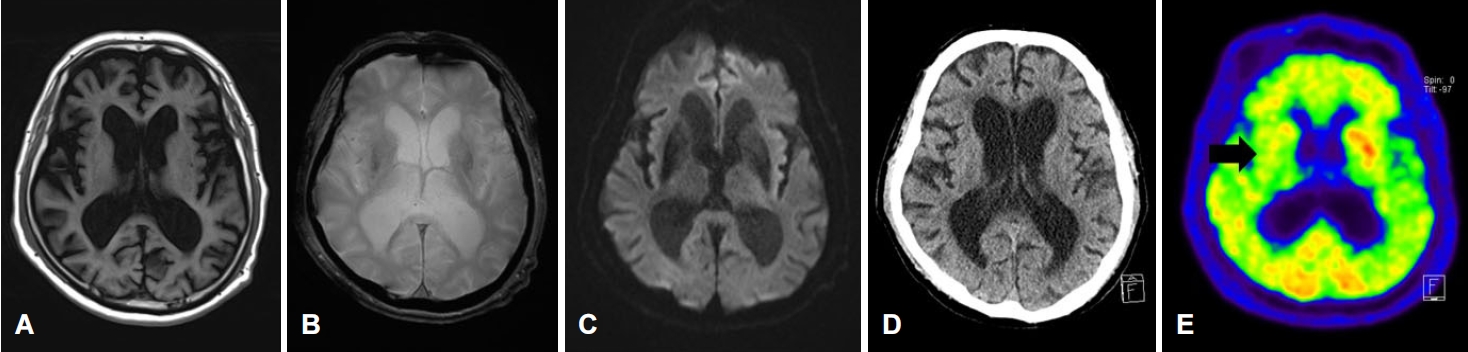
증상 발생 2일째에 시행한 뇌 CT에서 바닥핵에 변화를 보이지 않았으며, MRI에서 T1, T2강조영상, 경사에코영상(gradient echo imaging, GRE)에서 바닥핵에 동신호강도, 확산강조영상(diffusion weighted imaging, DWI)영상에서 바닥핵에 저신호강도가 확인되었다(Fig. A-D). 뇌 자기공명혈관영상에서 뇌내동맥에 협착, 폐색, 동맥류 소견은 관찰되지 않았다. 증상 발생 3일째에 시행한 18F-FDG PET에서 오른쪽 바닥핵에서 포도당 대사의 감소가 관찰되었다(Fig. E).
환자는 입원 후 혈당 조절을 위해 인슐린을 피하주사하였고 할로페리돌 4 mg을 투약 후 증상 12시간 내에 증상이 모두 소실되었다. 이후 당뇨약을 증량하여 혈당을 160-220 mg/dL로 유지하였고 1년 동안 재발없이 생활하고 있다.
고 찰
본 증례는 고혈당 상태에서 갑자기 왼쪽 상하지에 무도증이 발생하였고, 혈당 조절 후 증상이 소실된 점으로 보아 임상적으로 비케토산고혈당무도증으로 진단할 수 있다. 비케토산고혈당 상태에서 뇌조직은 무산소대사를 통해 에너지를 얻게 되는데, 이때 뇌 세포의 주요 에너지원은 gamma-aminobutyric acid (GABA)로, 비케토산상태에서는 케톤체의 부족으로 GABA가 빠르게 소비된다. GABA의 결핍으로 인해 운동 조절의 간접경로인 시상하핵에 대한 억제가 증가하고, 선조체(striatum)로부터 창백핵으로 가는 억제력의 감소로 인해 무도증이 나타나는 것으로 설명된다[3].
비케토산고혈당무도증에 대한 이전 보고에서는 대부분 뇌 영상 검사에서 바닥핵 부위에 특징적인 신호 변화를 동반하였다. 뇌 MRI 소견은 증상의 반대측 바닥핵에 T1강조영상과 확산강조영상에서 고신호강도가 관찰되거나 GRE에서 점상출혈이 확인되었다[4]. 18 F-FDG PET에서는 꼬리핵의 포도당 대사의 증가와 증상소실 후 바닥핵의 포도당 대사의 감소를 보였다[5]. 이에 대한 병태생리학적인 여러 기전이 추측되는데 뇌허혈, 출혈손상, 도파민 가설이 주 원인이 된다. 뇌허혈 가설은 고혈당에서 혈액 과점도(blood hyperviscosity) 에 의한 혈류의 흐름의 저하로 세포독성 뇌부종이 일어나 T1강조영상에서 고신호강도를 보이고 DWI에서는 고신호, 겉보기확산계수영상에서 저신호 강도를 보이는 이유를 설명한다[6]. 출혈손상이 원인이라는 주장은 혐기성 경로에 의한 산증으로 혈관내피세포가 손상되어 바닥핵에 점상출혈이 생겨 GRE에서 저음영으로 나타나는 것인데 사후부검에서 혈철소(hemosiderin) 침착에 대한 증거가 부족하여 모든 기전을 설명하기는 어렵다[4].
도파민 가설은 혈당 대사의 이상이 도파민을 증가시켜 바닥핵신경루프의 직접회로를 증가시키고, 간접회로의 억제효과를 약화시킨다. 선조체의 도파민 활성도가 변하면 도파민수용체가 상향 조절되어 도파민의 이화 대사가 줄어든다[7]. 이 가설은 증례 환자에서처럼 인슐린과 도파민수용체 길항제인 할로페리돌을 투약했을 때 증상의 호전을 보이는 현상을 뒷받침한다.
과거 문헌에서 보고한 비케토산고혈당무도증 환자들의 뇌 MRI 소견은 T1강조영상과 DWI에서 바닥핵 부위의 고신호강도 병변을 동반하는데, 이는 저관류에 의한 세포독성부종에 따른 것으로 뇌허혈의 가능성을 높게 보았다[3]. 그러나 본 증례에서는 뇌 MRI T1 강조영상과 GRE에서 모두 바닥핵의 동음영, 동신호 소견을 보였으며, 18 F-FDG PET에서는 오른쪽 바닥핵 중 선조체에 포도당 대사의 감소가 확인되었다. 이는 비케토산고혈당무도증이 뇌허혈과 출혈 손상에 의해 생긴 것이 아니라 도파민 활성도의 변화에 의해 생겼을 가능성을 고려해 볼 수 있다. 도파민은 당대사를 촉진하므로 처음 증상이 있을 때 18F-FDG PET에서 바닥핵의 포도당 대사가 활성화되었다가 증례 환자처럼 증상이 조절된 후에는 신경손상에 의한 포도당 대사가 감소할 수 있다[8]. 따라서 뇌 MRI에서 바닥핵의 변화가 보이지 않더라도 고혈당과 관련된 무도증이 나타날 수 있으므로 18F-FDG PET시행이 무도증의 발생기전을 이해하는 데 도움이 될 수 있다. 또한 비케토산고혈당무도증의 원인이 뇌허혈과 출혈손상에 의한 혈류 변화보다 도파민 과활성화가 발병기전에 크게 관여할 수 있음을 시사한다.
결론적으로, 비케토산고혈당 무도증에서는 뇌 MRI나 CT에서 특징적인 변화 없이 18F-FDG PET에서 바닥핵에 대사이상만이 나타날 수 있으므로 18F-FDG PET를 시행하는 것이 조기진단과 감별 진단에 도움이 될 수 있다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




