| J Korean Neurol Assoc > Volume 40(4); 2022 > Article |
|
Abstract
Cerebral hyperperfusion syndrome is a rare but serious complication of carotid revascularization, and characterized by ipsilateral headache, hypertension, seizures, and focal neurological deficits. Therefore, treatment strategies are directed towards regulation of blood pressure and limitation of rises in cerebral perfusion to prevent cerebral edema or hemorrhage, especially during several days after carotid endarterctomy or stenting. We report the unique case of a patient who suffered from contralateral cortical subarachnoid hemorrhage after carotid artery stenting, despite of well-controlled blood pressure.
경동맥 혈관재개통술의 중요한 합병증인 과관류증후군은 두통, 발작, 국소신경계증상뿐만 아니라 뇌내출혈, 거미막밑출혈 등을 유발할 수 있으며 자동 조절능력이 저하된 혈관에서 혈류가 급격히 증가함으로 인해 발생한다[1]. 과관류증후군은 대부분 경동맥스텐트 삽입술 동측에서 첫 수일 이내에 발생하며, 혈관재개통술을 시행한 반대편 대뇌반구에서 발생하는 것은 드물다[2,3]. 저자들은 양측 경동맥협착이 있던 환자에서 혈압 조절이 잘 되었음에도 불구하고, 우측 경동맥스텐트삽입술 10일 이후 좌측에 대뇌피질부 거미막밑출혈이 발견된 환자를 경험하였기에 보고한다.
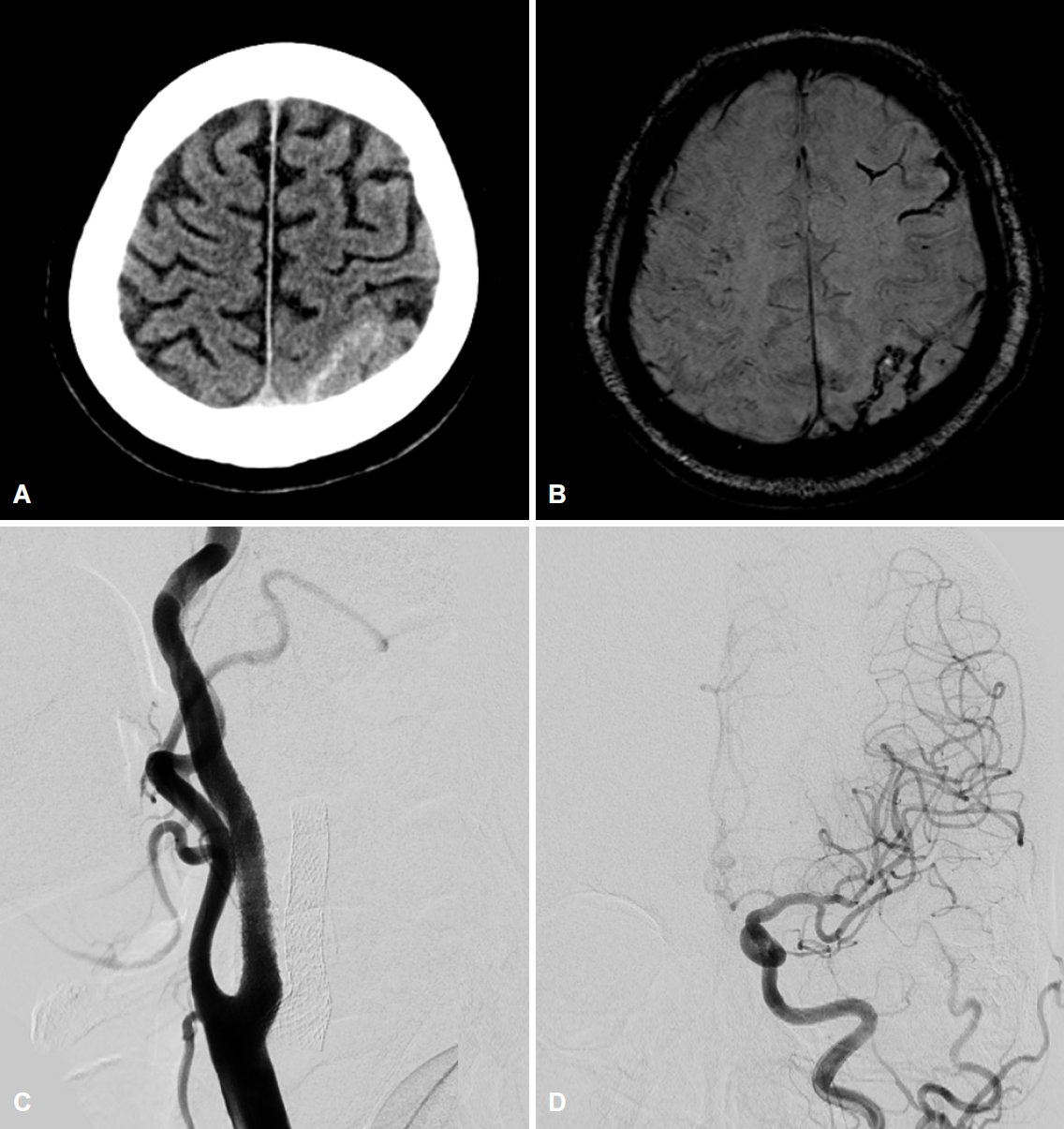
72세 남자가 12시간 전 발생한 구음장애, 좌측 안면마비와 근력 저하로 내원하였다. 고혈압, 당뇨병, 이상지질혈증으로 메트포민, 클로피도그렐, 로수바스타틴을 복용 중이었으며, 30갑년의 흡연자로 뇌졸중 과거력은 없었다. 초기 혈압은 140/110 mmHg, 맥박 84회/분, 호흡 20회/분, 체온 37.4도였다. 신경계진찰에서 의식은 명료하였고 경한 구음장애, 좌측 불완전 안면마비, Medical Research Council 4등급의 좌측 상하지 근력저하가 있었다. National Institutes of Health 뇌졸중척도는 5점이었다. 혈액검사에서 혈색소 15.0 g/dL, 혈소판 196,000/mm3, 활성화부분트롬보플라스틴시간은 29.3초(정상 22.7-30.3초), 프로트롬빈시간 국제정상화비율은 0.91 (정상 0.93-1.14), 총 콜레스테롤 146 mg/dL, 중성지방 153 mg/dL, 저밀도지질단백질은 86 mg/dL, C반응단백질 0.09 mg/dL, 혈당 128 mg/dL, 당화혈색소 6.6%였다. 뇌 확산강조영상에서 우측 중대뇌동맥 영역에 급성뇌경색이 있었고(Fig. 1-A), 액체감쇠역전회복영상에서 급성뇌경색 부위로 일부 고신호강도가 동반되었으며, 양측 대뇌반구에 고신호강도혈관현상이 관찰되었다(Fig. 1-B). 뇌혈관 자기공명영상에서 우측 내경동맥은 원위부 폐색이 의심되었고, 중대뇌동맥 혈류는 곁순환을 통해 유지되고 있으나 좌측에 비해 혈류가 감소되어 있었으며, 양측 내경동맥 근위부에는 심한 협착이 확인되었다(Fig. 1-C, D). 관류강조영상에서는 양측 전대뇌동맥과 중대뇌동맥 영역 전반에 뇌혈류의 감소가 확인되었다(Fig 1-E-H). 아스피린과 아토르바스타틴 40 mg을 추가한 후, 혈류에 대한 평가와 스텐트삽입술을 고려하여 뇌혈관 조영술을 시행하였다. 뇌혈관 조영검사에서 우측 내경동맥 근위부의 심한 협착이 확인되었으나, 폐색이 의심되었던 원위부는 속도가 저하된 앞방향혈류와 눈동맥을 통한 역방향혈류를 통해 유지되고 있었고, 연수막혈관을 통한 곁순환혈류와 함께 우측 중대뇌동맥의 혈류를 유지하고 있었으며, 전교통동맥 및 후교통동맥은 존재하지 않아 윌리스고리를 통한 곁순환은 관찰되지 않았다(Fig. 2-A, B). 좌측 내경동맥의 근위부에도 심한 협착과 앞방향혈류 속도의 지연이 관찰되었고, 좌측 중대뇌동맥과 전대뇌동맥은 눈동맥과 연수막혈관을 통한 곁순환을 통해 유지되고 있었다(Fig. 2-C, D). 우측 내경동맥 협착으로 인해 뇌경색이 진행할 위험성이 높아 풍선혈관성형술 및 스텐트삽입술을 진행하였다. 스텐트삽입술 이후 개선된 앞방향혈류를 통해 원위부 내경동맥과 우측 중대뇌동맥의 혈류량이 개선되었고, 시술 전에는 확인되지 않았던 전교통동맥을 통한 좌측 전대뇌동맥과 일부 중대뇌동맥으로 향하는 보조적인 혈류도 관찰되었다(Fig. 2-E, F). 반면 좌측 내경동맥혈류와 연수막혈관을 통한 곁순환혈류는 이전과 달리 중대뇌동맥에만 국한하여 혈류를 공급하는 소견이 관찰되었으며(Fig. 2-G), 여전히 후방순환계를 통한 보조혈류는 없었다(Fig. 2-H). 스텐트삽입술 직후 혈압은 수축기 100 mmHg, 이완기 60 mmHg 전후로 낮게 유지되었고, 이후에도 과관류증후군을 예방하기 위해 수축기혈압을 100-140 mmHg 사이로 안정적으로 유지하였다. 시술 직후 및 다음날 시행한 뇌 전산화단층촬영에서 뇌출혈 및 뇌부종은 없었고, 경미한 좌측 안면마비 외에는 모두 호전되었다. 심전도와 심초음파검사는 정상이었다. 증상 발생 7일 뒤 시행한 두개경 유도플러검사에서는 좌측 눈동맥의 혈류역전이 확인되어, 근위부내경동맥 협착으로 인한 뇌경색 발생 위험성이 여전히 높을 것으로 판단하여 스텐트삽입술을 계획하였다. 이후 스텐트 시술 전 추적 관찰 목적으로 증상 발생 10일째 시행한 전산화단층촬영에서 좌측 대뇌반구의 분수계영역의 두정엽고랑에서 거미막밑출혈을 의미하는 고음영이 확인되었고, 자화율강조 자기공명영상에서는 좌측 전두엽과 두정엽고랑에 걸쳐 피질 부위에 국한된 거미막밑출혈 소견이 확인되었다(Fig. 3-A, B). 환자는 두통, 발열, 외상이나 새로운 신경계증상은 없었고, 여전히 수축기혈압 100-120 mmHg가량으로 잘 유지되고 있었다. 거미막밑출혈을 유발할 수 있는 미세동맥류, 동정맥혈관기형, 가역적뇌혈관수축증후군 또는 뇌정맥혈전증 등을 감별하기 위해 시행한 뇌혈관 조영술에서 우측 내경동맥 스텐트 삽입 부위는 재협착이나 혈전 발생 없이 잘 유지되고 있었고, 좌측 내경동맥과 중대뇌동맥의 혈류 상태도 이전과 비교하여 변화가 없었으며, 거미막밑출혈을 유발할 수 있는 혈관 기형이나 손상도 관찰되지 않았다. 증상발생 22일째 시행한 전산화단층촬영에서는 거미막밑출혈이 감소된 소견이 확인되어, 다음날 좌측 내경동맥 근위부에 대해 풍선혈관성형술 및 스텐트삽입술을 시행하였으며(Fig. 3-C), 이후 개선된 전방혈류를 통해 이전과는 달리 좌측의 중대뇌동맥 및 전대뇌동맥을 포함한 혈류가 유지되는 형태로 혈류 순환이 변화하였다(Fig. 3-D). 환자는 새로운 신경계 증상이나 합병증 발생 없이 퇴원하였다.
본 증례는 양측 경동맥협착 환자에서 우측 경동맥 스텐트삽입술 10일 후 좌측 분수계영역에 과관류증후군에 해당하는 피질거미막밑출혈이 발생한 경우이다. 일반적인 과관류증후군과 달리 시술한 반대편 반구에 거미막밑출혈이 발생하였고, 전교통동맥, 후교통동맥이 없던 환자에서 발생하였다는 점에서 특이한 증례이다. 일반적으로 대뇌피질의 거미막밑출혈의 원인은 대뇌동맥류가 가장 흔하지만, 이외에도 외상, 동맥내막박리, 동정맥기형, 가역적뇌혈관수축증후군, 모야모야병, 뇌아밀로이드혈관병증, 심한 뇌혈관협착 등 다양한 혈관질환에 의하여도 생길 수 있다[4]. 증례 환자는 자기공명영상과 반복적인 뇌혈관 조영술을 통해 다른 원인은 배제할 수 있었다.
과관류증후군이 발생하는 기전은 확실하지 않으나 여러 가지 요인들이 작용하는 것으로 알려져 있다. 심한 경동맥협착에 의해 만성적인 뇌허혈이 지속되게 되면, 세동맥이 최대로 확장되게 되고, 대뇌혈관반응성이 저하되면서 대뇌 자동 조절능력이 손상된다. 경동맥재개통술 이후 갑작스런 뇌관류압이 증가하게 되면 국소적인 충혈 및 혈액뇌장벽의 손상이 발생하게 되어 두통, 발작, 뇌부종, 출혈, 국소신경계증상 등의 과관류증후군 증상이 발생하게 된다. 만성적인 고혈압은 혈관내피세포의 기능 이상, 신경근육조절능력 손상, 미세혈관병증, 자유라디칼 생성 등을 유발하여 과관류증후군이 일어나기 쉬운 환경을 만들게 된다. 또한 경동맥협착에 의해 압력수용기 기능 이상이 존재하는 상황에서 스텐트삽입술을 시행하면 반동고혈압, 혈압변동성증가를 초래하기 때문에 과관류증후군이 더 잘 일어나게 된다[5]. 이러한 기전으로 인한 과관류증후군은 경동맥협착 및 재개통술을 시행한 동측에 주로 발생하게 되는데, 이번 증례처럼 반대편에 발생하는 경우는 여러 가지 원인을 고려해볼 수 있다.
우선 전교통동맥이 새로 개통됨으로 인한 곁순환이 과관류증후군을 유발하였을 가능성이 있다. 대뇌혈관의 측부순환에 중요한 역할을 담당하는 것이 윌리스고리이다. 반대측 경동맥 폐색이 있는 경우에는 반대측 대뇌반구가 협착이 있는 경동맥의 혈류에 전적으로 의존하게 되므로 경동맥의 재개통술을 시행하면 전교통동맥으로 인한 곁순환으로 양측 또는 반대측 대뇌반구의 과관류증후군이 발생할 수 있다[2,6]. 본 증례는 처음 시행한 혈관조영술에서는 전교통동맥이 관찰되지 않아 좌우대뇌반구의 혈액공급이 완전히 분리된 상태였다. 그러나 우측 경동맥스텐트삽입술 이후 전교통동맥이 열리면서 좌측 전대뇌동맥의 혈류와 좌측 중대뇌동맥의 일부 혈류가 우측에서 공급되었다. 따라서 이로 인한 과관류증후군이 한 형태로 분수계영역에 피질거미막밑출혈이 발생하였을 수 있다. 두 번째로 연수막곁순환의 변화에 의해 발생하였을 가능성이 있다. 좌측에 비해 더 심한 우측 경동맥협착이 있고, 윌리스고리를 통한 곁순환이 없는 경우에는 연수막혈관을 통해 좌측 대뇌반구에서 우측 대뇌반구로 향하는 곁순환이 발달하게 된다. 경동맥스텐트삽입술 이후 우측의 뇌관류압이 증가하게 되면 좌측 대뇌반구에서 우측 대뇌반구로의 혈류공급이 필요하지 않게 되므로 우측으로 향하는 연수막곁순환이 감소하게 된다. 따라서 좌측대뇌반구의 혈류가 같이 증가하게 된다. 단일광자방출컴퓨터촬영을 이용하여 뇌혈류를 확인한 이전 연구에서 편측 경동맥협착만 있는 환자에서 스텐트삽입술을 시행하였을 때 전후교통동맥을 통한 곁순환 유무와 상관없이 반대측 대뇌반구의 혈류가 증가하는 것이 확인되었고, 연수막곁순환에 의한 결과임을 보여주였다[7].
과관류증후군을 예방하기 위해서는 철저한 혈압조절이 가장 중요하다. 일반적으로 경동맥스텐트삽입술 후에는 혈압을 140/90 mmHg 이하로 유지해야 하고, 과관류증후군의 고위험군인 경우에는 120/80 mgHg 이하로 조절하는 것이 도움이 된다고 알려져 있다[8]. 본 증례는 시술 이후 전산화단층촬영에서 특이 소견이 없었고 수축기혈압 120 mmHg 이하를 유지했음에도 불구하고, 10일 후 거미막밑출혈이 확인되었다. 이는 아마도 과관류증후군의 고위험 인자에 해당하는 90% 이상의 심한 협착, 반대편 혈관의 심한 협착, 고령, 불완전한 윌리스고리와 곁순환이 좋지 않은 점, 최근 뇌경색, 고혈압 병력 등이 있었기 때문이었을 것으로 판단한다[1,9]. 양측 대뇌반구에서 고신호강도 혈관현상이 관찰된 점은 심한 뇌혈관 협착과 뇌혈류 감소를 뒷받침하는 소견이다. 다만, 거미막밑출혈 양이 적었고, 신경계증상의 악화가 없었던 점은 적극적인 혈압 조절의 효과라고 생각한다. 본 환자는 혈류역학적으로 불안정하여 뇌경색 악화 가능성이 매우 높았고, 반대측 경동맥의 심한 협착이 있었기에 조기에 경동맥스텐트삽입술을 시행하였다. 그러나 과관류증후군을 예방하기 위해서는 초기에 풍선혈관성형술만을 시행하고, 단계적으로 수주 뒤 스텐트삽입술을 시행하는 것이 도움이 될 수 있다. 아직 단계적 스텐트삽입술의 표준 진료지침이 정립되지 않았으나 일과성허혈발작이나 뇌경색 발생을 증가시키지 않으면서 과관류증후군의 발생을 줄였다는 후향 연구 결과가 있으므로, 고위험군에서는 고려해볼 수 있겠다[10].
경동맥스텐트삽입술 후 발생하는 과관류증후군은 중요한 합병증이다. 과관류증후군의 발생 가능성이 높은 위험인자를 가진 환자들은 좀 더 장기간 철저한 혈압 조절이 필요하며, 적극적인 신경계진찰 및 영상검사를 통해 조기에 진단하는 것이 중요하다. 곁순환의 존재 유무 및 시술 후 곁순환의 변화로 인해 반대편 대뇌반구에도 과관류증후군이 발생할 수 있음을 고려해야 하겠다.
REFERENCES
2. Ullery BW, Kalapatapu V. Bilateral reperfusion injury after carotid endarterectomy with contralateral carotid occlusion. Vascular 2015;23:188-192.


3. Moulakakis KG, Mylonas SN, Sfyroeras GS, Andrikopoulos V. Hyperperfusion syndrome after carotid revascularization. J Vasc Surg 2009;49:1060-1068.


4. Spitzer C, Mull M, Rohde V, Kosinski CM. Non-traumatic cortical subarachnoid haemorrhage: diagnostic work-up and aetiological background. Neuroradiology 2005;47:525-531.


5. Farooq MU, Goshgarian C, Min J, Gorelick PB. Pathophysiology and management of reperfusion injury and hyperperfusion syndrome after carotid endarterectomy and carotid artery stenting. Exp Transl Stroke Med 2016;8:7.



6. Greenfield LJ Jr, Chimowitz MI, Quint DJ, Wakefield TW. Contralateral reperfusion injury after carotid endarterectomy. J Stroke Cerebrovasc Dis 1994;4:203-206.


7. Sadato A, Maeda S, Hayakawa M, Adachi K, Toyama H, Nakahara I, et al. Carotid stenting for unilateral stenosis can increase contralateral hemispheric cerebral blood flow. J Neurointerv Surg 2018;10:351-354.


8. Abou-Chebl A, Reginelli J, Bajzer CT, Yadav JS. Intensive treatment of hypertension decreases the risk of hyperperfusion and intracerebral hemorrhage following carotid artery stenting. Catheter Cardiovasc Interv 2007;69:690-696.


Figure 1.
Baseline brain magnetic resonance imaging. (A) Diffusion-weighted image (DWI) shows restricted diffusion with high signal intensity compatible with acute ischemic lesions at right middle cerebral artery (MCA) territory. (B) Fluid-attenuated inversion recovery image demonstrates high signal intensity lesions corresponding to DWI lesions and hyperintense vessels signs on bilateral hemispheres (arrowheads). (C, D) Time-of-flight magnetic resonance angiography (MRA) reveals decreased internal carotid artery (ICA) and right MCA flow, and contrast-enhanced MRA demonstrates near-occlusion of right ICA with severe stenosis of bilateral proximal ICAs (red arrows) (E, F) Perfusion-weighted images show delayed mean transit time (MTT) and time to peak (TTP) on bilateral anterior cerebral artery and MCA territory. (G, H) Cerebral blood flow (CBF) and cerebral blood volume (CBV) were decreased in right MCA territory.
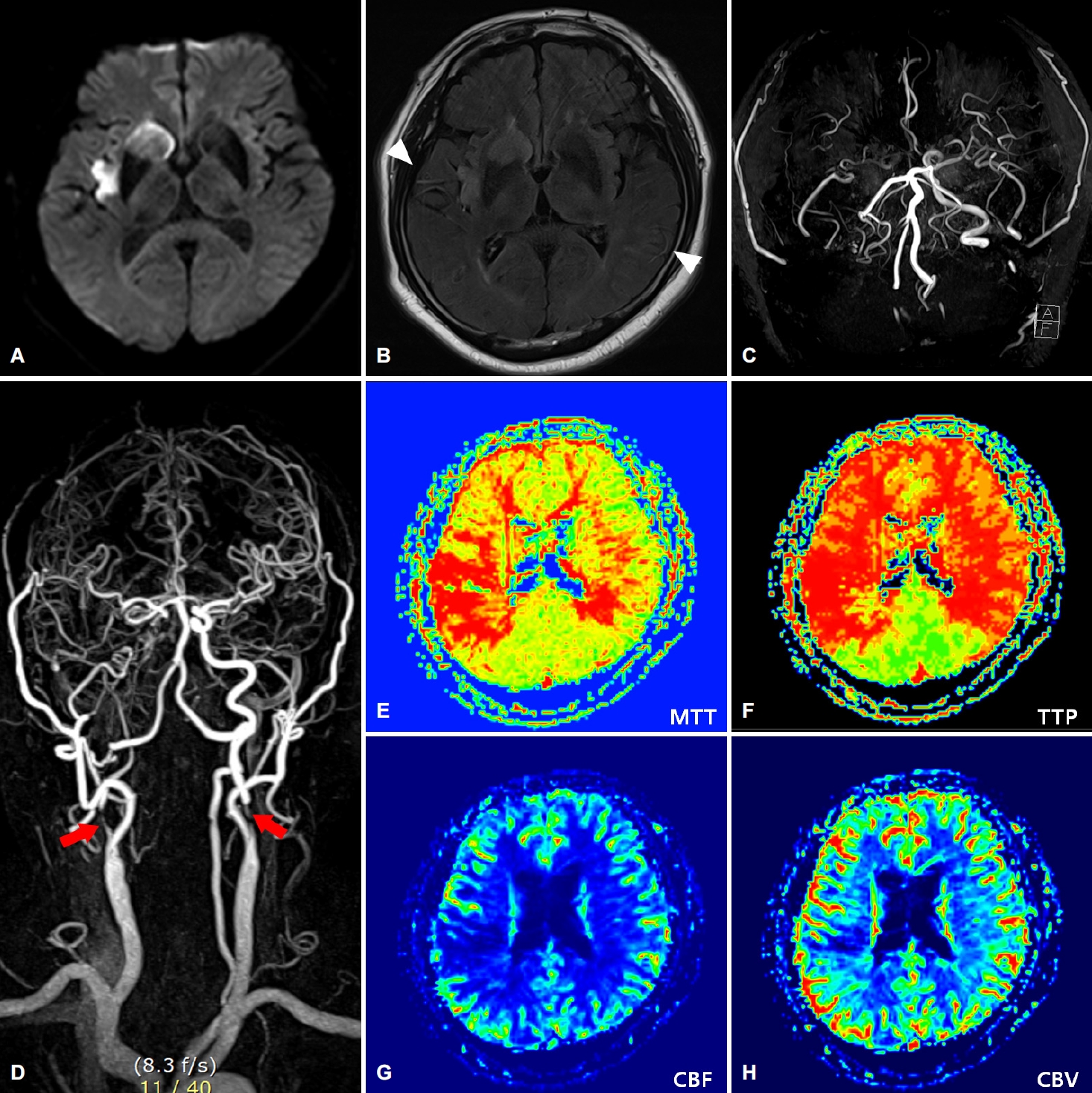
Figure 2.
Conventional cerebral angiography. (A, B) Right carotid angiogram shows severe stenosis of the proximal internal carotid artery (ICA) with a slow antegrade flow in reaching the distal ICA which supply right anterior cerebral artery (ACA) and middle cerebral artery (MCA) flow with a compensatory collateral flow from the external carotid artery (ECA). (C, D) Left carotid angiogram demonstrates severe stenosis of the proximal ICA with a slow antegrade flow to the left ACA and MCA with a compensatory collateral flow from ECA. (E, F) After successful carotid stenting on right proximal ICA, right carotid angiogram shows improved antegrade ICA flow which supply ipsilateral ACA and MCA flow with a newly developed compensatory flow toward left ACA and MCA through the anterior communicating artery. (G, H) Left carotid angiogram shows a slow antegrade ICA flow to the left MCA with a disappeared compensatory flow to the ipsilateral ACA, and with a poor collateral flow from posterior circulation.

Figure 3.
(A) Ten days after carotid stenting, follow-up brain computed tomography demonstrates localized hyperdense lesion along the left parietal sulcus. (B) Magnetic resonance susceptibility-weighted image reveals low signal intensity lesions along the left fronto-parietal sulci, which were compatible with cortical subarachnoid hemorrhage. (C, D) After successful carotid stenting on left proximal internal carotid artery, left carotid angiogram demonstrates improved antegrade ICA flow which supply ipsilateral ACA and MCA flow without compensatory flow from the external carotid artery. ICA; internal carotid artery, ACA; anterior cerebral artery, MCA; middle cerebral artery.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 605 View
- 34 Download
- Related articles
-
Isolated Intraventricular Hemorrhage after Carotid Artery Stenting2021 August;39(3)
Acute Exacerbation of Neovascular Glaucoma after Carotid Artery Stenting2018 November;36(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



