MTHFR유전자의 이형접합변이(C677T)를 동반한 대뇌정맥동혈전증
Cerebral Venous Sinus Thrombosis with MTHFR C677T Heterozygous Mutation
Article information
Trans Abstract
Decrease in the activity of methylenetetrahydrofolate reductase (MTHFR) increases the level of homocysteine. MTHFR C677T gene polymorphism has been reported as a well-known cause of elevated homocysteine level associated with cerebral venous sinus thrombosis (CVST). A 34-year-old male was admitted with severe headache after generalized seizure. Brain magnetic resonance venography showed thrombus in superior sagittal sinus. In the investigation of risk factors, a slight increase in homocysteine caused by MTHFR C677T heterozygous mutation is presumed to be the cause of CVST.
호모시스테인에 메틸기가 제공되어 메티오닌(methionine)으로 대사되는 과정에는 여러 효소가 관여하며, 그중 하나인 methylenetetrahydrofolate reductase (MTHFR)의 활성도가 감소하면 메티오닌으로 대사되지 않고 남아있는 호모시스테인의 수치가 높아져서 고호모시스테인혈증을 유발하게 된다. 이러한 고호모시스테인혈증을 일으키는 유전 원인으로 MTHFR C677T유전자변이가 보고되어 있다[1].
고호모시스테인혈증은 혈관내피세포의 손상을 일으켜 크고 작은 혈관의 폐색을 유발하므로 심근경색증, 허혈뇌졸중, 말초동맥폐색질환 등을 잘 동반한다. 또한 심부정맥혈전증, 폐동맥색전증, 대뇌정맥혈전증(cerebral venous thrombosis)을 포함한 정맥혈전증을 일으키는 것으로도 알려져 있다[2]. 경도의 혈중 호모시스테인 농도 증가와 관련한 대부분의 경우 동맥에서 발생하는 질환이 보고되었으나 정맥혈전증은 매우 드문 것으로 알려져 있다[3]. 이에 저자들은 경도의 고호모시스테인혈증을 보이고 대뇌정맥동혈전증이 발생한 환자에서 확인된 MTHFR유전자의 이형접합변이(C677T) 1예를 보고한다.
증 례
건강하던 34세 남자가 내원 1시간 전 발생한 경련으로 응급실에 왔다. 쇼파에 앉아있다가 갑자기 쓰러지며 좌측으로 몸이 편위 되고, 2분간 전신강직간대발작을 하였다. 발작이 멈춘 뒤 약 15분간 의식이 혼미하다가 회복되었다. 내원 3일 전 화장실에서 나오던 중 같은 양상으로 1분간 경련을 하였다. 뇌전증, 뇌염 등의 과거력은 없었다. 평소 두통이 없던 환자로, 2주 전부터 머리 전체에 깨질듯한 양상의 두통이 시작되어 서서히 강도가 심해지다가 내원일 아침부터는 일상생활을 제대로 하지 못할 정도로 악화되었다. 내원 3일 전부터 오심과 구토가 동반되었으나 시력저하를 포함한 국소신경계증상은 없었다. 환자는 최근 상기도감염이나 부비동염, 중이염, 두부 외상은 없었다. 약물 복용력이나 흡연, 음주 등의 사회력도 없었다. 신체진찰에서 혈압, 맥박, 체온을 포함한 활력징후는 정상이었고 유두부종은 관찰되지 않았다. 신경계진찰에서도 고위피질기능, 뇌신경, 운동 및 감각기능, 소뇌기능은 모두 정상이었다. 처음 발생하여 진행하는 양상의 심한 두통과 반복적인 전신 경련의 원인을 찾기 위해 뇌 컴퓨터단층촬영혈관조영술(computed tomography [CT] angiography)을 시행하였다. 조영증강 전 CT에서 우측 전두엽 피질에 국소적인 고음영이 관찰되었고(Fig. A) 조영 증강 후 CT에서 상시상정맥동의 빈델타징후(empty delta sign) 소견이 확인되었다(Fig. D). 입원 후 시행한 뇌 자기공명영상 확산강조영상(diffusion-weighted image)에서 우측 전두엽 피질의 고신호 강도를 보였으며(Fig. B) 자화율강조영상(susceptibility-weighted imaging)에서는 동일한 위치에서 저신호강도를 보였다(Fig. C). 조영증강 T1 강조영상과 자기공명정맥조영술(magnetic resonance venography)에서는 전두엽과 두정엽, 후두엽에 걸친 상시상정맥동의 미만성 충만결손(filling defects)이 확인되어(Fig. E, F) 대뇌정맥동혈전증으로 인한 정맥성 뇌경색과 이차적인 출혈변성으로 진단하였다.
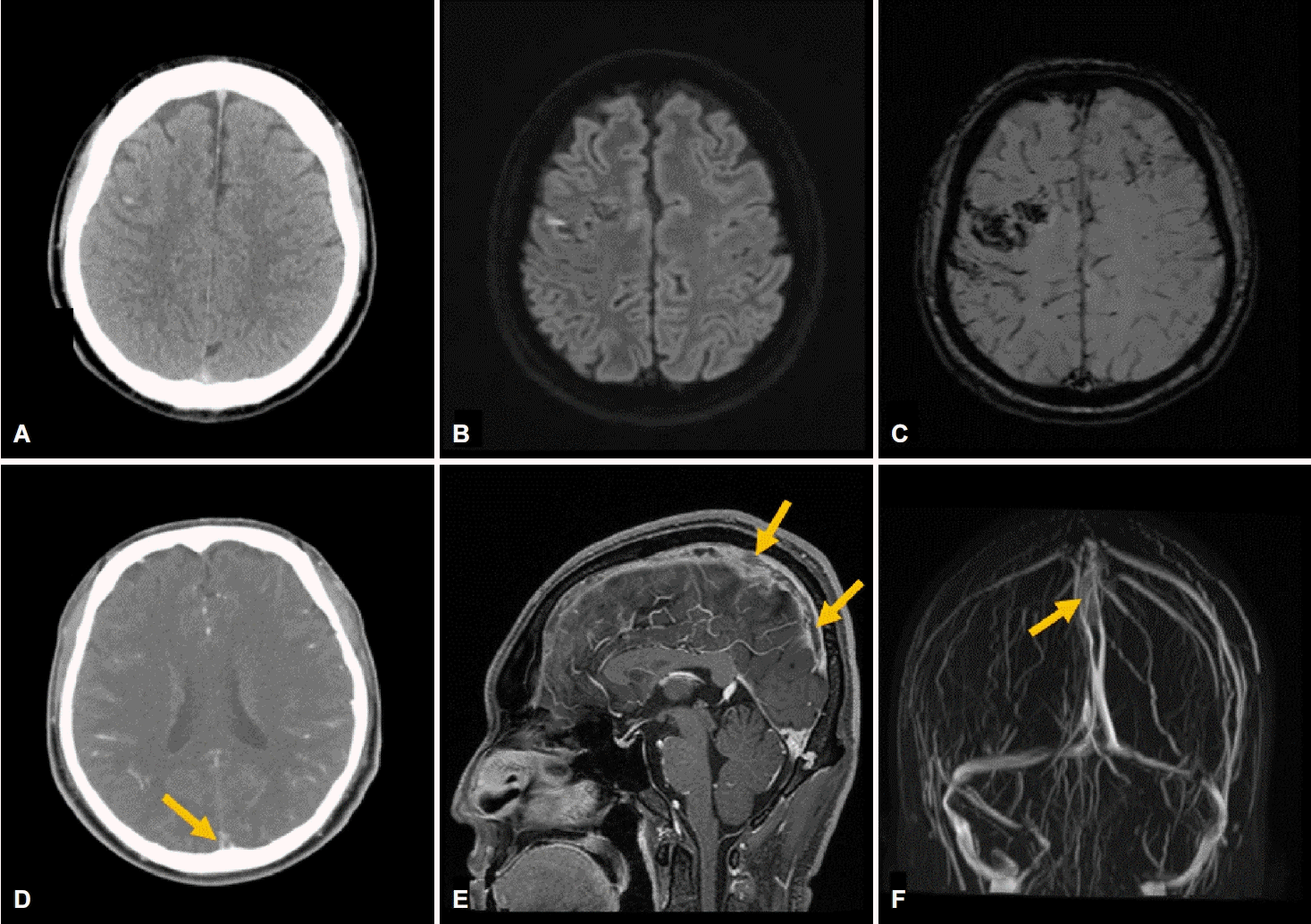
(A) Brain CT shows high density lesion on the sulcus of the right frontal lobe. (B) Diffusion-weighted image reveals hyperintense lesion on the sulcus of the right frontal lobe. (C) Susceptibility-weighted imaging demonstrates hypointense, hemorrhagic lesions on the sulci of the right frontal lobe. (D) Contrast-enhanced Brain CT shows the empty delta sign in superior sagittal sinus (arrow). (E) Sagittal T1-weighted image with enhancement shows multifocal thrombi at superior sagittal sinus (arrows). (F) Magnetic resonance venography shows diffuse filling defect in superior sagittal sinus (arrow). CT; computed tomography.
일반혈액검사, 일반생화학검사, 갑상선기능검사, 혈액응고검사, 매독검사, 사람면역결핍바이러스검사는 모두 정상이었다. 프로트롬빈시간, 활성화부분트롬빈시간, 섬유소원은 정상이었고, d-이중체는 0.94 mg/L로 증가되어 있었다. 항응고인자 관련 혈액검사상, C단백, S단백, 항트롬빈 III, 루푸스항응고인자, 항인지질항체는 모두 음성 또는 정상 범위였다. 그 외 결체조직질환 관련 혈액검사상, 항핵항체(anti-nuclear antibody), 항호중구세포질항체(anti-neutrophil cytoplasmic antibody), 항이중가닥 DNA항체, 류마티스인자 모두 음성이거나 정상이었다. 혈장 호모시스테인 수치는 15.44 mol/L로 약간 증가되어 있었고, 혈중 엽산과 비타민B12, B6는 정상 수준이었다. 유전자검사에서 응고인자V라이덴돌연변이(factor V Leiden mutation)는 관찰되지 않았고, MTHFR유전자의 이형접합변이(C677T)가 확인되었다. 뇌파검사에서는 양측 전두엽에서 간헐리듬델타활동(frontal intermittent rhythmic delta activity)이 관찰되었다.
환자는 MTHFR C677T유전자변이에 의한 대뇌정맥동혈전증으로 진단하고 에녹사파린(enoxaparin) 1 mg/kg을 하루 한 번 피하 주사로 5일 동안 사용한 후 와파린으로 변경하여 국제표준화비율을 2.0-3.0으로 유지하였다. 또한 항경련제로 레비티라세탐(levetiracetam) 500 mg을 하루 두 번 사용하였으며, 입원 8일째 시행한 추적 뇌자기공명영상에서 상시상정맥동의 혈전이 거의 사라진 것을 확인할 수 있었다. 이후 와파린과 엽산 1 mg을 함께 복용하면서 외래 추적 관찰 중으로 현재까지 두통이나 경련의 재발 및 새로운 신경계이상 소견은 없었다.
고 찰
MTHFR유전자변이의 빈도는 인종과 지역에 따라 13-40%까지 다양하게 나타나며, 국내에서는 이형접합변이(677CT)와 동형접합변이(677TT)의 비율이 48%, 14% 정도로 보고된다[4]. 또한 677TT를 갖는 경우 MTHFR 효소 활성도가 정상 대조군(677CC)의 활성도에 비해 30%로 감소되고, 677CT의 경우 60%로 감소하는 것으로 알려져 있다[5].
호모시스테인은 메틸화를 거쳐 메티오닌으로 대사되는데, 이 과정에서 필요한 메틸기는 5-methyltetrahydrofolate에서 얻어진다. MTHFR이 5,10-methylenetetrahydrofolate를 5-methyltetrahydrofolate로 환원시켜 호모시스테인에 메틸기를 제공하기 때문에 유전자변이에 의해 MTHFR의 활성도가 감소하면 메티오닌으로 대사되지 않고 남아있는 호모시스테인이 증가하여 고호모시스테인혈증을 유발하게 된다[1].
혈장내 호모시스테인이 증가하면 심근경색, 허혈뇌졸중과 같은 심뇌혈관질환, 신경관결손, 난소암, 췌장암과 같은 고형암뿐만 아니라 혈액암, 혈관성치매, 당뇨병말초신경병 등 다양한 질환의 발병률이 증가하는 것으로 나타났다. 드물지만 심부정맥혈전증, 폐동맥색전증, 대뇌정맥혈전증을 포함한 정맥혈전증이 발생할 수 있다.[2].
고호모시스테인혈증이 정맥혈전증을 일으키는 병태생리학 기전으로 여러 가지 가설이 제시되었다. 호모시스테인은 조직플라스미노겐활성인자(tissue plasminogen activator)가 혈관내피세포에 부착하는 것을 막고 프로트롬빈을 활성화시키는 반면, S단백과 C단백의 활성화는 억제시키므로 백혈구 흡착과 혈소판 응집이 용이해져 혈전이 잘 형성된다. 또한 호모시스테인은 세포질그물(endoplasmic reticulum, ER) 내에서 잘못 폴딩된 단백질을 만들고, 이는 세포질그물체스트레스 반응(ER stress response)을 일으켜 지질대사이상과 염증 반응, 세포자멸사(apoptosis)를 일으키므로 혈전이 잘 형성되는 환경을 만든다. 뿐만 아니라 혈관내피세포가 높은 농도의 호모시스테인에 노출되면 산화질소가 감소하고, 활성산소에 의해 혈관내피세포가 손상되므로 혈전 형성에 기여한다[6].
국내에서는 MTHFR유전자검사에서 동형접합변이가 확인된 상시상정맥동의 혈전증과 고호모시스테인증이 보고된 바 있다[7,8]. 본 증례는 MTHFR유전자의 이형접합변이가 진단된 대뇌정맥동혈전증에 대한 증례로 호모시스테인 수치의 현저한 상승이 관찰되지 않았다. 이는, 고호모시스테인혈증이 없더라도 MTHFR유전자변이 자체가 대뇌혈전증의 원인이 될 수 있음을 보여주는 증례로 국내 이형접합변이의 높은 발생 빈도를 고려해볼 때 임상적 의의가 있다[4].
그러나 대뇌정맥혈전증은 유발요인이 다양하여 이를 감별하는 것이 쉽지 않은 질환이므로 앞서 기술한 결론을 도출하기 위해서는 결체조직질환, 혈액응고인자이상, 염증, 감염, 대사질환, 약물 복용력 및 유전자이상 등을 감별하기 위한 면밀한 병력청취와 다양한 혈액검사가 필요하다[9]. 그러므로 대뇌정맥혈전증 환자에서 MTHFR 유전자의 이형접합변이가 확인될 경우 이것 만을 원인으로 고려하여 중복된 다른 원인에 대한 감별을 소홀히 하지 않도록 주의가 필요하다.