전정자율신경반사의 해부생리적 특징과 임상 발현
Anatomic and Physiologic Properties and Clinical Manifestations ofVestibulo-Autonomic Reflexes
Article information
Trans Abstract
The vestibular nervous system senses linear and angular acceleration upon the head during postural change and generates vestibular nerve activity changes. The autonomic nervous system regulates involuntary physiologic processes throughout the peripheral and central nervous systems. The vestibular and autonomic systems interplay throughout several brain regions to maintain homeostasis during the postural changes, called vestibulo-autonomic reflex. In this review, we first contemplated the anatomic and physiologic properties of vestibulo-autonomic reflex, focusing on the relationship between vestibular and cardiovascular systems and between the vestibular and respiratory systems and the role of the brainstem and cerebellum on the vestibulo-autonomic reflex. Then, we summarized the autonomic dysfunction reported in patients with various vestibular disorders, such as acute unilateral vestibulopathy, benign paroxysmal positional vertigo, Meniere’s disease, and persistent perceptual postural dizziness. Finally, we described the mechanism of autonomic manifestation in vestibular disorders in detail using the recently proposed mechanism of vestibular syncope integrating the vestibular system, brainstem and cerebellum, and autonomic system functions.
서 론
전정신경계(vestibular system)는 자발적(voluntary) 또는 수동적(passive) 이동시 발생하는 머리의 선형 및 각 가속도를 측정하여 신경발화로 변환한다. 뇌간(brainstem) 및 소뇌(cerebellum)의 하부신경구조물에서 정제된 전정신경신호는 시상(thalamus) 및 전정피질(vestibular cortex)로 전달되어 속도 및 위치에 대한 인식을 가능케 하며, 또한 안구운동계, 체간 및 사지운동계와 상호작용하여 전정안반사(vestibulo-ocular reflex), 전정척수반사(vestibulo-spinal reflex)를 만들어 공간에서 눈, 머리 및 체간의 위치를 조정하는 역할을 한다[1-3]. 자율신경계(autonomic system)는 그 작용기 전에 따라, 교감(sympathetic)과 부교감(parasympathetic) 신경계로 구분하는데, 중추 및 말초신경계 전반에 걸쳐 존재하며[4], 심박수, 혈압과 호흡 등을 포함한 불수의적 생리과정을 조절하여 항상성을 유지하게 한다[5,6]. 전정신경계는 자율신경계와도 상호작용을 하여 전정자율신경반사(vestibulo-autonomic reflex)를 형성하는데, 특히 교감신경의 활성 변화를 통해 이동 중 발생하는 혈압 및 맥박 변동을 조정한다[7]. 따라서 전정신경계질환에서 자율신경계증상 발현이 흔하며, 멀미(motion sickness) 및 만성어지럼에서 자율신경 증상과 전정신경계와의 관련성이 알려져있다[8-10]. 이와 같은 배경에서 본 종설에서는 전정신경계와 자율신경계의 관계 및 임상 증상에 대해 고찰하였다.
본 론
1. 전정신경계와 자율신경계의 관계
전정계와 자율신경계의 1차 중추영역은 후방섬피질(posterior insular cortex)에 공통적으로 산재되어 있어, 상위 조절계에서부터 근접함을 알 수 있다[11-13]. 후방 섬피질은 전정신경핵, 고립로핵(nucleus of solitary tract), 팥곁핵복합체(parabrachial nucleus complex)에서 기원한 신경신호를 시상을 거쳐 전달받고, 전띠다발피질(anterior cingulate cortex), 편도(amygdala), 안와전두엽(orbitofrontal cortex)과 상호작용하여 자율신경계의 출력을 조절한다[14]. 뇌간의 전정계와 자율신경계의 연결은 하전정핵(inferior vestibular nucleus)에서 미주신경의 등쪽운동핵(dorsal motor nucleus of vagus)과 복측외측수질(ventrolateral medulla)까지의 하행로와 상전정신경핵(superior vestibular nucleus)에서 상소뇌각(superior cerebellar peduncle) 주변의 팥곁핵복합체에 이르는 상행로로 구성된다[15]. 하행로는 심혈관계에, 상행로는 호흡계에 영향을 미치는 것으로 추정된다. 소뇌의 전소뇌엽(anterior lobe) 및 후소뇌엽의 상하부(rostral and caudal part of posterior lobe)가 교감과 부교감계 활성에 영향을 미치는 것으로 알려졌다[16-19]. 이와 같은 해부학적 신경회로의 존재 이유를, 가장 많은 연구가 진행된 전정심혈관반사(vestibular-cardiovascular reflex)와 전정호흡반사(vestibular-respiratory reflex)를 통해 살펴보겠다.
1) 전정심혈관반사
우리는 중력이 작용되는 환경에 살고 있기 때문에 체위 변화에 따라 체내에 혈장분포와 혈류흐름의 변화가 발생한다. 즉, 자세가 바뀌면 중력의 영향으로 체내 혈장이 재배치되어 의존성 위치(dependent position)에는 혈액량과 관류압이 증가하는 반면, 비의존성 위치(non-dependent position)에는 반대의 현상이 발생한다. 이는 뇌를 포함한 주요장기로 가는 관류의 감소나 증가가 발생함을 의미한다[20]. 예를 들면 앙와위(supine)에서 기립하면 중력의 영향으로 하지와 복부로 혈액량이 재배치되고 심장으로 들어오는 혈액(preload)이 감소하여 심박출량이 저하되고 결과적으로 뇌혈류의 감소가 초래된다. 이에 대해 우리 몸은 자율신경반사를 통해 혈압과 맥박을 조절하여 항상성을 유지해야 한다[21]. 가장 널리 알려진 혈압과 맥박의 보상기전은 압력반사경로(baroreflex pathway)이다[5,20]. 혈압 변화시 그 정보를 대동맥체와 경동맥체의 압력 수용기(baroreceptors)가 인지하고 뇌간의 고립로핵으로 전달한다. 혈압이 저하되면 압력 수용기가 수축되고 고립로핵으로 전달되는 신경활성이 저하된다. 원래 고립로핵은 복측외측연수의 하부(caudal ventrolateral medulla)를 활성화시키며, 복측외측연수의 하부는 다시 복측외측연수의 상부(rostral ventrolateral medulla)를 억제하고 있다. 따라서 압력수용체의 활성이 줄어들면, 고립로핵과 복측외측연수의 하부의 활성이 줄어들고, 복측외측연수의 상부의 활성은 증가하게 된다. 복측외측연수의 상부는 척수의 외중간세포기둥 (intermediolateral cell column)에 있는 절전교감신경섬유(preganglionic sympathetic neuron)의 활성을 자극하기 때문에, 복측외측연수의 상부활성은 교감신경활성을 증가시킨다[20]. 고립로핵은 또한 부교감성 심장미주신경이 시작되는 의문핵(nucleus ambiguus)과 미주신경의 등쪽운동핵을 흥분시키는데, 따라서 고립로핵의 활성저하는 부교감신경의 출력을 감소시키게 된다. 종합하면 기립에 의한 혈압의 감소는 압력반사회로를 통해 다시 혈관을 수축시키고 심박수와 심장근의 수축력을 증가시켜 궁극적으로 혈압을 증가시키면서 항상성을 유지한다[22]. 압력반사는 혈압이 높은 경우 반대로 작용한다. 그러나 이 압력반사의 내재된 약점은 되먹임기전(feedback mechanism)를 통해 작동한다는 점이다(Fig. 1). 즉, 혈압의 변동성이 생겨야 이를 보상한다는 것이며, 압력반사회로가 정상적으로 작동하더라도 혈압의 보상에는 1-2초 이상의 시간이 필요하다[5]. 이는 1-2초 내에 체위가 변하는 상황, 즉 반복적으로 앉았다가 일어나거나, 또는 계단을 오르내리거나 뛰는 경우, 압력반사만으로는 적절한 항상성을 담보할 수 없음을 시사한다. 이를 보상하기 위해서는 다른 방식의 조절기전이 필요한데, 여기에 전정자율신경반사의 역할이 있다.
전정자율신경반사의 증거로 먼저 전기전정자극(galvanic vestibular stimulation, GVS)시 근육의 혈류를 조절하는 근육교감신경(muscular sympathetic nerve)의 활동 변화가 있다. 약 1초간 지속되는 저주파(low frequency)의 정적(static) GVS에서 근육교감신경의 활성의 변화는 없었으나, 고주파(high frequency)의 동적(dynamic) GVS에 의한 근육교감신경의 활성은 심장박동과 별개로 근육교감신경의 활동 변화를 초래하였다[23,24]. GVS는 근육뿐만 아니라 피부의 혈관수축과 땀분비를 증가시키는 피부교감신경(skin sympathetic nerve)의 활성도 변화를 초래하는 것으로 확인되었다[25]. 이를 통해 전정자율신경반사는 주로 교감신경계와 영향이 있는 것을 알 수 있다. 전정계 자극을 통해 혈압의 변화를 살펴 본 경우는 다음과 같다. 먼저 비선택적 전기자극을 전정계에 가하면 약 100-200 ms의 잠복기를 가지고 혈압이 증가하거나 감소하는 패턴이 확인되었다[26]. 또한 보다 생리적인 자극, 즉 머리의 위치를 변화시키는 등의 방법을 통한 전정자극 실험에서는 1) 머리의 위치를 중력에 평행한 축을 중심으로 수평회전시에 교감신경활성의 변화가 없었으나, 2) 머리를 숙이거나 뒤로 젖히는 등의 자극시 체위 변화에 따라 예상되는 정맥혈의 감소를 보상하는 방향으로 교감신경활성의 변화가 나타남을 확인하였다[27]. 이와 같은 증거는 전정교감신경반사는 반고리관(semicircular canal)보다는 이석(otolith)신호가 중요하며, 압력반사에 비해 빠르게 작동하여 몸의 이동에 따른 혈압 변화에 대응하는 목적이 있음을 암시하고 있다[5]. 비록 급성저혈압시 내전정신경핵의 I형 신경세포의 발화가 증가하고 II형 신경세포의 발화는 억제되는 패턴이 있어 혈압 변화에 의해 전정신경계의 활성이 변화할 수 있는 피드백 회로의 특징이 없다고 할 수 없으나[28], 머리 움직임(자극)에 의해 혈압변동을 초래하는 교감신경활성(출력)을 조절한다는 주요 기능적 특징은 전정교감반사가 피드포워드(feedforward) 방식으로 작동함을 알 수 있다(Fig. 1) [5].
이와 같은 전정자율신경반사는 전정신경핵과 뇌간의 자율신경핵의 연결회로를 통해 빠르게 전달될 수 있어, 앞서 기술한 하전정핵에서 미주신경의 등쪽운동핵과 복측외측수질을 향한 하행로가 주로 담당하는 해부학적 구조물이 될 것이다.
2) 전정호흡 반사
호흡은 흡기(inspiration)시 횡경막(diaphragm)과 외늑간근육(external intercostal muscle)이 수축하여 흉강을 아래, 위로 넓힌다. 호기(expiration)는 폐의 복원 탄성에 의해 이루어지며 보통 근육의 작용은 필요 없지만, 강한 호기 시에는 복근(abdominal muscle)과 내늑간근육(internal intercostal muscle)이 중요한 역할을 한다[29]. 또한 호흡근의 수축은 상기도 근육(upper airway muscle)과 조화를 이루어 작동해야 한다. 자세의 변화는 호흡근의 안정 시 길이를 변화시키는데, 달라진 자세에 의해 호흡의 항상성이 유지되기 위해서는 호흡근이 변화된 길이에 맞게 활성도의 변화가 발생해야 한다[30]. 예를 들면, 사족보행 동물이 머리를 들어올리거나 인간이 앙와위에서 기립자세로 변경하면 안정 시의 횡경막이 짧아지며(즉 흉강이 넓어짐), 이는 변화된 자세에서 호흡 항상성을 유지하기 위해 흡기의 횡경막 활성도가 증가해야 하며, 호기에 복근의 활성도를 증가시켜 흉강을 위로 밀어 올려야 함을 의미한다. 주목할 것은 각각 흡기와 호기에 작동해야 하는 호흡근이 특정 자세에서는 동시에 활성이 증가해야 한다는 것이다. 상기도 근육도 특정자세에서 활성이 변하는데, 혀의 돌출근(tongue protrude muscle)은 사족 보행 동물의 경우 고개를 들어올리는 자세, 인간의 경우 앙와위에서 활성이 증가한다[29]. 이와 같은 기능의 손실은 특정자세에서 호흡의 항상성을 손상시킨다.
자세 변화가 호흡근에 미치는 영향을 통해 전정-호흡 반사가 있음이 제시된 바가 있으나, 보다 직접적인 근거는 전기자극을 통한 전정계 자극이 호흡근의 활성도를 변화시킨 실험을 통해 확인해 볼 수 있다. 전정계에 대한 전기자극은 15 ms 미만의 잠복기를 가지고 늑간신경과 복부신경, 상기도 근육에 관여하는 미주신경, 설인두신경(glossopharyngeal nerve)과 설하신경(hypoglossal nerve)의 광범위한 활성 변화를 유발하였다[31,32]. 또한 내, 하전정신경핵의 비활성화를 통해 전정전기자극에 대한 호흡근 신경의 조정이 소실됨은 전정호흡반사회로의 존재를 더욱 뒷받침하는 증거이다[33]. 전정 신경 이외 광범위한 탈신경화(denervation)된 동물실험에서는 머리를 위로 들어올리는 회전자극은 복부근육과 혀의 돌출근의 활성도를 증가시켰다[34]. 이는 자세 변화에 따른 횡경막의 길이 변경에 대응하는 근육활성 조절을 통해 호흡을 유지시키고 혀를 돌출시켜 상기도를 확보하게 하는 생리적 요구에 부합하는 현상이다. 또 다른 실험에서는 머리를 들어올리는 자극에 대해 관찰되던 호흡근의 활성변조가 전정신경을 제거하면 횡경막에서는 소실되지 않으나 복근에서는 소실되었고, 횡경막과 복근의 자발적 활성은 모두 증가하는 것을 보고하였다[29,35]. 특히 시간이 지나면서 손상된 복근의 활성변조는 회복되는데 반해 횡경막과 복근의 증가된 자발적 활성은 회복되지 않는 것을 보여주었다.29,35 이를 통해 전정계는 자세 변화에 대응하여 호흡의 항상성을 유지하기 위해 긴장성 억제신호를 호흡근에 전달하며 복근(호기근)의 활성 변화에 주로 관여함을 알 수 있다.
전정호흡반사의 해부학적 회로는 다음과 같다. 호흡근에 연결되는 전운동호흡신경(premotor respiratory neuron)은 연수 하부(caudal medulla)의 측면망상체(lateral reticular formation)와 내측연수망상체(medial medullary reticular formation)에 위치한다[36]. 실험에서는 내측연수망상체를 화학적 비활성화하면 전정자극에 대한 횡경막과 복근의 활성변조가 증가하고 복근의 자발적 활성이 증가였고, 이러한 변화가 외측연수의 비활성화를 통해 소실되었다[33]. 이를 통해 내측연수망상체는 전정핵에서 신호를 받아 횡경막과 복근에 억제신호를 전달하는 반면 연수 하부의 외측경로는 흥분신호를 호흡근에 전달하는 것으로 생각된다.
3) 전정자율반사와 소뇌
소뇌 구조 중 전소뇌엽, 후소뇌엽의 상하부가 교감과 부교감계 활성에 영향을 미치는 것으로 알려졌다. 소뇌와 자율신경반사의 관련성은 단편적으로 알려져 있으나 기술한 전정심혈관 및 전정호흡 반사가 자세 변화에 관계된 혈압과 호흡의 항상성 유지에 관여함을 고려할 때 소뇌와 자율반사와의 관계를 전정정보처리에 있어 소뇌의 역할에 미루어 짐작해 볼 수 있다. 깊은 이해를 위해 말초전정계의 작동원리와 불완정성 그리고 소뇌의 전정정보처리 방법에 대해 살펴보겠다.
(1) 말초전정계의 불완전성
말초전정계는 머리의 이동에 의한 회전(angular) 및 선형(linear)가속도를 신경신호로 변환하여 뇌로 전달한다. 반고리관은 골성미로(bony labyrinth)와 막성미로(membranous labyrinth)로 구성되며, 막성미로 안에 내림프(endolymph)가 흐르고 있다. 머리가 회전하면 막성미로는 머리와 함께 이동하는 반면, 내림프는 관성에 의해 원위치를 유지하려 하기 때문에 막성미로와 내림프의 이동에 상대적인 차이가 발생하고, 이는 팽대부릉정을 회전방향의 반대로 편위시켜 신경전위를 유발한다[37]. 그러나 등속도의 머리회전에서는 내림프가 막성미로와의 마찰력에 의해 회전하기 시작하여 내림프와 막성미로 사이에 상대적 움직임의 차이가 점차 사라지게 된다. 따라서 팽대부릉정은 편위된 위치에서 원래 위치로 돌아오게 된다. 또한 회전이 멈추어도 내림프가 마찰력에 의해 정지하기까지는 일정 시간이 필요하기 때문에 회전이 멈춘 후 팽대부릉정은 회전방향으로 편위되어 신경신호를 형성하게 된다. 이 현상은 회전의자(rotation chair)의 계단속도회전(step-velocity rotation)검사에서 등속도 회전 중에 전정신경의 발화와 안진을 감쇄시키고 회전 후에는 반대방향으로 신경발화와 안진이 발생시킨다. 이 현상은 1-2초 내의 등속도 회전에서도 발생하기 때문에, 뇌로 전달되는 회전속도는 부정확하게 된다.
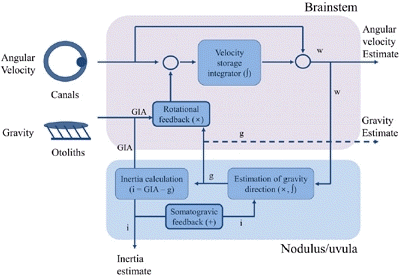
이석기관은 선가속도계(linear accelerometer)로 중력가속도(gravitational acceleration)와 이동에 수반한 관성가속도(inertial acceleration)를 측정한다[21]. 중력가속도는 지구상에 존재하는 한 크기가 변하지 않으나 관성가속도는 이동에 따라 변한다. 인간은 직립의 기준을 중력가속도에 맞추기 때문에 올바른 중력가속도에 대한 정보는 필수적이다. 또한 선형 이동에 따른 인식, 안반사, 체간 및 자율신경반사를 형성하기 위해서는 이동에 따른 관성가속도를 측정해야 한다. 그러나 등가원리의 법칙(equivalent principle; 어떤 선가속도계도 중력가속도와 관성가속도를 구분하지 못한다)에 따라 생리적 선가속도계인 이석기관도 중력가속도와 관성가속도를 구분해내지 못하고 두 가지의 벡터합인 중력관성가속도(gravitoinertial acceleration)를 측정해 뇌에 전달하는데, 이를 중력관성가속도의 모호성(ambiguity of gravitoinertial acceleration)이라 명한다[38].
(2) 중추전정계의 역할
말초전정계에서 전달되는 부정확한 정보에도 불구하고, 우리 뇌는 정확한 회전과 이동에 대한 정보를 가지는데, 이는 중추전정계가 말초전정계를 보완하는 신경연산(neural computation)을 수행함을 암시한다. 신경의 발화가 물리적 자극을 표현하며, 신경세포간의 연결을 통해 수학적 연산을 수행한다는 것을 내적모델(internal model)이라고 한다[38]. 그렇다면 내적모델을 통해 중추전정계가 말초전정계의 불완전한 신경정보를 보완하는 원리를 살펴보겠다.
회전속도에 대한 보완: 반고리관에서 발생한 관속도(canal velocity, CV)는 머리가 회전하는 속도(head velocity, HV)와 내림프가 회전하는 속도(endolymph velocity, EV)의 차이에 의해 발생한다(방정식 1). 따라서 내림프의 EV를 측정할 수 있으면 머리의 회전속도(HV)를 측정할 수 있다. 내림프의 EV는 내림프의 가속도(endolymph acceleration, EA)를 적분하면 되는데(방정식 2), 내림프와 막성미로와의 마찰력(friction)이 내림프의 이동의 원천이므로 EA는 마찰력(frictional force, FF)에 비례한다(방정식 3). 그리고 이동마찰력은 막성미로와 내림프의 속도 차이, 즉 반고리관의 속도정보에 비례한다(방정식 4). 따라서 반고리관 속도정보(CV)를 적분하고 특정 이득(gain)을 곱하면 내림프의 회전속도가 된다. 즉 공간에서 머리의 회전속도는 1) 반고리관 속도정보와 2) 특정이득을 곱한 적분된 반고리관 속도정보의 합으로 측정할 수 있다(방정식 5). 이러한 1형과 2형 신경세포로 구성된 전정신경세포와 반대측 전정신경세포와 연결되는 교차섬유가 이와 같은 신경적분을 수행하는데 중요한 역할을 한다.
방정식 1) CV = HV – EV
방정식 2) EV = ∫ EA dt
방정식 3) EA ∝ FF (∴ EA = K1 × FF)
방정식 4) FF ∝ HV – EV (∴ FF = K2 × (HV-EV) = K2 × CV)
방정식 5) HV = CV + EV = CV + ∫ EA dt = CV + ∫ K1 × FF dt = CV + ∫ K1 × K2 × CV dt = CV + K3 ∫ CV dt (K3 == K1 × K2)
선가속도에 대한 보완: 이석기관은 중력가속도와 관성가속도의 벡터합인 중력관성가속도를 뇌에 전달한다. 그러나 중력가속도의 크기는 일정하며, 중력에 평행하지 않는 회전(머리를 숙이거나 기울이는 경우)만이 머리중심좌표계(head centered reference frame)에서 중력의 방향을 변화시킨다. 앞서 중추전정계가 머리의 회전 속도를 측정하는지 살펴보았다. 그리고 회전속도는 벡터량으로 표시할 수 있다. 중력벡터(g)와 회전벡터(Ω)의 외적(cross product)은 중력벡터의 변화량을 의미하기 때문에, 이를 시간에 따라 적분하면 머리중심좌표계에서 중력벡터의 위치를 계산할 수 있다. 이후 이석기관에서 전달된 중력관성가속도에서 중력가속도를 감하면 관성가속도를 추정할 수 있다(관성 = 중력관성가속도 – 중력가속도) (Fig. 2).
(3) 전정자율반사에서 소뇌의 역할
앞선 내용을 통해 소뇌는 뇌간의 전정신경핵과의 연결회로를 통해 불완전한 말초전정신호를 정제하여 회전속도, 중력가속도, 관성 가속도를 올바르게 추정하게 함을 알 수 있다. 전정자율반사는 체위에 따라 심혈관 및 호흡의 항상성을 유지하는 기능을 가지기 때문에 체위 변화에 대한 정확한 정보가 필요하다. 따라서 자율신경계와 소뇌의 해부학적 연결 및 자극에 따른 신경활동의 변조는 말초전정신호가 직접적으로 자율신경계에 영향을 미치는 것 이외에 뇌간과 소뇌에서 처리된 2차 전정정보가 자율신경계에 영향을 미치는 현상을 반증하는 것을 암시한다.
2. 전정질환에서 자율신경증상
1) 일측전정신경병증(acute unilateral vestibulopathy)
급성전정신경염에서 기립못견딤증(orthostatic intolerance)은 흔한 증상이며 이에 대한 보상으로 기립빈맥도 관찰된다[39]. 기립경검사를 통해 급성기에 기립저혈압을 보고한 연구도 있다[40]. 전정신경염 환자는 정상군에 비해 냉각피부자극시 혈압증가가 미미했다. 또한 기립자극시 심장미주반사(cardiovagal reflex)의 활성을 반영하는 심박동수변이(heart rate variability)의 고주파(high frequency)영역 감소가 관찰되지 않고, 저주파/고주파영역의 비율(low frequency to high frequency ratio)의 변화가 없어 교감신경반응의 감소를 제시하였다[41]. 이와 같은 결과가 탈수, 장시간 침상 안정의 영향을 배제할 수 없으나, 전정신경병증에 의한 결과로 발생한 전정심혈관 반사의 이상이 더 주요할 것으로 제시되었다[39].
2) 양성돌발체위현기증(benign paroxysmal positional vertigo)
양성돌발체위현기증의 잔존 어지럼과 자율신경계 부전과의 관계성에 대해서도 보고되었다. 이석정복술 후 약 43% 환자에서는 기립시 순간적 현기증이나 보행이나 머리 움직임에 의해 지속되는 비특이적 어지럼을 호소하는 것으로 보고되었다[42]. 흥미로운 것은 이들 중 약 19%에서 기립저혈압이 관찰된 것인데, 이는 양성돌발체위현기증의 잔존어지럼이 자율신경계 부전, 특히 교감신경계 부전과 관련이 있음을 암시한다[43].
3) 메니에르병(Meniere’s disease)
메니에르병의 증상 발현 사이(interictal stage)와 증상 발현(ictal stage) 당시에 자율신경기능을 정상인과 비교평가한 연구는 증상 발현 사이의 메니에르병은 비록 통계적 유의미를 보여주지는 못했으나, 부교감신경과 기립에 의해 유발되는 교감신경의 활성의 저하를 보고한 바 있다[44]. 메니에르병 발생 전후로 심박수 변동성의 스펙트럼분석과 동공측정을 통해 자율신경계 활성도를 평가한 연구는 양측 차이는 유의미하지 않으나 병측에서 증상 발현 직전의 부교감신경계 저하와 교감신경계 과활성을 확인하였다[45]. 메니에르병 환자에서 과도한 스트레스에 노출되면 교감신경계의 활성화를 유발하게 되고 이는 내이의 혈관투과성 증가와 혈관주위 염증을 유발함을 확인하였다[20,45]. 급성 감각신경성 난청을 보인 메니에르병 환자의 뇌 자기공명영상(magnetic resonance imaging, MRI)은 혈액-미로 장벽의 투과성이 증가됨을 보여주기도 하였다[46]. 교감신경계의 활성화로 유발된 목 경직, 두통과 팔다리 냉한이 메니에르병의 치료 후 호전되었으나 자율신경기능 부전이 메니에르병 환자에게 촉발요인이 되는지 그 결과인지에 대해서는 연구가 더 필요하다고 제시한 바도 있다[44,45].
4) 지속체위지각어지럼(persistent postural perceptual dizziness)
만성 어지럼의 가장 흔한 원인인 지속체위지각어지럼(persistent postural perceptual dizziness)은 과거 체위공포현기증, 만성주관적 어지럼과 시각어지럼으로 표현되었던 만성기능적어지럼을 통합하여 재정의한 것이다[47]. 변동성은 있지만 종일 지속되며 현기증, 불안정감, 흔들거리는 느낌의 증상들을 주로 호소하며 기질적 전정 장애나 정신적 충격 등의 선행인자가 흔히 있다[47]. 불안장애에 대한 개인적 성향과도 관련이 있으나 지속체위지각어지럼 환자에서 섬피질영역과 시각피질의 활성도 변화를 보였고, 섬피질영역은 스트레스와 관련하여 중추 자율신경계 조절에 중요한 피질영역임을 확인하였다[13,48]. 따라서 지속체위지각어지럼 환자에서도 전정신경계와 자율신경기능계의 관계성에 대해 연구가 더 진행되고 있다. 가상현실(virtual reality)에서 운동학적 시각 입력을 통해 전정 자극을 유도하기 위해 다양한 속도 조건(가속, 감속, 일정)으로 수평 및 수직 방향의 움직임 자극을 주며 맥박수 다양성에 대한 평가를 진행한 연구에서 지속체위지각어지럼 환자는 부교감신경의 활성 저하와 교감신경계의 과활성을 보였고 수평보다 수직방향의 움직임에서 부교감신경의 변동성이 낮았다. 이는 전정자극이 자율신경계에 영향을 미치는 것을 의미하며 중력과 균형에 관한 신경신호 처리과정에서 증상을 느끼는 것으로 보인다[49]. 지속체위지각어지럼 환자들은 자율신경계이상으로 구역, 구토, 심계 항진, 식은땀 등의 증상을 호소하고 불안장애나 우울증을 함께 가지고 있기도 한다[47]. 그리고 미주신경자극법이 지속체위지각어지럼 환자에게서 삶의 질 척도와 우울척도에서 유의미한 호전과 어지러움의 악화와 빈도, 자세불안정도의 호전을 보여주었다[50]. 미주신경은 부교감신경계의 중요 요소로 미주신경의 자극이 우울증과 불안에 관여하는 대상피질과 어지럼과 자율신경기능장애에 관여하는 섬피질로 전달되며 이는 노르에피네프린 분비를 매개하여 효과를 발생시키는 것으로 생각되고 있다[51]. 자율신경계와 전정신경계의 연관성에 대해 지속체위지각어지럼 환자에서 확인되지만 반대의 경우 즉, 이미 자율신경계 기능저하가 있다면 이는 시각 전정 시스템 이상을 유발하고 지속체위지각어지럼을 유발할 수도 있기 때문에 해석에 주의를 요하며 더 많은 수의 연구가 필요하다.
5) 중추신경계질환(central nervous system disease)
중추신경계질환과 자율신경 증상에 대한 관계는 아직도 연구가 더 필요하다. 특히 앞서 언급되었던 섬피질은 시상핵을 통해서 전정신경핵, 고립핵 및 시신경교차위핵(suprachiasmatic nucleus)과 연결되어 정보를 다각도로 해석하고 전띠다발피질, 편도체와 안와 전두피질과 상호작용한다[13,16,20]. 추후 이 대뇌피질영역에 발생한 퇴행성질환 혹은 급성 혈관성질환을 대상으로 전정계와 자율신경계에 대한 연구를 통해 질환의 경과 및 임상 증상을 예측할 수 있는 인자로 이용될 수 있는지 연구가 필요하다.
3. 전정실신과 전정자율신경반사에 대한 모델
앞서, 전정질환에서 자율신경 증상에 대한 연구를 살펴보았다. 그러나 전정질환에 동반된 자율신경 증상에 대한 근원적 이해는 쉽지 않다. 이제 전정질환이 유발하는 자율신경 증상의 원리를 최근에 소개된 전정실신을 통해 좀 더 살펴보겠다.
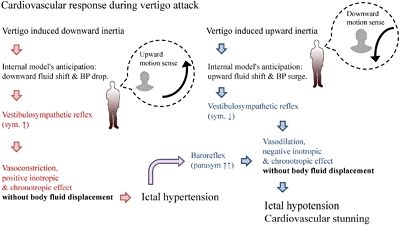
실신은 뇌로 가는 혈류의 전반적이고 일시적 장애로 발생한 의식의 소실로 원인에 따라 다양하게 구분한다[52]. 전정실신은 전정발작이 실신을 유발한 반사성실신(reflex syncope)의 일부로 메니에르병에서 자주 보고되었다[53,54]. 그러나 최근 연구에서는 메니에르병 이외 양성돌발체위현기증, 전정발작(vestibular paroxysmia) 그리고 평가당시 원인을 정확하게 알 수 없는 반복현기증증후군인 양성재발성현기증(benign recurrent vertigo)에서도 전정실신이 보고되었다[55]. 전정실신이 발생하는 기전은 어지럼 발생시 이석기관의 물리적 변형에 의한 흥분성 신호가 전정척수반사로를 통해 사지로 전달되거나, 공간감각을 인지하던 대뇌피질영역에 전달되어 발생할 수 있다고 추상적으로 설명되었다[53]. 그러나 최근 연구에서는 전정실신의 구체적 원리를 전정심혈관반사와 압력반사와의 비정상적 상호작용으로 제시하였는데 이를 간단하게 살펴보면 다음과 같다[38].
체위 변화에 의해 발생하는 체액 분포의 변화는 혈압의 변화를 초래하는데 전정-교감반사가 피드포워드방식으로 1차적으로 대응하며, 압력반사가 피드백 방식으로 추가적이고 안정적으로 혈압을 조정한다. 예를 들면 기립에 의해 체액이 몸의 하부로 치우치면 감소된 전부하와 심박출량을 보상하기 위해 전정-교감반사가 증가하여 혈관수축, 심장수축력 및 박동수 증가를 유도한다. 뒤이어 압력 반사가 부교감 출력을 줄이고 교감 출력을 증가시켜 혈압을 안정적으로 유지하게 된다. 만약 전정질환이 체위 변화가 없는 상태에서 잘못된 속도정보를 발생시키면, 이는 체액분포의 변화가 없는 상태에서 교감신경의 증가를 초래하고 혈압의 과도한 상승은 압력 반사의 부교감 출력증가를 초래하여 혈압저하 및 실신을 유발할 수 있다(Fig. 3). 또한 전정실신의 유발원인은 이석기관의 장애 외에도 반고리관의 장애와 중추신경계 병변에 의해서도 발생할 수 있음이 제시되었다[55].
결 론
전정계와 자율신경계는 밀접한 해부학적 연결을 가지고 상호작용을 한다. 이러한 연결의 기능적 의미를 이해하고 더불어 중추전정계가 작동하는 원리를 이해한다면, 현재의 검사로는 규명할 수 없는 전정질환에서의 자율신경 증상을 진단하고 치료하는 데 도움을 받을 수 있을 것이다. 이를 위해 전정질환, 특히 중추신경계를 침범하는 질환에서 전정계 이상과 자율신경 증상을 규명하고 치료하기 위한 연구가 필요하다.