임상 추론: 좌안의 시력저하와 통증으로 내원한 24세 여자
A 24-Year-Old Woman Presenting with Decreased Visual Acuity and Pain on Left Eye
Article information
증 례
24세 여자가 1주 전부터 악화된 좌안의 시력저하와 통증으로 안과에 내원하였다. 시력저하는 빛을 인지하지 못할 정도로 심했으며 안구를 움직일 때 통증을 동반하였다. 좌안 안저검사에서 시신경유두부종 및 출혈이 있었다. 고용량 스테로이드 정맥주사(1 g/daily)로 3일간 치료받고 1달 뒤 교정시력 1.0까지 회복되었고 당시 시행한 뇌 자기공명영상에서 뇌 병변은 보이지 않았다.
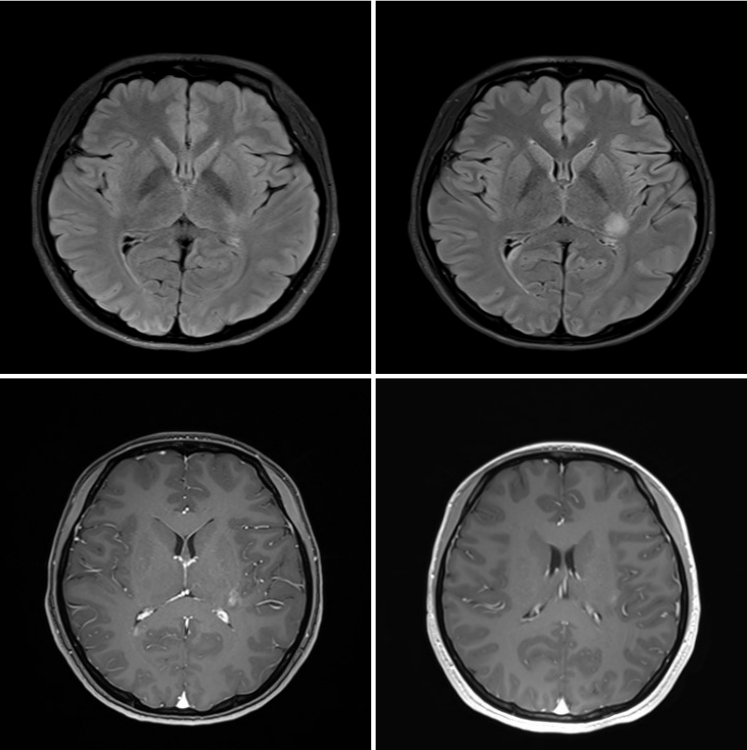
2년 뒤 우측 하지의 감각저하 및 저림이 발생하고 2주간 증상이 더 심화되어 우측 반신 감각저하 및 저림으로 신경과에 내원하였으며 시행한 뇌 자기공명영상에서 좌측 시상과 우측 뇌량 부위의 병변이 관찰되었다(Fig. 1). 당시 시행한 뇌척수액검사에서 백혈구, 단백질 수치는 정상이었고 IgG지수는 0.47, isoelectrofocusing (IEF) 방법으로 시행하지 않은 올리고클로날밴드(oligoclonal band) 검사 결과는 음성을 보였다. 생세포기반검사(live cell based assay)로 시행한 aquaporin-4 (AQP4) 항체검사도 음성을 보였다[1]. 다발성경화증 진단 하에 고용량 정맥 스테로이드 치료(1 g/daily)를 5일간 받고 증상은 완전히 호전되었다. 1개월 뒤 다시 좌측 하지에 감각저하가 있어 신경과를 내원하였고 척수 자기공명영상촬영을 시행하였으나 척수내 병변은 보이지 않았다. 뇌 자기공명영상촬영도 다시 시행하였으나 이전과 비교하였을 때 변화 소견은 보이지 않아 재발하지는 않은 것으로 평가하고 급성기 치료는 시행하지 않았다. 이 때부터 재발 방지 목적으로 인터페론베타를 처방받아 투약하였다.

Right corpus callosal and left thalamic T2 high signal lesions with gadolinium enhancement on brain magnetic resonance imaging.
질문 1. 환자의 감별진단은?
환자는 첫 증상으로 급성 단안 시력저하 증상을 경험하였고 스테로이드 투약 후 회복되었으나 이후 아급성 반신의 감각이상 증상을 보여 신경학적 증상의 악화와 완화를 경험하였다. 시신경염, 반신을 포함한 감각이상 증상과 더불어 이를 설명할 수 있는 뇌자기공명영상촬영 이상 소견으로 중추신경계 염증질환을 추정할 수 있었다. 이러한 임상 양상을 보일 수 있는 중추신경계 염증질환으로는 다발성경화증, AQP4 항체양성 시신경척수염범주질환 그리고 최근 독립된 질환으로 정립된 수초 희소돌기아교세포 당단백질(myelin oligodendrocyte glycoprotein, MOG)항체연관질환이 있다[2].
환자는 급성 단안 시력저하와 아급성 감각이상 증상을 바탕으로 다발성경화증으로 진단되었다. 그러나 환자의 단안 시력저하가 빛을 인지하지 못할 정도로 심했던 것은 임상적으로 다발성경화증에 전형적이지 않았고, 뇌 자기공명영상 소견 역시 전형적인 다발성 경화증 양상인 측뇌실 주변의 타원형(ovoid) 병변 혹은 도슨 손가락 병변(Dawson’s finger lesion) 등의 소견에 합당하지 않았다[2,3]. 이러한 면을 고려할 때 감별이 필요한 질환으로는 AQP4항체양성 시신경척수염범주질환 및 MOG항체연관질환이 있다.
질문 2. 진단에 필요한 추가 검사는?
첫 진단에서 감별에 필요한 MOG항체검사가 시행되지 않아 신뢰도 높은 생세포기반분석으로 시행한 MOG항체검사가 추가되어야 할 것이다[4]. 또한 다발성경화증의 감별을 위해 시행한 올리고클로날밴드검사는 검사 방법에 따라 결과의 신뢰도가 달라질 수 있는 검사로 IEF 방식으로 시행한 올리고클로날밴드검사가 추가되어야 한다[5].
이전 재발로부터 9개월 뒤 다시 우측 하지 감각저하 및 저림 증상이 발생하고 2주 이상 지속되어 시행한 뇌 자기공명영상에서 조영증강이 되는 좌측 시상 병변이 보였으나(Fig. 2), 척수 자기공명영상촬영상 척수내 병변은 보이지 않았다. 정맥 고용량 스테로이드 치료(1 g/daily)를 5일간 받고 증상은 완전히 호전되었으며 인터페론베타 치료를 지속하였다.
Left thalamic T2 high signal lesion with subtle gadolinium enhancement on brain magnetic esonance imaging.
2개월 뒤 재발 빈도가 잦아지는 것을 우려하여 이차 의견을 구하기 위해 상급 병원에 내원하였고, IEF 방식으로 시행한 올리고 클로날밴드검사는 음성 소견을 보였으며 MOG항체 생세포기반검사는 양성 소견을 보였다. MOG항체연관질환 진단 하에 기존에 투약하였던 인터페론베타는 중단하였고 mycophenolate mofetil을 투약하기 시작하여 매일 2 g 유지 중이며 2년여 동안 재발 없이 안정적으로 지내고 있다.
질문 3. 환자의 진단은?
환자는 신뢰도 높은 live cell을 바탕으로 한 MOG항체 세포기반검사에서 양성 소견을 보여 MOG항체연관질환으로 진단하였다. 성인 환자가 시신경염을 첫 증상으로 발현하였고 안저검사에서 시신경유두부종 및 출혈 소견을 보였으며 급성기 스테로이드 치료에 잘 반응하여 완전한 회복을 보였고 뇌 자기공명영상촬영에서 뇌량과 깊은 회색질인 시상을 침범하였던 것이 MOG항체연관질환의 임상적, 영상의학적 소견에 합당하였다[2-4].
질문 4. 적절한 재발 방지 치료는?
다발성경화증의 치료제인 인터페론베타의 경우 MOG항체연관질환 환자의 재발률을 낮추는 데 도움이 되지 않는 것으로 보고되어 환자의 경우 치료제의 전환이 필요하였다[6].
MOG항체연관질환의 재발 방지 치료는 아직 임상시험 등을 바탕으로 한 높은 수준의 근거는 부족한 상태이나 임상적 경험을 바탕으로 한 결과들을 통해서 면역억제 치료가 도움됨이 보고되었다[7-9]. 환자는 이러한 면역억제 치료제 중 하나인 mycophenolate mofetil을 투약하기 시작하였으며 2년여 동안 재발 없이 안정적으로 지내고 있다.
토 의
MOG항체연관질환은 다발성경화증이나 AQP4항체양성 시신경척수염범주질환과 일부 임상적 양상을 공유하지만 병태생리학적인 차이점들이 확인되면서 다른 질환군으로 분리되었다[2]. MOG항체연관질환은 일차적으로 astrocyte를 표적으로 하는 AQP4항체양성 시신경척수염범주질환과는 달리 일차적으로 탈수초성(demyelination) 질환이며 병변에서 주로 cluster of differentiation (CD) 4+ T cell이 발견되는 것이 CD8+ T cell이 주로 발견되는 다발성경화증과의 차이점이다[10,11].
환자의 급성 단안 시력저하는 빛을 인지하지 못 할 정도로 심했으나 급성기 치료인 고용량 스테로이드 치료에 잘 반응하여 1.0까지 호전되는 소견을 보였다. 급성기 스테로이드 치료에 잘 반응하는 것이 MOG항체연관질환의 특성 중 하나이다[7-9]. 또한 시신경염 발현시 안저검사 소견에서 시신경유두부종 및 출혈이 있었던 것은 MOG항체연관질환에서 자주 보이는 소견이다[12]. 그리고 시신경염이 있었던 첫 증상 발현시 뇌 자기공명영상촬영에서 뇌 병변이 없었던 것과 뇌 병변의 경계가 불명확하며 시상을 포함한 깊은 회색질을 침범한 것은 다발성경화증과는 다른 면이었다[3]. MOG항체연관질환에서 상대적으로 빈번한 임상적, 영상의학적 특징은 다음의 Table에 정리되어 있다[2-4,7,9,12].
진단을 위한 항체검사는 신뢰도 높은 검사 방법인 생세포기반분석을 선택하는 것이 중요하며 필요시 반복검사를 고려하는 것도 중요하다[13]. 한 번의 검사에서 음성이 나오더라도 검체가 급성기 치료인 스테로이드 등에 영향을 받았을 경우 위음성이 나오는 경우가 있고 재발 시에는 양성을 보이는 경우가 더 많아 가능하다면 재발시 급성기 치료 전 검체로 항체검사를 반복적으로 시행하는 것이 필요하다[14].
MOG항체연관질환의 치료는 급성기에는 다른 중추신경계 염증성질환과 같이 고용량 스테로이드나 혈장교환술, 면역글로불린 치료를 시행할 수 있다[7-9]. 재발 방지를 위한 치료는 면역억제 치료가 효과를 나타내는 것이 보고되었으나 아직 임상시험 등을 통한 근거가 더 마련되어야 하며 현재 이러한 임상시험이 진행 중이다[7-9]. 일부 임상적 경험을 통한 보고에서 mycophenolate mofetil, rituximab, tocilizumab, 면역글로불린정맥주사(intravenous immunoglobulin) 등의 효과가 보고되었다[6,8,9,15,16]. 그러나 일부 다발성경화증 치료제(인터페론베타 혹은 나탈리주맙)의 경우 MOG항체연관질환의 재발률을 낮추는 데 도움이 되지 못하는 경우들이 보고되고 있어 정확한 감별 진단 후 치료제를 결정하는 것이 필수적이다[6,9,15].
KEY POINTS
1. MOG항체연관질환과 일부 임상 양상을 공유하지만 반드시 감별이 필요한 다발성경화증과 AQP4항체양성 시신경척수염범주질환과 구분되는 임상 양상 및 영상 소견을 숙지해야 한다.
2. MOG항체연관질환이 의심되는 환자에서는 신뢰도 높은 방법인 생세포기반분석으로 MOG항체검사를 시행해야 하며, 시행 당시 재발 여부나 치료제 투약 여부 등의 상태에 따라 결과 해석에 유의해야 한다.
3. MOG항체연관질환 환자에서의 치료는 아직 임상시험이 진행 중으로 표준화된 치료가 정립되지 않았으나, 임상적으로 재발이 있고 질환의 중증도가 높으며 MOG항체가 지속적으로 양성이 나오는 경우 재발 방지를 위한 면역억제 치료가 필요하다.
