기얭-바레증후군은 말초신경의 급성염증질환으로 상기도 감염이나 장염 등의 선행 감염 후 발생하는 경우가 많다[1]. 병리와 해부학적 침범 부위에 따라 다양한 아형이 존재하는데 상행마비를 보이는 전형적인 급성염증탈수초다발신경병이나 운동신경을 주로 침범하는 급성운동축삭신경병 등이 대표적이다[1,2]. 특히 급성운동 축삭신경병에서 캄필로박터균과 분자동일성을 보이는 강글리오사이드가 항원으로 작동해 면역교차반응을 일으켜 랑비에결절주변 부위에 염증손상을 일으킨다는 사실이 실험적으로도 증명되었다[1-3]. 하지만 급성염증탈수초다발신경병에서 아직까지 특정 병원 인자와 강글리오사이드 자가항체의 연관성은 잘 알려져 있지 않다. 저자들은 최근 시가독소생성대장균(shiga toxin-producing Escherichia coli, STEC)과 장독소대장균(enterotoxigenic Escherichia coli, ETEC)에 의한 장염 이후 발생한 급성염증탈수초다발신경병 증례를 경험하였고 이 증례는 GM1과 포스파티딘산에 복합항체에 양성반응을 보였다.
증 례
65세 여자가 이틀 전부터 갑자기 사지쇠약이 발생하였다. 일주일전 3회가량의 설사를 하였고, 이틀 전 잠을 자고 일어나던 중 양측 하지에 근력저하가 발생하였다. 하루 전부터는 양측 상지에도 쇠약을 호소하였다.
혈압, 맥박, 호흡, 체온은 정상이었고 과거병력 및 약물병력에서 특이 사항은 없었다. 신경계진찰에서 양하지 근력은 Medical Research Council (MRC) 3등급이었고 양측 상지근력은 MRC 4등급이었다. 감각이상은 없었고 양측 사지의 깊은힘줄반사가 전반적으로 떨어져 있었으며 바뱅스키반사를 포함한 위운동신경세포병터징후는 보이지 않았다.
일반혈액검사, 혈액화학검사, 일반소변검사, 요화학검사는 모두 정상범위였다. 뇌척수액검사에서 백혈구는 없었고, 단백질은 31.0 mg/dL, 포도당 67 mg/dL (혈청 116)로 모두 정상범위였다. 대변에서 시행한 세균성 급성설사 선별검사 중합효소사슬반응에서 STEC와 ETEC가 양성이었고 이질, 캄필로박터, 살모넬라, 비브리오, 플레시모나스, 예르시니아 균들은 모두 음성이었다.
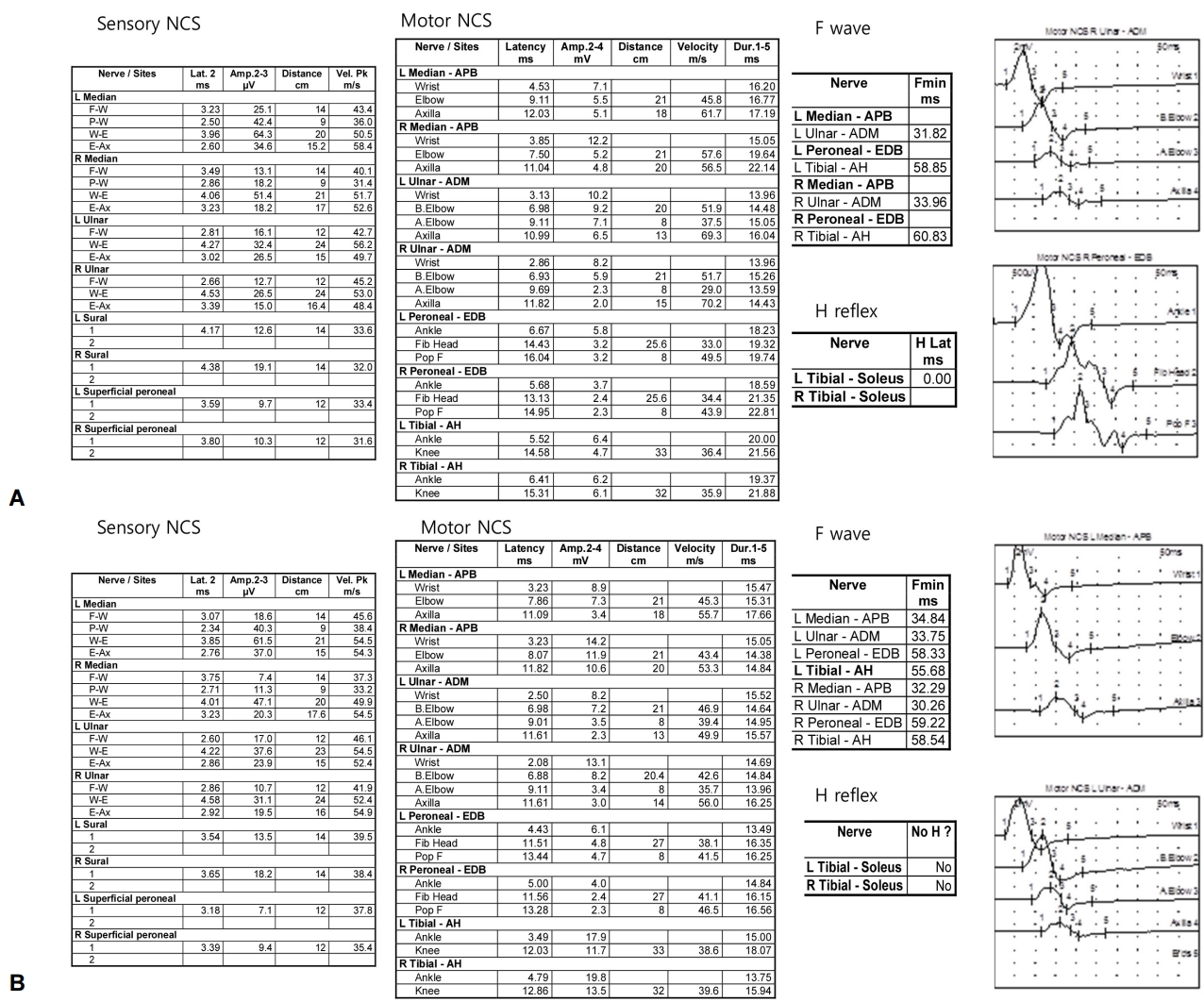
감각신경전도검사에서 감각신경활동전위의 진폭은 모두 정상 범위였고 우측 정중신경, 양측 장딴지신경, 우측 얕은종아리신경의 전도속도가 저하되어 있었다. 운동신경신경전도검사에서 복합근육활동전위의 진폭은 모두 정상범위였고 양측 정중신경, 자신경, 종아리신경, 뒤정강신경의 말단잠복기가 연장되었고 전도속도가 저하되어 있었으며 양측 정중신경, 자신경, 종아리신경에서 전도차단이 보여 신경생리검사로 급성염증탈수초다발신경병 형태의 기얭-바레증후군으로 진단할 수 있었다(Fig. A). 6주 후 시행한 신경전도검사에서는 우측 정중신경에서 손가락-손목 구간에서 감각신경활동전위의 진폭이 감소되었고 손가락-팔꿈치, 손바닥-팔꿈치 구간에서 감각신경 전도속도가 느려져 있었으며 양측 상하지 운동신경에서 전도속도의 감소가 보이고 양측 정중신경, 자신경, 종아리 신경에서 전도차단이 지속적으로 보였다(Fig. B).
혈청 항강글리오사이드항체 검사에서 항GM1, 항GM2, 항GD1a, 항GD1b, 항GD3, 항GT1a, 항GT1b, 항GQ1b는 모두 음성이었고 GM1과 포스파티딘산에 대한 복합항체가 양성이었다.
입원 직후 면역글로불린을 kg당 2,000 mg으로 5일간 투약하며 물리 치료를 시작하였고, 12주 후 사지근력은 모두 정상으로 회복되었고 사지의 깊은힘줄반사도 정상으로 회복되었다.
고 찰
이 증례는 STEC와 ETEC에 의한 설사 후 발생한 기얭-바레증후군으로 GM1을 포함한 여러 강글리오사이드 항체에서는 음성반응을 보이면서 GM1-포스파티딘산의 복합항체에서만 양성반응을 보였던 흥미로운 증례다.
캄필로박터균에 의한 장염은 기얭-바레증후군의 30% 정도를 차지할 정도로 많이 보고되었고 캄필로박터 외핵의 지방소당 성분이 GM1이나 GD1a와 유사한 분자구조를 보여 면역학적 교차반응이 랑비에결절과 주변부위에서 발생하면서 주로 축삭변성 형태의 기얭-바레증후군을 일으키는 것이 증명되었다[1-3]. 캄필로박터제주니 외에도 인플루엔자균, 폐렴마이코플라즈마, 엡스타인-바바이러스, 거대세포바이러스, 지카바이러스, B형 그리고 C형 간염바이러스 등이 다양한 형태의 선행 감염을 일으키면서 기얭-바레증후군과 연관되어 있음이 보고 되었지만 연관된 자가항체나 병인은 아직까지 잘 알려져 있지 않다[1,4-6]. 본 증례는 두 번의 신경전도검사를 통해 축삭변성보다는 탈초 형태의 기얭-바레증후군에 가깝다는 것을 알 수 있었는데 신경생리학적으로 Ho 혹은 Hadden 기준에는 합당하지만 Rajabally 기준에는 부합하였다[7]. 6주 후 시행한 신경전도검사에서 전도차단이 지속적으로 보여 가역전도차단을 보이는 급성운동축삭신경병의 가능성은 떨어져 보였다.
ETEC, STEC는 캄필로박터제주니처럼 그람음성 균주로 가축을 포함한 동물의 장에 살고 있으면서 숙주에는 해를 주지 않지만 사람에게는 장염이나 요로감염을 일으킬 수 있다. 대장균의 외핵에도 지방소당이 존재하며 여기에 가지모양세포의 톨(toll) 유사수용체 2와 4가 결합해 nuclear factor-κB를 활성화하여 면역반응이 시작되는데 이는 캄필로박터제주니의 감염 후 발생하는 면역반응과 비슷하다[8]. 캄필로박터제주니 감염 후 immunoglobulin (Ig) G, IgA 항체가 캄필로박터제주니 세포벽의 지방소당에 대응하여 형성되는데 드물게 몇몇 사람들에게는 말초신경의 강글리오사이드의 다양한 항원결정부위와 면역교차반응이 일어나 기얭-바레증후군을 일으키는 것으로 알려져 있다[1-6,8]. 이와 연관된 항-강글리오사이드 자가항체로는 GM1, GD1a, GT1a, GQ1b 등이 있다. 아직까지 ETEC, STEC 같은 대장균과 연관된 항-강글리오사이드항체는 잘 알려져 있지 않았는데 본 증례에서는 IgG GM1-포스파티딘산 복합항체가 검출되었다. 최근 손가락처짐을 주증상으로 발병한 8명의 기얭-바레증후군 증례연구에서 7개의 증례에서 GM1-포스파티딘산 복합항체가 양성임이 발견되었고 이 중 두 증례에서는 GM1 단독항체는 음성반응을 보이면서 GM1-포스파티딘산 복합항체에서만 양성을 보였다[9]. 이 연구에서 총 8명 중 5명에서 혈청 캄필로박터 항원 양성이 발견되었지만 ETEC, STEC 감염 여부는 확인되지 않았다.
최근 장염을 보이는 환자들의 원인균을 선별 확인하기 위해 몇몇 균주에 대한 중합효소사슬반응검사가 상업적으로 나와있는데 기얭-바레증후군의 선행 감염 원인을 찾을 때 대변의 배양검사나 혈청의 항체검사보다 민감도를 높일 수 있을 것으로 기대된다. 아직까지 ETEC와 STEC의 지방소당이 GM1-포스파티딘산의 복합 항원과 어떤 분자구조적 유사성을 보이는지는 잘 알려져 있지 않지만 이에 대한 후속 연구가 대장균 감염 후 발생하는 기얭-바레증후군의 병태생리를 밝히는 데 큰 도움을 줄 수 있을 것으로 기대한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




