| J Korean Neurol Assoc > Volume 40(2); 2022 > Article |
|
Abstract
The phosphorylated 43-kDa transactive response DNA-binding protein (TDP-43) was identified as a major disease protein in sporadic amyotrophic lateral sclerosis (ALS) and frontotemporal lobar degeneration. We present a case with progressive muscle weakness who was diagnosed with sporadic ALS. On postmortem examination, TDP-43 immunoreactive neuronal cytoplasmic inclusions were noted in motor cortex, hippocampus and anterior horns of spinal cord, which was compatible with ALS-TDP, stage 4. This is the first documented autopsy-confirmed ALS case with ALS-TDP pathology in Korea.
근위축측삭경화증(amyotrophic lateral sclerosis, ALS)은 위아래운동신경세포의 점진적인 퇴행으로 근위약과 근위축이 발생하는 대표적인 운동신경세포질환이다. 증상 발생 3-5년 내에 호흡근마비로 대부분 사망하고, 현재 확실한 치료법은 없다[1]. 그러나 2006년 ALS 환자의 운동신경세포의 세포질에서 과인산화된 transactive response DNA binding protein-43 (TDP-43)이 발견되면서, ALS 병인에서의 TPD-43 역할에 대한 많은 연구들이 진행되고 있다. 저자들은 국내 최초로 ALS-TDP 병리조직진단이 확정된 ALS 환자를 보고하고자 한다.
27세 남자가 양측 상지에 점차 힘이 빠지는 증상으로 신경과를 방문하였다. 5개월 전부터 우측 팔의 힘이 약해져 젓가락질을 할 때 팔이 떨리는 느낌이 들었고, 점차 수저질과 글씨 쓰기가 불편해졌다. 1개월 전부터는 좌측 팔에도 힘이 빠져 팔굽혀펴기가 힘들어졌다. 간헐적으로 사지근육 여기저기가 불수의적으로 튀는 느낌이 있었고, 양손에 근육 위축이 생겼다. 특이 과거력과 약물 복용력은 없었고, 혈액검사 결과는 정상이었다. 신경계진찰에서 조음장애, 삼킴곤란, 혀의 근섬유다발수축과 위축은 없었다. 우측 상지 근력 등급은 Medical Research Council 4, 좌측 상지 근력 등급은 4+였으며 양 하지의 근력저하는 없었다. 양 상지에서 근위축이 확인되었다. 감각저하나 이상 감각은 없었다. 좌측 위팔두갈래근의 깊은 힘줄반사가 항진되어 있었으나 그 외 다른 근육의 깊은힘줄반사는 정상적이었고 병적반사는 없었다. 경추 자기공명영상에서 경추 3-4번, 경추 4-5번 영역의 추간판돌출과 경미한 척수압박 소견이 있었다(Fig. 1-A). 신경전도검사는 정상이었고 침근전도검사에서 우측 상하지와 흉요추부 척추곁근육에 광범위한 탈신경 및 신경재분포전위가 관찰되었다. 유사 증상의 가족력은 없었고, 척수근위축증과 숨뇌척수근위축증의 감별을 위해 시행한 SMN1, SMN2 유전자변이 검사와 안드로젠수용체(androgen receptor) 유전자삼염기 반복검사에서 이상 소견은 없었다. 인지장애는 없었고(간이정신상태검사 28점), 뇌 자기공명영상 결과는 정상이었다(Fig. 1-B). 상기 소견을 종합하여 ALS로 임상적으로 진단하고 경과를 관찰하였다. 진단 2개월 후부터 양 하지 쇠약이 발생하여 걸을 때 다리가 끌렸고, 앉았다 일어서기가 힘들어졌다. 증상 발생 1년 후에는 간헐적으로 사레가 들렸고, 1년 6개월이 지난 무렵부터는 걸을 수가 없어서 침상생활을 하였다. 증상 발생 2년 후 호흡저하로 응급실을 방문하여 비침습양압환기 치료를 받았고, 이로부터 2년 후 기관절개술과 피부경유내시경위창냄술을 시행받았다. 이후부터 가정용 인공호흡기를 단 상태로 집에서 요양하였고, 증상 발생 10년째, 환자 나이 37세로 사망하였다.
사후 7시간 40분만에 뇌와 척수를 적출하였고 뇌 무게는 1,325 g(우: 552 g, 좌: 547 g)이었다. 육안으로 볼 때 대뇌피질의 위축이나 바닥핵, 시상, 해마, 뇌줄기, 소뇌에 이상은 없었으나 척수가 심하게 위축되어 척수 직경(경수: 1.1 cm, 흉수: 0.7 cm, 요수: 0.8 cm, 천수: 0.5 cm)이 정상 남성의 척수 직경(목경부팽대: 1.62 cm, 가슴척수: 1.38 cm, 요천추팽대: 1.94 cm)에 비해 확연하게 작았다(Fig. 2) [2].
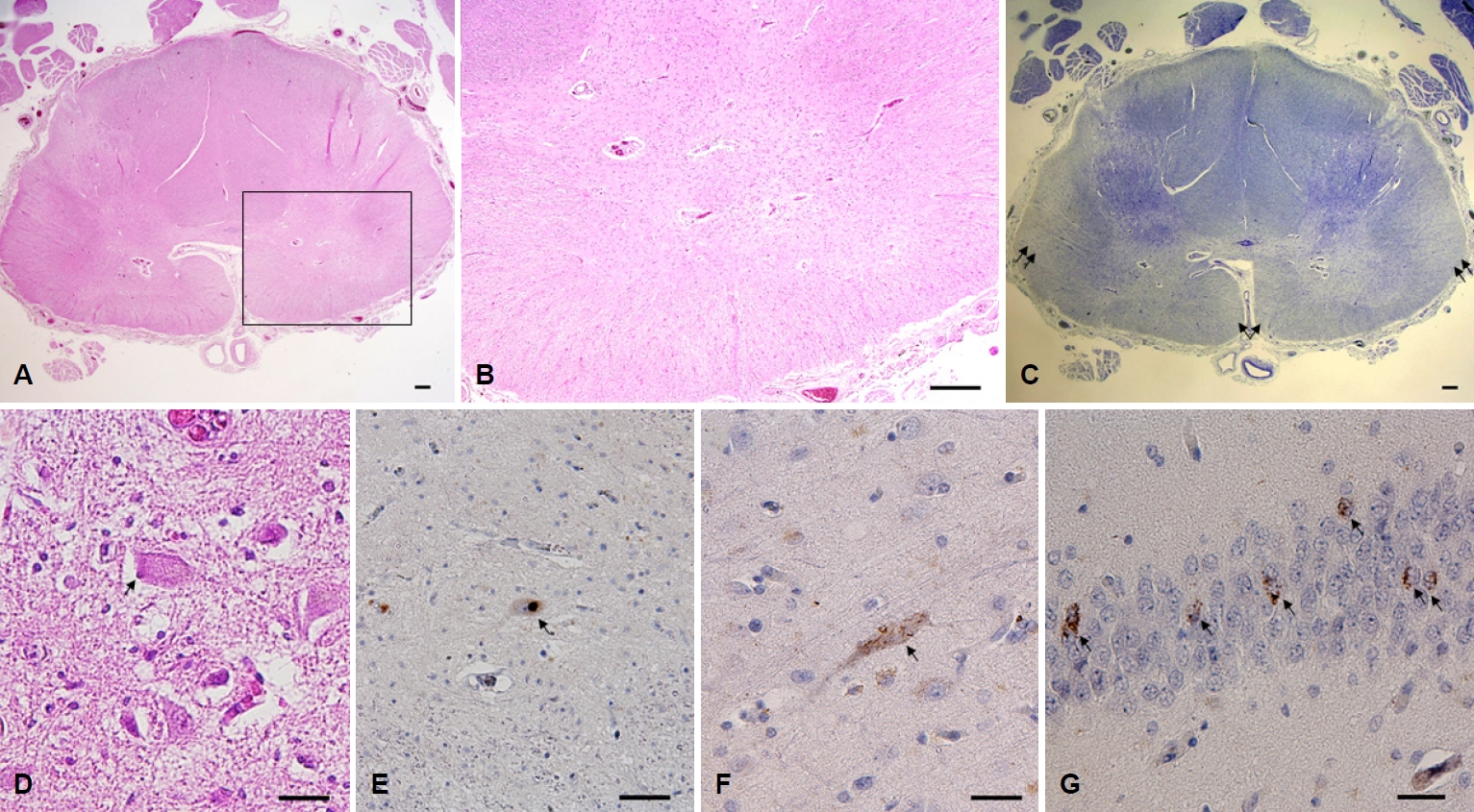
헤마톡실린-에오신(hematoxylin-eosin, HE)염색을 하여 광학현미경으로 관찰하였을 때, 경부, 흉부, 요천부 척수의 척수가쪽기둥, 앞쪽기둥의 피질척수로에서 신경아교증이 심하였고 앞뿔에서 운동신경세포가 거의 관찰되지 않았으며(Fig. 3-A, B), Luxol fast blue염색에서 척수가쪽기둥과 피질척수로의 퇴행이 확인되었다(Fig. 3-C). 뇌줄기 운동신경세포 일부에서 Bunina소체가 확인되었고(Fig. 3-D), 극소수 남아 있는 척수앞뿔운동신경세포에서 TDP-43염색 양성을 보이는 비정상 TDP-43신경세포질봉입소체가 확인되었다(Fig. 3-E). 대뇌 운동피질은 HE염색에서 신경퇴행 변화가 심하지 않았으나 TDP-43면역조직화학염색에서 비정상TDP-43 신경세포질봉입소체가 베츠세포(Betz cell)를 포함한 많은 신경세포에서 보였고 TDP-43염색에 양성인 디스트로피신경돌기가 드물게 관찰되었다(Fig. 3-F). 중간전두이랑, 바닥핵, 해마의 치과립세포와 암몬각 영역에서도 중등도의 비정상TDP-43신경세포질봉입소체가 확인되었다(Fig. 3-G). 따라서, 대뇌 운동피질과 척수뿐만 아니라 전두엽, 바닥핵, 해마까지 TDP-43 침착을 보여 ALS-TDP 4단계에 해당하였다. 그 외 베타아밀로이드염색, 타우염색, 시누클레인염색에서 비정상단백질의 침착은 관찰되지 않았다.
사망 후 실시한 전체엑솜분석에서 전두측두엽치매, ALS, 기타 치매관련 비정상상 돌연변이는 없었고, C9orf72 유전자의 비정상 헥사뉴클레오타이드의 반복확장도 없었다.
본 증례의 환자는 우측 상지에서 시작하여 전신으로 진행하는 근 위약과 위축이 있었고, 우측 상지에서 깊은힘줄반사의 항진이 관찰되어 국소 부위의 위운동신경세포 징후를 보였다. 침근전도검사에서도 광범위한 탈신경전위가 확인되어 운동신경세포질환에 합당하였다. 혈액검사와 뇌/척수영상검사에서 이상은 없었고, 유전자검사로 젊은 나이에 발병하는 유전질환인 척수근위축증과 숨뇌척수근위축증을 배제할 수 있었다. 이를 종합하여, El Escorial 진단기준에 따라 임상추정검사지지(clinically probable - laboratory supported) ALS로 진단하였다[2]. 본 환자는 증상 발생에서 사망까지의 기간이 10년으로 ALS 환자의 평균 유병 기간(3-5년)에 비해 비교적 긴 경과를 보였다. 산발ALS의 경우 호발연령은 58-63세이고 가족성ALS의 경우 47-52세로 상대적으로 발병연령이 낮다[3]. 환자는 27세의 어린 나이에 발병하였고 긴 경과를 보여 가족성 ALS 가능성도 염두에 두었으나, 가족력이 없었고, 사망 후 실시한 유전자검사에서 ALS관련 돌연변이는 없어서 산발ALS에 해당한다.
ALS의 주된 병리 소견은 뇌, 척수의 운동신경세포와 척수가쪽 기둥, 앞쪽기둥의 피질척수로의 신경퇴행이다. 즉, 대뇌피질의 베츠세포, 뇌줄기, 척수앞뿔의 운동신경세포 수와 크기가 감소하고, 공포형성과 해면화를 동반한다. 별아교세포와 미세아교세포가 증가하고 특징적인 호산구신경세포봉입소체인 Bunina소체를 관찰할 수 있다. 또한 척수 가쪽과 앞쪽기둥 피질척수로에서도 축삭의 소실을 확인할 수 있다[4]. 분자병리학적으로는 산발성인지, 가족성인지 그리고 가족성이라도 어떤 유전자변이를 가지는지에 따라 다른 소견을 보인다. ALS의 약 90%에 해당하는 산발성의 경우, 대부분에서 운동신경세포 세포질 내에 인산화TDP-43염색에서 양성을 보이는 비정상TDP-43 침착이 확인되는데, 이를 ALS-TDP병리로 분류한다[4]. TDP-43은 414개의 아미노산으로 이루어진 핵 단백질로 그 기능에 대해서는 아직 충분히 알려져 있지 않지만 유전자 발현 조절에서 다양한 역할을 수행하는 것으로 여긴다[5]. 일부 가족성 ALS 환자의 경우에도 비정상TDP-43신경세포질봉입소체가 관찰되었으나 SOD1 유전자변이 가족성ALS에서는 TDP-43염색에 음성인 SOD1단백의 침착이, FUS 유전자 변이와 관련된 경우 FUS 양성이면서 TDP-43음성인 봉입소체가 발견된다[4]. 전체 가족성 ALS의 약 50%를 차지하는 C9orf72 유전자 반복확장이 있을 경우에는 TDP신경세포질봉입소체 외에도, repeat-associated non-ATG (RAN)의 전사과정에서 만들어진 다이펩타이드반복단백질(dipeptide repeat proteins)과 RNA중심(foci)이 특징적으로 확인된다[4]. ALS-TDP병리는 해부학적 분포에 따라 4단계로 나눈다[6]. 1단계는 운동피질, 뇌줄기의 XII, VII, V번 운동신경핵, 척수의 운동신경을 침범한 경우다. 중앙 전두이랑, 뇌줄기의 그물체, 전소뇌핵, 적핵까지 침범할 경우 2단계로, 전전두엽피질, 중심뒤피질, 줄무늬체, 바닥핵까지 침범하는 경우 3단계로 한다. 측두엽과 해마까지 침범하면 4단계가 된다. 환자는 척수의 퇴행 변화는 굉장히 심하였으나, 대뇌운동피질(중심앞이랑)의 신경퇴행 변화는 심하지 않았다. 하지만 위운동신경세포에 해당하는 중심앞이랑의 운동신경세포와 아래운동신경세포에 해당하는 척수앞뿔의 운동신경세포 모두에서, 비정상TDP-43신경세포질봉입소체가 확인되어 ALS-TDP병리로 확진할 수 있었고, 해마까지 침범하여 4단계로 진단하였다. ALS-TDP병리단계와 임상증상과의 연관성에 대해서는 더 연구가 필요하다. ALS-TDP병리는 해부학적 분포에서 전두측두엽변성(frontotemporal lobar degeneration, FTLD)-TDP병리와 차이가 있다. 즉, ALS-TDP병리에서 비정상TDP-43신경세포질봉입소체는 운동피질, 척수, 바닥핵에 현저히 존재하는 반면 FTLD-TDP는 전두측두엽 피질에 많이 분포한다.
Acknowledgements
치매 연구를 위해 부산대학교병원 뇌은행에 뇌를 기증해주신 환자와 보호자분께 진심으로 감사의 말씀을 올립니다. 부산대학교병원 뇌은행 업무 전반에 걸쳐 도움을 주신 이혜인 선생님께도 감사 드립니다
REFERENCES
2. Brooks BR, Miller RG, Swash M, Munsat TL; World Federation of Neurology Research Group on Motor Neuron Diseases. El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotroph Lateral Scler Other Motor Neuron Disord 2000;1:293-299.


3. Logroscino G, Traynor BJ, Hardiman O, Chio A, Mitchell D, Swingler RJ, et al. Incidence of amyotrophic lateral sclerosis in Europe. J Neurol Neurosurg Psychiatry 2010;81:385-390.


4. Saberi S, Stauffer JE, Schulte DJ, Ravits J. Neuropathology of amyotrophic lateral sclerosis and its variants. Neurol Clin 2015;33:855-876.



5. Kawakami I, Arai T, Hasegawa M. The basis of clinicopathological heterogeneity in TDP-43 proteinopathy. Acta Neuropathol 2019;138:751-770.



6. Brettschneider J, Del Tredici K, Toledo JB, Robinson JL, Irwin DJ, Grossman M, et al. Stages of pTDP-43 pathology in amyotrophic lateral sclerosis. Ann Neurol 2013;74:20-38.



7. Ha SH, Baek WK, Kim HY, Noh MY, Hwang SJ, Kim SH. An autopsy case of amyotrophic lateral aclerosis with neuroinflammatory change. J Korean Neurol Assoc 2012;30:128-131.
Figure 1.
(A) Sagittal T2-weighted spinal magnetic resonance imaging (MRI) shows mild disc protrusion in C3-C4 and C4-C5 levels. (B) Brain MRI shows no abnormal findings.
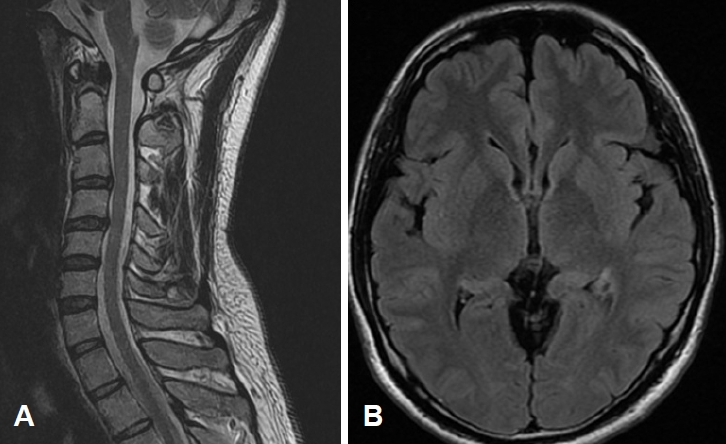
Figure 2.
(A) Grossly, there was no definite cortical and subcortical atrophy. Cervicothoracic (upper row) and thoracolumbosacral (lower row) spinal cords show atrophy and grayish discoloration. (B) Cauda equina is thin.
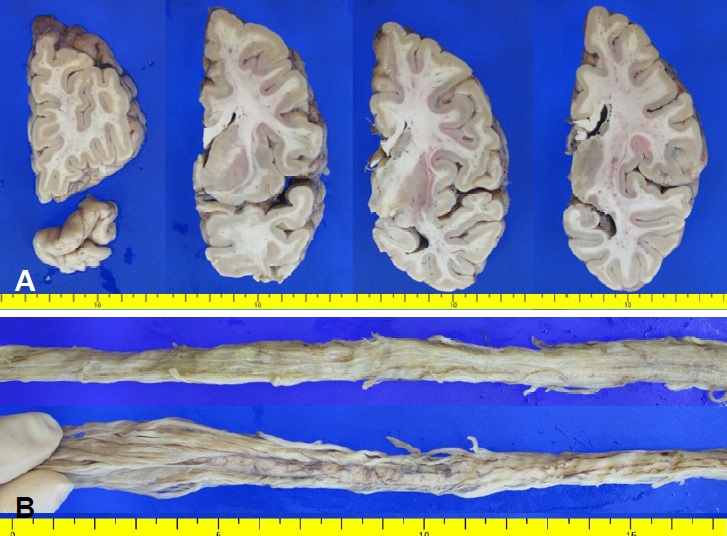
Figure 3.
(A) A section from thoracic cord shows severe degeneration of corticospinal tracts and anterior horns (H&E stain, scale bar=250 μm). (B) An enlarged picture of a rectangle area from (A) shows severe gliosis and neuronal loss (H&E stain, scale bar=250 μm). (C) Diffuse myelin pallor is seen in anterolateral columns including corticospinal tracts (arrows) (Luxol fast blue stain, scale bar=250 μm). (D) Bunina body (arrow) is observed in hypoglossal nucleus (H&E stain, scale bar=25 μm). TDP immunoreactive neuronal cytoplasmic inclusions (arrows) are seen in (E) a survived lower motor neuron of thoracic anterior horn, (F) motor neurons including a Betz cell of motor cortex, and (G) dentate granule cells of hippocampus (Phospho TDP stain, scale bar=25 μm).
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,111 View
- 47 Download
- Related articles
-
Amyotrophic Lateral Sclerosis Associated With CADASIL2013 ;31(3)
An Autopsy Case of Amyotrophic Lateral Sclerosis with Neuroinflammatory change2012 ;30(2)
Value of Needle Electromyography for the Diagnosis of Amyotrophic Lateral Sclerosis1998 ;16(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



