| J Korean Neurol Assoc > Volume 39(3); 2021 > Article |
|
Abstract
A 79-year-old man visited neurology clinic due to gait ataxia and vertigo for 10 months. Neurologic examination revealed saccadic pursuit, mild dysmetria, impaired tandem gait, and areflexia that recovers after exercise. The amplitude of compound muscle action potentials recorded on the abductor digiti minimi increased up to 6,639.4% during repetitive nerve stimulation at 50 Hz stimulation. This case demonstrates that clinicians should consider Lambert-Eaton myasthenic syndrome as a differential diagnosis when a patient complains of gait ataxia and vertigo.
램버트-이튼근무력증후군(Lambert-Eaton myasthenic syndrome, LEMS)은 근위부 근력 약화, 심부건반사 소실, 자율신경의 이상을 보이며 운동 후 심부건반사가 회복되는 특징이 있는 신경근육접합부 질환이다. 소세포폐암에서 발생할 수 있는 신생물딸림증후군 중 하나로 시냅스 전 P/Q형(type) 전압작동칼슘통로(voltage-gated calcium channel, VGCC)에 대한 항체가 90% 이상의 환자에서 관찰되며[1], 이로 인해 아세틸콜린 분비가 감소하여 증상이 발현된다고 알려져 있다. 소뇌에 P/Q형 VGCC가 존재하기 때문에 LEMS에서 소뇌실조 증상이 동반되는 보고들이 있었고, 최근 Mayo Clinic에서 소뇌실조 증상이 동반된 LEMS 환자를 분석해 보았을 때 24%의 환자에서 소뇌 실조가 초기 증상으로 발현하였다고 보고한 바가 있다[2]. 저자들은 현훈과 소뇌 실조가 주 증상인 LEMS 환자를 경험하였기에 이를 보고하는 바이다.
79세 남자가 10개월 전부터 걸을 때 균형을 잡기 힘들고 1개월 전부터 현훈을 호소하며 병원에 왔다. 기저질환으로 B형간염 보균자, 만성 폐쇄폐질환, 협심증이 있었으며 사지의 뚜렷한 근력 약화는 호소하지 않았다. 활력징후는 정상 범위였고, 신체검사에서 폐 청진을 하였을 때 천명 외에 특이 소견은 없었다. 신경계진찰에서 양측 상하지 근위부와 원위부에서 모두 Medical Research Council 5등급(grade 5)으로 정상이었으며 근위축은 관찰되지 않았다. 감각기능검사는 정상이었고, 심부건반사는 사지에서 대칭적으로 소실되어 있었다. 추종눈운동(pursuit) 진찰에서 톱니바퀴추종운동(saccadic pursuit)이 관찰되었고 신속보기검사(saccade test)에서는 이상이 관찰되지 않았다. 롬베르크(Romberg)검사에서 눈을 뜨거나 감을 때 모두 넘어지려는 경향이 있었고 소뇌기능검사로 손가락 코대기검사(finger-to-nose test)와 발꿈치정강이검사(heel-to-shin test)에서 목표물을 지나치거나 일정한 속도로 수행하지 못하는 경도의 양측 겨냥 이상을 보였다. 보행을 시켰을 때 불안정하며 불규칙한 보폭과 옆으로 쓰러지는 양상을 보였으며 일자보행을 시켰을 때에도 불안정하여 양측으로 쓰러지는 소뇌 실조를 보였다. 혈액검사에서 항핵항체(antinuclear antibodies)가 1:160으로 양성이었고 anti-SS-A/Ro항체가 양성이었다. Anti-Hu, anti-Yo, anti-Ri 등의 신생물딸림증후군 항체에서는 이상 소견이 관찰되지 않았다. 뇌 자기공명영상검사에서 소뇌 위축 등 환자의 증상을 유발할 만한 이상 소견은 관찰되지 않았으며, F-18-플루오로탈산소포도당(F-18-fluorodeoxyglucose) 양전자방출단층촬영(positron emission tomography)검사에서 소뇌의 포도당 대사량은 보존되어 있었다. 신경전도검사에서 복합근육활 동전위(compound muscle action potential)가 정상 아래 한계치와 비교할 때 정중신경에서 6.7%, 척골신경에서 3.8%, 비골신경에서 13.3%, 후경골신경에서 41.7% 수준으로 전반적인 감소가 보였으나 침근전도검사에서 신경병 또는 근육병 시사하는 소견은 관찰되지 않았다.
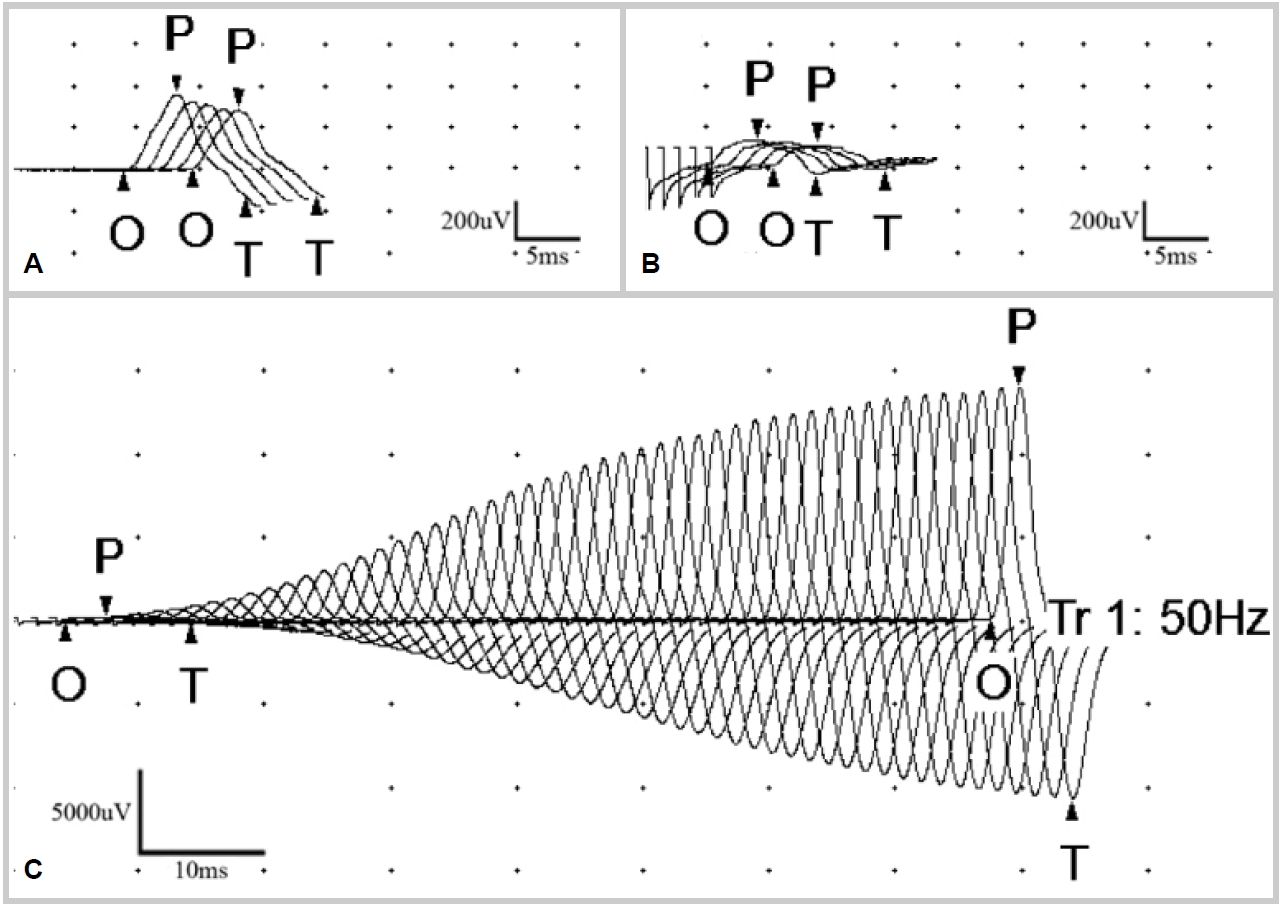
이후 다시 한 신경계진찰에서 운동유발 후 심부건반사가 회복되는 것(grade 0 → grade 2+)을 확인하였으며, 반복신경자극검사에서 3 Hz의 저빈도자극을 하였을 때 우측 새끼벌림근과 자쪽손목굽힘근에서 기록한 복합근육활동전위 진폭이 다섯 번째 자극에서 첫 번째 자극과 비교하여 각각 17.8%, 26.6% 감소하였다(Fig. A, B). 우측 새끼벌림근에서 기록한 50 Hz의 고빈도 자극에서는 첫 번째 복합근육활동전위 진폭이 0.37 mV, 마지막 자극의 진폭이 24.78 mV로 6,639.4% 증가하였다(Fig. C). 혈액검사에서 항아세틸콜린 수용체항체는 음성이었으며, P/Q형 VGCC에 대한 항체가 2.34 nmol/L 양성으로 확인되었다.
이어진 영상검사, 조직검사에서 소세포폐암으로 확진되었으며, LEMS에 대해서 피리도스티그민(pyridostigmine 60 mg), 3, 4-다이아미노피리딘(diaminopyridine) 10 mg을 하루 4회 복용을 시작하였고, 2주 뒤 보행장애와 현훈이 뚜렷하게 호전되었다.
LEMS는 소뇌 실조로 발현하는 경우가 흔하지 않아서 소뇌 실조로 환자가 병원에 왔을 때 쉽게 고려되지 않는 질환이다[3]. 하지만 본 환자의 경우 주 호소증상이 소뇌성 보행 실조와 현훈이었고, 전기 생리학적 검사에서 복합근육활동전위의 진폭이 상하지에서 모두 비정상적으로 감소되어 있어 추가적으로 한 신경계진찰에서 심부건반사가 운동 후 회복되는 것을 확인하였다. 이어진 반복신경자극검사에서 고빈도 자극에서 6,639.4%로 큰 증가를 보이는 점과 P/Q형 VGCC에 대한 항체 양성을 근거로 LEMS로 진단하였다.
LEMS는 악성 종양과 잘 동반되는 신생물딸림증후군 중 하나로, 소세포폐암이 LEMS 환자의 60%에서 확인된다. 소세포폐암 등 여러 악성 종양에서 anti-Hu, anti-Yo 또는 anti-Ri 항체 등으로 인한 신생물딸림소뇌변성이 발생할 수 있기 때문에 LEMS 환자에서 소뇌 실조가 동반된 경우 P/Q형 VGCC 항체 외의 다른 종류의 항체 때문에 소뇌 실조가 발생할 수도 있다[4]. 하지만 본 환자에서는 anti-Hu, anti-Yo 또는 anti-Ri 항체에 대하여 음성으로 확인되었고, 뇌 자기공명영상검사와 F-18-플루오로탈산소포도당 양전자 방출단층촬영에서 신생물딸림소뇌 변성에서 보이는 영상 이상 소견이 확인되지 않아서 진단에서 배제하였다[5].
본 환자에서 시행한 자가면역항체검사에서 항핵항체와 anti-SS-A/Ro항체가 양성으로 확인되었다. Anti-SS-A/Ro항체는 쇠그렌증후군, 전신홍반루푸스 등에서 관찰되는 자가항체이다. 본 환자에서는 소세포폐암이 확인되어 이에 대한 항암 치료가 필요한 상태였기 때문에 자가면역질환에 대한 추가적인 검사가 이루어지지 않았다. 일반적으로 종양과 관련되지 않은 LEMS 환자에서는 다른 자가면역질환과 동반되는 경우가 대조군에 비해 유의하게 높았으나, 종양과 관련된 LEMS에서는 대조군과 비교해서 큰 차이를 보이지 않았다[6]. 하지만 이전에 소세포폐암에서 쇠그렌증후군과 LEMS가 함께 확인된 증례가 있는 점을 고려하면[7], 쇠그렌증후군에서 특징적인 증상인 입마름은 LEMS에서도 흔한 증상이기 때문에 간과되어 과소진단(underdiagnosis)되어 왔을 가능성도 생각해야겠다.
LEMS 환자에서 소뇌 실조가 생기는 병태생리는 아직 정확하게 밝혀진 바가 없다. 하지만 소뇌의 푸르키네(Purkinje)세포와 과립(granule)세포에 P/Q형 VGCC가 존재하기 때문에 LEMS에서 생기는 P/Q형 VGCC 항체가 소뇌 증상 발현에 영향을 줄 것으로 생각되고 있다[3]. 한 시험관내 실험에서는 쥐의 푸르키네(Purkinje)세포와 과립(granule)세포에 LEMS를 유발하는 P/Q형 VGCC IgG 항체를 처리하였더니 세포의 P/Q형 VGCC가 현저히 감소하는 것을 확인하였고[8], 이는 P/Q형 VGCC 항체가 뇌혈관장벽을 통과한다면 소뇌의 기능 저하를 유발할 수 있다는 것을 시사한다. 이러한 실험 결과는 소뇌 실조가 동반된 LEMS 환자의 부검 결과에 의해 뒷받침된다.
따라서 LEMS 환자에서 위와 같은 병태생리로 소뇌 실조 증상이 발생하면 오직 소수의 LEMS 환자에서만 소뇌 실조가 나타나는 것을 설명하기는 어렵다[9]. 그 이유로 정상적인 상황에서는 P/Q형 VGCC 항체가 뇌혈관장벽을 통과하지 못하거나, 환자들마다 항원결정기가 다름에서 기인한다고 생각되고 있다[10].
저자들은 첫 증상으로 보행실조, 현훈성 어지러움 등 소뇌증상으로 발현하여 LEMS로 진단된 1예를 경험하였기에 이를 보고하는 바이다. 소뇌 실조로 발현된 경우라도 LEMS를 감별진단에 넣어야 하며, 심부건반사가 운동 후 회복되는지 여부를 확인하는 신경계진찰이 도움이 될 것으로 생각한다.
REFERENCES
1. Lennon VA, Kryzer TJ, Griesmann GE, O'Suilleabhain PE, Windebank AJ, Woppmann A, et al. Calcium-channel antibodies in the LambertEaton syndrome and other paraneoplastic syndromes. N Engl J Med 1995;332:1467-1474.


2. Zalewski N, Lennon VA, Pittock SJ, McKeon A. Calcium channel autoimmunity: cerebellar ataxia and lambert-eaton syndrome coexisting. Muscle Nerve 2018;58:29-35.

3. Newsom-Davis J. Neuromuscular junction channelopathies: a brief overview. Acta Neurol Belg 2005;105:181-186.

4. Mason WP, Graus F, Lang B, Honnorat J, Delattre JY, Valldeoriola F, et al. Small-cell lung cancer, paraneoplastic cerebellar degeneration and the Lambert-Eaton myasthenic syndrome. Brain 1997;120(Pt 8):1279-1300.


5. Madhavan AA, Carr CM, Morris PP, Flanagan EP, Kotsenas AL, Hunt CH, et al. Imaging review of paraneoplastic neurologic syndromes. AJNR Am J Neuroradiol 2020;41:2176-2187.


6. Wirtz PW, Bradshaw J, Wintzen AR, Verschuuren JJ. Associated autoimmune diseases in patients with the Lambert-Eaton myasthenic syndrome and their families. J Neurol 2004;251:1255-1259.


7. Nishimura T, Tasaka S, Yamada W, Hasegawa N, Soejima K, Sayama K, et al. Small cell lung cancer with Sjögren's syndrome and Lambert-Eaton myasthenic syndrome. Nihon Kokyuki Gakkai Zasshi 2006;44:775-778.

8. Pinto A, Gillard S, Moss F, Whyte K, Brust P, Williams M, et al. Human autoantibodies specific for the alpha1A calcium channel subunit reduce both P-type and Q-type calcium currents in cerebellar neurons. Proc Natl Acad Sci U S A 1998;95:8328-8333.



Figure.
Findings of the nerve stimulation test. (A) Repetitive nerve stimulation of the ulnar nerve at 3 Hz, recording from the abductor digiti minimi muscle, shows 17.8% decremental responses of CMAP amplitude. (B) Repetitive nerve stimulation of the ulnar nerve at 3 Hz, recording from the flexor carpi ulnaris muscle, shows 26.6% decremental responses of CMAP amplitude. (C) Repetitive nerve stimulation at 50 Hz shows marked incremental response (6,639.4%). O; onset, P; peak, T; trough, CMAP; compound muscle action potential.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,161 View
- 46 Download
- Related articles
-
Systemic Sarcoidosis Presenting as Bilateral Optic Neuritis2022 February;40(1)
Tolosa-Hunt Syndrome Presenting as Cluster-Like Headache2021 November;39(4)
Miller-Fisher Syndrome Presenting with Bilateral Pseudo-Internuclear Ophthalmoplegia2018 May;36(2)
안구증상으로 발현한 Lambert-Eaton Myasthenic Syndrome (LEMS)2010 ;28(1)
Central Pontine Myelinolysis Presenting With Cerebellar Ataxia2009 ;27(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



