멜라스(mitochondrial encephalopathy, lactic acidosis, and strokelike episodes)는 사립체 DNA 변이로 발생하는 질환이다. 뇌졸중유사증상(stroke-like episodes)은 90% 이상의 멜라스 환자에서 발생하며, 주로 40세 이전에 나타난다[1]. 사립체세포병증(mitochondrial cytopathy)과 사립체혈관병증(mitochondrial angiopathy)이 주요 발병기전으로 알려져 있다[2,3]. 뇌졸중유사증상이 있는 경우 대부분 확산강조영상에서 병변이 발견되지만, 이들은 주요 혈관영역에 따라 분포하지 않는다. 혈관조영검사에서도 주요 혈관은 정상인 경우가 많으며[4], 관련 동맥의 협착이 보고된 예는 많지 않다[3,5,6]. 이에 본 저자들은 병변측 중대뇌동맥의 가역적인 협착을 동반한 중년 여성의 멜라스 증례를 보고하는 바이다.
증 례
43세 여자가 3주 전 비슷한 시점에 갑자기 발생한 좌측 상지와 입 주변의 저린 통증으로 내원하였다. 동반 증상은 열감이 있었으며, 내원 당시 또는 만성 두통은 호소하지 않았다. 비흡연자이며 음주력은 없었다. 당뇨병과 양측 감각신경난청이 있었으나 고혈압 및 뇌졸중 병력은 없었다. 가족력에서 특이 사항은 확인되지 않았다. 당뇨병은 인슐린으로 조절하고 있었으며, 한달 전 시행한 당화혈색소 수치가 8.9%로 다소 상승되어있어 인슐린 용량 조절 중인 상태였다.
환자는 키 144 cm, 체중 29 kg (모두 성별/연령 대비 1% 미만)으로 왜소한 체구였다. 입원 당시 생체징후는 체온 37.7도의 미열 만 있었다. 미열의 원인이 될 수 있는 호흡기, 비뇨기, 소화기계증상은 관찰되지 않았으며, C반응단백(C-reactive protein) 수치는 0.05 mg/dL (정상, 0.3 mg/dL 이하)로 정상치에 해당하였다. 발열의 원인을 확인하기 위하여 시행한 배양검사와 복부 computed tomography에서는 특이 소견이 확인되지 않았으며, 뇌척수액검사에서도 두개내 감염을 시사할 만한 특이 소견은 확인되지 않았다. 혈관염 등 자가면역질환으로 인한 발열 여부를 확인하기 위하여 시행한 항핵항체(anti-nuclear antibody), 항Sjogren's syndrome related antigen A항체, 항중성구세포질항체(anti-neutrophil cytoplasmic antibody), 항cyclic citrulinated peptide항체(anti-CCP antibody), 항카디로리핀항체(anti-cardiolipin antibody), 류마티스인자 모두 음성 및 정상으로 확인되었다. 혈중 전체 콜레스테롤, 중성지방, 저밀도와 고밀도 콜레스테롤 수치는 모두 정상범위였다. 혈중 젖산 농도는 30.6 mg/dL (정상, 19.8 mg/dL 이하)로 증가되어 있었다. 흉벽경유심 초음파에서는 제한심근병증이 확인되었다.
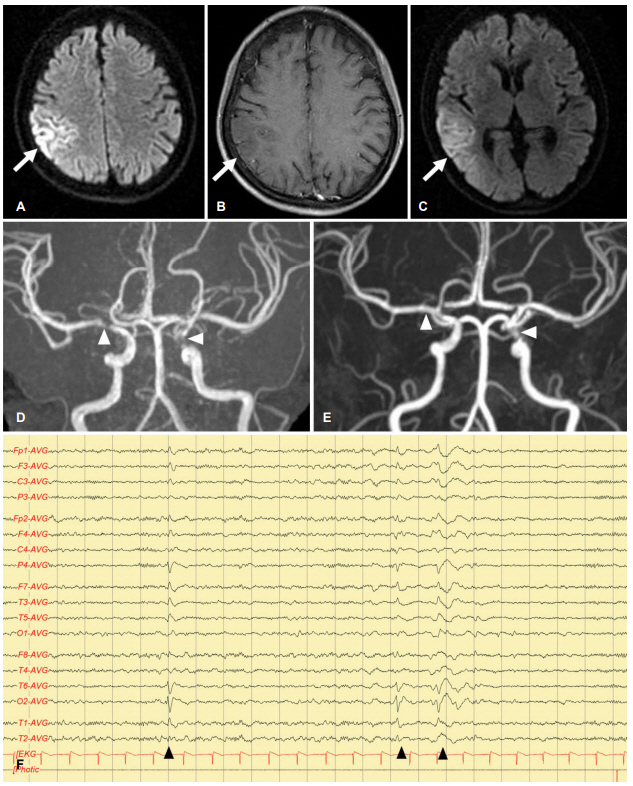
내원 당일 뇌 자기공명영상을 촬영하였다. T2강조영상에서 우측 두정엽과 양측 측두엽의 고신호강도가 관찰되었고, 확산강조영상과 T1강조조영증강영상에서는 우측 두정엽 병변이 고신호강도로 확인되었다(Fig. A, B). 자기공명혈관촬영에서는 우측 중대뇌동맥 근위부와 좌측 내경동맥 원위부에서 심한 협착이 확인되었다(Fig. D). 추가적으로 시행한 경두개초음파에서는 좌측의 경우 내경동맥 원위부부터 혈류 속도가 95.33 cm/s로 증가되어 있었으며(정상, 30-65 cm/s), 우측의 경우 내경동맥 원위부의 혈류 속도는 41.67 cm/s로 정상범주로 확인되었으나(정상, 30-65 cm/s), 중대뇌동맥 근위부부터 혈류 속도가 160.33 cm/s로 증가되어 있는 모습이 확인되었다(정상, 40-80 cm/s). 내원시 촬영한 뇌파는 정상이었으며, 모야모야병과 관련된 RNF-213 유전자검사는 음성으로 확인되었다.
저신장, 저체중, 젊은 연령에서 발생한 당뇨, 감각신경난청, 혈중 젖산 상승 그리고 심근병증이 동반되어 있다는 점을 고려하여 사립체질환의 가능성이 높다고 판단하였다. 이에 멜라스유전자검사를 진행하였으며, 흔한 원인 중 하나인 m.3243A>G 점돌연변이가 확인되었다. 이후 저린 증상에 대하여 프리가발린(pregabalin)을 투약하며 증상이 호전되어 경과를 관찰하였다.
고 찰
본 보고에서는 내경동맥과 중대뇌동맥의 협착을 동반한 뇌졸중 유사증상이 발생한 멜라스 환자에 대해 기술하였다. 비록 추적검사를 통해 병변측 혈관인 우측 중대뇌동맥의 협착이 가역적인 것을 확인하였으나, 멜라스유전자검사와 추적 혈관촬영 결과가 나오기 전에는 동맥경화에 의한 협착 또는 초기 모야모야병에 의한 뇌경색 가능성을 더 높게 생각하였다. 그러나 이른 나이에 발생한 당뇨병과 양측 감각신경난청 그리고 입원 중 시행한 검사에서의 다양한 단서들을 토대로 멜라스를 진단할 수 있었다. 일본에서 시행된 연구에 의하면, 절반이 넘는 멜라스 환자가 첫 증상으로 경련을 호소하며, 2/3 이상의 환자에서 진단 이후 경련이 발생한다[7]. 발프로산, 카바마제핀, 페니토인, 조니사마이드, 토피라메이트, 가바펜틴과 같은 약제는 사립체 기능에 영향을 끼쳐 멜라스 환자에서 경련을 악화시킬 위험이 높기에, 조기에 적절한 진단을 통해 사립체 기능에 영향을 끼치지 않는 항경련제를 투약하는 것이 중요하다[1]. 당뇨의 경우도 흔하게 사용하는 메트포르민은 멜라스 환자에서 젖산산증을 유발할 수 있어 젊은 나이에 발생한 당뇨 환자의 경우 멜라스에 해당되는 임상 양상이 있는지 확인하는 것이 중요하다[1].
멜라스에서 뇌졸중유사증상은 85% 정도의 환자에서 발생하며 미세혈관병증은 주요한 원인 중 하나이다[7]. 미세혈관병증은 크게 두 가지 원인으로 인하여 발생하는데, 하나는 사립체의 에너지 생성장애로 인한 혈관세포내 사립체의 침착이고, 다른 하나는 아르기닌 합성의 저하로 산화질소 결핍이 발생하여 혈관의 수축이 유발되는 것이다[1]. 부검을 통한 연구에서는 대뇌동맥의 내피세포와 평활근세포에서 사립체 침착이 소동맥에 집중되어 있고, 중대뇌동맥 같은 큰 동맥에서는 다소 분포가 떨어진다고 보고되었다[3]. 이러한 현상이 멜라스 환자의 혈관조영검사시 주요 대뇌동맥의 이상 소견이 관찰되지 않는 이유가 될 수 있을 것이다.
본 증례에서 관찰된 가역적인 좌측 중대뇌동맥의 협착은 산화질소 결핍이 유발한 가역적인 혈관 수축으로 인하였을 가능성이 있다. 좌측 내경동맥 원위부의 협착의 경우 추적혈관영상에서도 잔존하였는데, 이는 산화질소 결핍으로 인한 일시적인 혈관수축 보다는 사립체의 침착으로 인한 협착이나 지속되는 당뇨로 인한 동맥경화 변화로 인한 것일 가능성이 있겠다.
멜라스의 뇌졸중유사증상은 40대 이후에는 드물고, 당뇨와 같은 기저질환을 고려할 때, 대뇌혈관 협착의 원인으로 동맥경화를 배제하기 어렵다. 그럼에도 불구하고, 왜소한 체구, 당뇨, 난청, 젖산수치 상승 등 사립체질환에 부합하는 임상 양상의 동반과 함께, 가역적 뇌혈관협착이 관찰될 경우, 동맥경화보다 멜라스의 가능성을 고려해 보아야 한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




