임상추론: 파킨슨증과 운동기복으로 내원한 65세 남자
Clinical Reasoning: A 65-Year-Old Man Presented with Parkinsonism and Motor Fluctuation
Article information
증 례
65세 남자는 약 7년 전부터 오른쪽 팔과 다리에 힘이 없고 행동이 느려져서 외부 병원에서 파킨슨병으로 진단받고 약물 치료 중이었다. 진단 후 초기 약 5년 동안 환자는 파킨슨병 약물 치료에 의해 증상이 잘 조절되었다. 그러나 약 6년 정도 지나면서 약효가 빨리 나타나지 않고 약물 작용시간이 짧아지는 증상이 점점 심해져 진단 후 약 7년째 본원 신경과를 방문하였다. 신경퇴행질환의 가족력은 없었고, 술과 담배는 하지 않았다.
본원 첫 방문 당시 신경계진찰에서 운동완만(bradykinesia)과 경축(rigidity)이 뚜렷하게 관찰되었고 오른쪽 팔과 다리의 증상이 왼쪽보다 약간 심했다. 약효 개시시간(on-time)에 측정한 통합파킨슨병척도중 운동척도(unified Parkinson’s disease rating scale part III motor scale)는 22점이고 Hoehn and Yahr stage (HY stage)는 2.5였다.
내원 당시 한국판간이정신상태검사(Korean-Mini Mental Status Examination, K-MMSE), 임상치매평가척도(Clinical Dementia Rating, CDR)와 종합임상치매평가척도(CDR-Sum of boxes, CDR-SB), 통괄퇴화척도(Global Deterioration Scale, GDS) 및 도구일상생활능력(instrumental activity of daily living, I-ADL)을 평가하였다.
본원 내원 당시 환자는 표준형레보도파(levodopa) 100 mg을 하루에 2번 복용하고 있었다. 내원 이후 환자는 사망하기 전까지 약 10년간 도파민성 약물로 장기적인 치료를 받았고, 다양한 운동기복(motor fluctuation)과 이상운동증(dyskinesia)이 나타났다.
질문 1. 이 환자는 특발파킨슨병의 진단기준에 맞는가?
환자는 58세에 특발파킨슨병으로 진단을 받았다. 현재까지 임상적으로 널리 이용되고 있는 파킨슨병의 임상기준은 1988년에 발표된 UK Parkinson’s Disease Society Brain Bank clinical diagnostic criteria이다[1]. 이 기준에 따르면 스텝 1에서 우선 운동완만이 있으면서 경축, 4-6 Hz의 안정시떨림, 또는 자세불안정(일차 시각기능, 전정기능, 소뇌기능 또는 고유감각 장애가 없어야 함) 중에서 적어도 1개 이상이 있어야 한다. 스텝 2는 배제기준으로 파킨슨병의 감별을 위해 필요한 조건들이다. 스텝 3는 파킨슨병을 진단하기 위한 지지기준으로 8개 항목 중에서 3개 이상이 있어야 한다[1]. 본 증례는 오른쪽 팔과 다리부터 증상이 시작(unilateral onset)되었고, 진행 경과를 보였다(progressive disorder). 또한, 발병 후 주로 오른쪽 증상이 왼쪽보다 심한 증상의 비대칭(persistent asymmetry affecting the side of onset most)이 지속되었으며 5년 이상 레보도파에 좋은 반응이 지속(levodopa response for 5 years or more)되었다. 마지막으로 10년 이상의 임상 경과(clinical course of 10 years or more) 중 레보도파에 의해 유발되는 심한 이상운동증(severe levodopa-induced dyskinesia)도 관찰되어 지지기준을 만족하였다.
최근 2015년에 발표된 Movement Disorder Society (MDS)의 파킨슨병 임상진단기준[2]은 운동완만이 있으면서, 안정 시 떨림 또는 경축 중 1가지가 있는 필수기준을 제시하고 있다. 이는 UK Parkinson’s Disease Society Brain Bank 진단기준과 유사하지만, 배제기준과 지지기준으로만 나눠진 기존의 진단기준에 적신호(red flag) 기준을 추가하여 세분화하였다. 또한, MDS의 파킨슨병 임상기준에서 자세불안정이 제외되었는데, 자세불안정은 파킨슨병 후기 단계에 잘 발생하며, 질병 초기에 존재하면 다른 진단을 제시한다[2]. 임상 진단기준에 합당한 파킨슨병의 진단은 다음의 3가지 조건을 만족해야 한다[2]. 첫째, 절대적인 배제기준이 없어야 하고, 둘째, 2가지 이상의 지지기준이 있어야 하며, 셋째, 적신호가 없어야 한다.
본원에서 약효 개시시간 동안 측정한 환자의 통합파킨슨병평가척도 운동척도에서 운동완만과 경축이 뚜렷하게 관찰되었고, 오른쪽팔과 다리의 운동완만과 경축이 왼쪽에 비해 심했다. 또한, 오른쪽팔에서 약 3-4 Hz로 항상 관찰되는 안정 시 떨림이 있었다. 운동완만, 경축, 안정 시 떨림으로 파킨슨병의 임상진단을 위한 필수 조건을 만족한다. 또한, 임상 진단을 위한 지지기준 4가지 중에서 환자는 3가지를 만족하였다[2]. 첫째, 안정 시 떨림이 있었다. 둘째, 환자는 진단 초 약 5년 동안 레보도파에 반응이 좋았고 현저한 증상의 완화를 보였다. 셋째, 환자는 진단 후 약 8년부터 레보도파에 의한 이상운동증(levodopa induced dyskinesia, LID)이 발생하였다. 비록 지지기준 중 후각기능 저하 또는 123I-meta-iodobenzylguanidine (MIBG) 섬광조영술(MIBG scintigraphy)에서 심장교감신경계의 퇴행변화(cardiac sympathetic degeneration)를 확인하지는 못했으나 절대적인 배제기준 및 적신호에 해당하는 증상 또는 징후가 없어[2] 파킨슨병으로 진단할 수 있다.
질문 2. 이 환자의 치료 및 경과는?
환자는 58세 진단 후 초기 5년간 레보도파에 반응이 좋았으나, 7년 후 진행기(advanced stage)로 접어들면서 약효 개시시간이 늦어지고, 약효 지속시간이 짧아졌다. 개시시간의 지연과 약 효과가 빨리 나타나지 않는 것에 대해서, 우선 표준형레보도파 100/25 mg을 하루 3번 복용하게 한 후 한 달 뒤에는 200/50 mg을 하루에 3번 복용하도록 서서히 증량시켰다. 레보도파의 작용시간이 짧아 오래 지속되지 못하고 약효 종료시간이 빨라진 것에 대해서 서방형레보도파 200/50 mg을 하루에 3번 병용하였다.
진단 후 8년째 환자는 걸을 때 오른쪽 다리가 불수의적으로 꼬이는 무도증(chorea)을 보고하였다. 환자의 이상운동증은 주로 레보도파를 복용 후 약 2시간 지나면서 발생하였고, 약효가 사라질 때는 나타나지 않아 최고점용량이상운동증(peak dose dyskinesia)으로 생각되었다. 환자의 이상운동증이 보행장애 및 일상생활능력을 악화시켜서 서방형제제의 1회 복용량을 200/50 mg 1/2정으로 줄이고 하루 4번으로 복용 횟수를 증가시켰다. 또한, 환자는 아침에 일어나기 힘들고 몸이 무거워(morning off) 아침 식전에 레보도파확산정 100 mg을 복용하였다. 그러나 레보도파 1회 총 용량의 감소로 다시 약효가 빨리 소진되고 오래 지속되지 못해서 표준형레보도파 200/50 mg과 서방형 레보도파 200/50 mg을 하루에 3번 함께 복용하였다. 또한, 자기 전 서방형제제 200/50 mg 1정과 1/2정을 추가로 복용하였다.
진단 후 9년째 운동기복(motor fluctuation)과 이상운동증(dyskinesia)이 반복해서 나타나는 요요현상(yo-yo-ing, combination of fluctuations and dyskinesia)[3]이 나타나기 시작하였다. 일반적으로 요요현상은 약물조절이 쉽지 않고 서방형레보도파는 요요현상을 악화시킬 수 있어[3] 서방형제제 200/50 mg을 하루에 4번 복용하여 전체 레보도파 용량을 줄였다. 또한, 표준형레보도파 대신 표준형제제와 콤트억제제(catechol-O-methyltransferase inhibitor, COMT inhibitor) 복합제 200/50/200 mg을 하루에 3번 복용하였다.
진단 후 약 11년째 의자에서 스스로 일어나지 못하고 걸을 때 몸이 앞으로 쏠리며 걸음이 빨라지는 운동증상과 정신운동지체(slowness of psychomotor speed)를 보였다. 이에 대해 표준형 레보도파 100/25 mg 1/4정을 하루에 3번 추가해 보았으나 뚜렷한 증상의 호전을 없었다.
진단 후 13년째 저녁 6시경에 약효가 갑자기 떨어지는 증상(sudden off)이 나타났다. 이런 경우 다양한 도파민 제제가 크게 도움이 되지는 않으나[3] 환자가 점심 약을 오후 늦게 먹도록 복용시간을 지연시켰다.
진단 후 14년째 구음장애, 삼킴곤란 및 소변장애가 나타났고, 진단 후 약 16년째 하루 10번 이상 넘어지며 요요현상은 더욱 자주 나타났다. 당시 환자의 HY stage는 4.0이었고, 독립적인 생활이 불가능하였다. 표준형제제와 콤트억제제복합제의 복용 횟수를 늘려보았으나, 이상운동증이 악화되어 다시 복합제의 복용 횟수를 줄이고 아만타딘(amantadine) 100 mg 1/2정을 추가하였다.
진단 후 약 17년째, 환자는 스스로 식사를 하지 못하고, 혼자서 거동할 수 없어 요양병원에 입원하였고, 약 1년 뒤 75세 나이로 사망하였다.
질문 3. 사망하기 전 환자의 인지기능은 파킨슨병 경도인지장애에 합당한가?
내원 당시 환자가 시행한 한국판간이정신상태검사, 임상치매평가척도, 종합임상치매평가척도, 통괄퇴화척도 및 도구일상생활능력은 모두 정상이었다(Table 1).
진단 후 10년째 시행한 한국판간이정신상태검사는 여전히 30점 만점이었으나 한국판몬트리올인지평가(Korean version Montreal Cognitive Assessment, K-MoCA)는 23점이었다(Table 1). 이 때 한국판몬트리올인지평가에서는 시공간인지/집행기능(trail making, copy cube), 집중력(vigilance), 언어기능(문장 따라 말하기, sentence repetition), 추상력(시계-자) 및 기억력 항목에서 저하를 보였다. 파킨슨병치매 레벨 I 진단기준에 따르면[4] 파킨슨병 환자의 인지기능이 일상생활에 영향을 주는지 평가하기 위해서 보호자와의 인터뷰 또는 약 복용 설문지(pill questionnaire)[4]를 시행한다. 환자는 자신이 복용하는 항파킨슨제 복용량을 잘 알고 있었으며 증상에 따라 증량, 감량을 구별할 수 있었다. 또한, 시간에 맞춰서 스스로 약을 복용할 수 있었고 남거나 모자란 적이 없어서 일상생활에 영향을 줄 정도로 인지기능저하가 심각하다고 생각되지 않았다.
진단 후 11년째와 13년째 시행한 한국판간이정신상태검사는 모두 집중력과 계산력저하를 보였다. 진단 후 11년째 다시 시행한 한국판몬트리올인지평가에서도 여전히 시공간인지/집행기능, 집중력 및 기억력에서 저하를 보였다. 사망 1년 전 마지막으로 시행한 한국판간이정신상태검사는 25점으로 크게 떨어졌다(Table 1). 특히, 집중력과 계산력, 기억력, 언어기능 및 시공간인지능 등 다양한 인지영역의 저하를 보였다.
2012년 제안된 파킨슨병 경도인지장애 진단을 위한 Movement Disorder Society Task Force의 가이드라인[5]에서 첫 번째 선정기준에 따르면 임상 진단기준에 따라 진단된 파킨슨병 환자가 서서히 악화되는 인지기능을 호소하거나, 정보제공자 또는 전문의에 의해 인지기능이 보고해야 한다. 또한, 인지장애는 일상생활에 장애를 유발하지 않고 환자는 독립적 기능을 유지해야 한다. 세 번째 섹션은 인지평가의 포괄성에 따라 레벨 I과 II 범주로 나눠서 제시한다. 우선 레벨 I의 경우, 글로벌 인지기능 척도에서 이상을 확인하거나, 또는 제한된 신경심리검사가 수행되는 경우 적어도 2개의 검사에서 이상 소견을 보여야 한다. 레벨 II는 레벨 I보다 포괄적인 신경심리검사로 진단한다.
환자가 시행한 간이정신상태검사는 Movement Disorder Society Task Force의 가이드라인에서 권고되는 레벨 I 검사는 아니지만[5] 지속적으로 한국판간이정신상태검사에서 집중력 및 계산력 저하를 보였고 마지막에는 기억력 회상(recall) 항목, 언어기능 및 그리기(시공간인지능) 등 다양한 영역에서 인지기능저하를 보였다. 두 번의 한국판몬트리올인지평가 역시 공통적으로 시공간인지/집행기능, 집중력 및 기억력저하 소견을 보였다.
환자는 포괄적인 신경심리검사를 시행하지 않아서 파킨슨병 경도인지장애 진단기준 레벨 II를 적용할 수 없지만, 파킨슨병 경도인지장애 진단기준에서 권고하는 글로벌 인지기능 척도로 권고하는 한국판몬트리올인지평가에서 3개 인지영역(시공간인지/집행기능, 집중력 및 기억력)의 기능저하가 관찰되었다. 이는 파킨슨병 경도인지장애 진단기준 레벨 I에 해당하며 인지기능장애가 일상생활에 영향을 주지 않아 파킨슨병 경도인지장애라고 할 수 있다.
질문 4. 이 환자의 최종 진단명은?
환자는 75세에 사망 후 뇌부검을 시행하였다. 대뇌의 무게는 약 1,090 g (좌측 500 g, 우측 590 g)이었고 크기는 약 16.5×9.5×6.5cm였다. 단면에서 뇌혈관 죽상경화증, 경색, 및 출혈은 관찰되지 않았다. 좌뇌, 좌측 소뇌와 좌측 뇌줄기는 충분한 포르말린 고정 후 육안검사와 블록 제작을 하였다. 눈에 띄는 소견은 흑색질(substantia nigra)과 청반(locus ceruleus)의 심한 창백(severe pallor)이었다(Fig. 1).

In the macroscopic findings, substantia nigra (arrow) and locus ceruleus (arrowhead) showed severe hypopigmentation.
대뇌 전엽에 걸쳐 경미한 위축과 경미한 뇌실 확장 외에 이상소견은 없었다.
헤마톡실린-에오진염색(hematoxylin-eosin stain, H&E stain) 현미경 소견에서 신경세포 손실이 흑색질과 청반에서 심하였으며, 메이너트기저핵(nucleus basalis of meynert), 편도(amygdala), 내후각피질(entorhinal cortex), 해마(hippocampus), 신피질(neocortex)에서는 경미하였다(Table 2). 헤마톡실린-에오진염색에서 흑색질, 메이너트기저핵, 편도에서 레비소체(Lewy body, LB)가 드물게 관찰되었고, 띠이랑(cingulate gyrus)에서는 중등도로 관찰되었다(Fig. 2).

(A) Severe neuronal loss and gliosis with Lewy body (inlet) of substantia nigra (H&E, ×40 [inlet, ×400]). (B) Many Lewy bodies and some Lewy neurites in substantia nigra (alpha-synuclein, ×100). (C) Amygdala (alpha-synuclein, ×100) and (D) Cingulate (alpha-synuclein, ×200) showing numerous Lewy bodies and Lewy neurites. (E) A few scattered Lewy bodies in the temporal (left), frontal (middle), and parietal (right) lobe (alpha-synuclein, ×200). (F) Moderate neurofibrillary tangles by Tau staining in the entorhinal cortex (phospho-Tau [AT8], ×100).
알파-시누클레인 면역염색으로 확인한 레비소체 점수 체계에 따라[6] 흑색질, 해마, 초내후각피질(transentorhinal cortex) 및 띠이랑은 심한(severe) 정도, 메이너트기저핵과 편도에서는 극심한(very severe) 정도의 레비소체 밀도를 보였다(Table 2). 또한 측두엽(temporal lobe), 전두엽(frontal lobe), 두정엽(parietal lobe)에도 레비소체가 경미하게(mild) 관찰되었다(Table 2).
타우(Tau) 염색에서는 신경섬유매듭(neurofibrillary tangle)과 신경그물실(neuropil thread)이 내후각피질에 경도에서 중등도, 해마에서 경도로 관찰되었다(Braak stage II, B1) (Fig. 2). 베타아밀로이드 염색에서 신경판(neuritic plaque), 미만성판(diffuse plaque), 아밀로이드혈관병증(amyloid angiopathy)은 관찰되지 않았다(Thal phase 0, Consortium to Establish a Registry for Alzheimer's Disease[CERAD] score 0). TDP-43 (Transactive response DNA binding protein 43 kDa)와 유비퀴틴(ubiquitin) 단백 확인을 위한 p62 면역조직화학 염색 모두 음성이었다. 따라서, 본 환자의 병리진단은 광범위 신피질형태(diffuse neocortical type)의 레비소체질환(Lewy body disease)으로 생각된다[6].
토 의
일반적으로 초기 파킨슨병 환자들은 약물 치료 시작 후 약 3-5년 동안 증상이 잘 조절되면서 약에 대한 반응도 좋고 부작용도 없는 안정적인 시기를 거친다[3,7,8]. 이 시기를 밀월 기간(honeymoon period)[7]이라고 부르는데, 대부분의 환자들이 하루에 레보도파 300-600 mg 정도로 증상을 유지를 할 수 있다[8]. 이 시기가 지나고 레보도파 사용 후 약 5-6년 남짓부터 도파민성 약물의 장기 치료에 의한 부작용으로 운동기복, 레보도파에 의한 이상운동증 및 다양한 합병증이 발생한다[3,7].
진행기에 접어들면서 나타나는 운동기복 중 가장 대표적인 것은 약효소진(wearing-off)으로 인해 약효 종료시간이 빨라지는 것이다[7,9]. 약효소진이란 다음 도파민성 약제 복용 전에 약효가 감소하는 것을 말하는데[7], 이 경우 약물 복용에도 불구하고 약효가 최적으로 유지되는 지속시간이 짧아지고 약효 종료시간(off-time)이 빨라진다. 약효소진에 대한 치료 전략으로 첫째, 레보도파 제제의 증량, 둘째, 서방형제제나 도파민작용제(dopamine agonist) 등의 다른 종류의 도파민계 약물 추가, 셋째, 레보도파 1회 복용량을 줄이고 복용 횟수 증가(levodopa dose fractionation) 또는 넷째 콤트억제제 또는 마오비(monoamine oxidase type B, MAO-B)억제제 추가를 고려할 수 있다[3,7,9,10]. 그 외 운동기복으로 갑자기 레보도파의 혈중농도가 떨어지면서 약효가 사라지는 상태(sudden off)로 일반적으로 이 경우에는 각종 항파킨슨약물 처방으로는 크게 효과가 없다[3].
이상운동증이란 레보도파나 도파민작용제 복용 후 과운동이 나타나는 것을 말한다[7]. 이상운동증이 심하지 않다면 반드시 약물 조절이 필요한 것은 아니지만, 일상생활에 장애를 준다면 약물 조절이 필요하다[9]. 최고점용량이상운동증은 주로 레보도파의 혈중 농도가 높아서 생기므로 약물의 용량을 줄이면 감소하게 된다[3,9]. 대신 파킨슨 운동증상이 악화될 수 있고 약물의 작용시간도 짧아지게 되므로 약물을 복용하는 횟수를 늘린다[3]. 그 외 아만타딘이나 클로자핀을 추가해 볼 수 있다[3,7,9,10].
운동기복과 이상운동증이 모두 발생하는 경우 가장 약물 조절이 어렵다. 약물을 복용하면 이상운동증이 동반된 작동기(on-period)가 나타나고 약물의 용량을 낮추면 움직이기 힘들어지는 비작동기(off-period)가 된다[3]. 이렇게 양극단의 상태가 반복될 때 요요현상(yo-yo-ing)이라고 한다[3].
파킨슨병의 전형적인 병리 소견은 레비소체라는 단백 봉입소체(inclusion body)가 보이는 것이다[11]. 일반적으로 헤마톡실린-에오진염색은 뇌간형 레비소체를 찾는 데 적합할 수 있지만, 대뇌 피질 레비소체는 찾기 어렵다[6]. 현재, 레비소체 검출에 가장 민감하고 구체적인 검사법은 알파-시누클레인(alpha-synuclein) 면역조직화학염색을 사용하는 것이다[6]. 레비소체 병리 소견에 대한 주요 병기 시스템 중 레비소체치매 컨소시엄(DLB consortium) 권장안에 의하면[6], 신피질에 분포하는 레비소체의 양이 증가할수록 레비소체 밀도를 1부터 4단계로 나눠 다음과 같이 반정량적으로 측정한다(Fig. 3);1) 경도(mild) - 레비소체가 1개 정도로 아주 드물거나 레비신경돌기(Lewy neurites)만 관찰되는 경우, 2) 중등도(moderate) - 레비소체가 고배율에서 1개 이상 관찰되고 경도의 레비신경돌기가 관찰되는 경우, 3) 심한 정도(severe) - 4개 이상의 레비소체와 저배율에서 흩어져 있는 레비신경돌기가 관찰되는 경우, 4) 극심한 정도(very severe) - 수많은 레비소체와 레비신경돌기가 관찰되는 경우[6]. 본 증례에서는 뇌간, 변연계 및 신피질 영역에서 레비소체 관련 병리소견의 패턴을 보았을 때(Table 3)[6], 레비소체가 뇌간(brain stem)과 기저 전뇌(basal forebrain)와 변연부(limbic region)에 현저하게 관찰되며 신피질에서는 경도로 관찰된다.
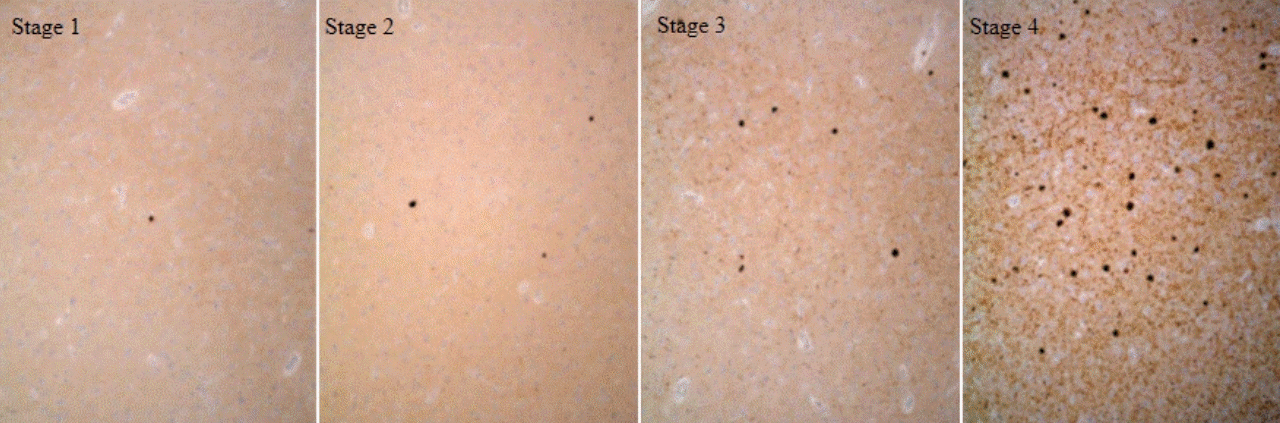
Staging of alpha-synuclein pathology in dementia with Lewy bodies (DLB) [6]. Alpha-synuclein immunostaining in cerebral cortex of DLB cases illustrating increasing severity of Lewy bodies (LBs) and LB pathology scored as stage 1 to 4. Stage 1; mild (sparse LBs or Lewy neurites [LNs]), Stage 2; moderate (>1 LB per high power field and sparse LNs), Stage 3; severe (≥4 LBs and scattered LNs in low power field), Stage 4; very severe (numerous LBs and LNs).
인지기능저하를 보이는 환자에서 레비소체 병리 소견과 알츠하이머형 병리 소견이 공존하는 경우, 신경판과 신경섬유매듭의 지형적 분포 정도를 각각 점수화한 CERAD 점수와 Braak 단계를 조합하여 알츠하이머 신경병리변화를 평가한다[12]. 그후 마지막으로 알츠하이머 신경병리변화와 레비소체 병리의 상대적인 기여도를 가늠하여 레비소체 병리 소견이 레비소체치매임상증후군(Dementia with Lewy bodies clinical syndrome)에 적합한지 평가한다(Table 4)[6,13]. 최근에는 레비소체 관련 병리 소견을 총 5개 영역들(신피질 중심, 변연계 중심, 뇌간 중심, 편도 중심, 후각망울 중심)로 나누어서 평가한다[13].
그 외 내후각피질(단계 I-II)과 해마(단계 III-IV)에 신경섬유매듭이 관찰되어 환자는 일차나이연관타우병증(primary age-related tauopathy)을 동반하고 있었다[14]. 일차나이연관타우병증은 나이든 노인들의 뇌에서 거의 보편적으로 관찰되며, 이러한 병리 소견을 가진 사람들의 증상은 보통 정상적 인지상태부터 기억상실형 경도인지장애까지 다양하지만 치매를 보이는 경우는 매우 드물다[14]. 환자는 약 18년이라는 긴 이환 기간에도 불구하고 사망하기 2년 전 마지막 인지평가에서 경도인지장애 수준을 보였다.
파킨슨병 경도인지장애 환자들에서 다양한 레비소체 단계와 알츠하이머 신경병리가 함께 관찰되는 병리이질성이 심하다[15]. 특히, 기억상실형 경도인지장애와 비교하였을 때 비기억상실형 경도인지장애에서 신피질에서 레비소체 병리가 증가한다[15].
본 증례의 병리 소견에 따라 환자의 인지기능저하에 대해 알츠하이머형 병리의보다는 레비소체 병리의 기여가 높고, 신피질에서 관찰되는 레비소체가 경도인지장애와 관련된다고 생각된다[15].
결론적으로 환자는 전형적인 특발파킨슨병의 임상양상을 보이며 18년의 긴 이환 기간 동안 서서히 파킨슨 증상이 악화되면서 경도인지장애를 보였다. 또한, 병리 소견에서 레비소체가 흑색질, 초내후각피질, 띠이랑, 메이너트기저핵 및 편도에 집중적으로 분포된 반면, 신피질에는 경미하게 관찰된다. 따라서, 환자의 긴 파킨슨병이 이환 기간 동안 레비소체 병리 소견도 뇌간 및 변연계 중심단계에서 신피질 중심으로 변화되는 과도기적 단계로 생각된다.
KEY POINTS
1. 파킨슨병의 필수 임상 진단기준은 운동완만이 있으면서, 안정시 떨림 또는 경축 중 1가지가 있어야 한다.
2. 진행기에 접어든 파킨슨병은 약물 치료에 연관되어 운동기복(motor fluctuation) 및 이상운동증(LID) 등의 다양한 합병증이 발생한다. 이 때 환자의 임상 증상을 확인하고 적절한 약물치료가 필요하다.
3. 파킨슨병 경도인지장애를 진단하기 위한 선정기준으로는 파킨슨병의 임상 진단기준에 합당하고 객관적인 신경심리검사에서 인지장애가 나타나지만 독립적인 일상생활이 가능해야 한다.
4. 레비소체질환의 병리적 진단은 후각망울, 편도, 뇌간, 변연계 및 신피질 영역에서 레비소체 및 그와 관련된 병리 소견의 패턴을 먼저 확인하고 알츠하이머형 병리 소견도 같이 확인해서 진단한다



