멜라스증후군(metabolic encephalopathy, lactic acidosis and stroke-like episodes syndrome)은 드문 미토콘드리아질환 중의 하나로, 미토콘드리아 DNA의 운반 RNA (transfer RNA)를 암호화하는 유전자 MTTL1의 점돌연변이로 인하여 발생한다. 이에 미토콘드리아에서의 에너지 생성이 감소하여 다계통 장기의 기능부전을 초래하는 것이 특징이다. 특히 에너지 사용량이 많은 근육, 내이, 뇌 등이 멜라스증후군에서 취약한 기관으로 근육병증, 청력장애, 뇌병증 등을 유발할 수 있다[1]. 국내에서도 멜라스증후군과 연관된 인슐린저항성당뇨병, 젊은 환자에서 발생한 후두엽 뇌경색 등이 보고된 적이 있다[2,3]. 본 증례에서는 멜라스증후군의 뇌실질 침범으로 인하여 실어증 및 경련이 발생한 환자에 대하여 보고하며, 멜라스증후군의 특징적인 임상양상 및 급성 뇌경색 등의 뇌질환과 감별에 도움이 될 수 있는 영상의학 요소들에 대하여 고찰한다.
증 례
38세 여성이 내원 1주 전 발생한 언어장애로 내원하였다. 남편과 말싸움을 하던 중 갑자기 남편의 말을 잘 이해하지 못하고 본인이 하고 싶은 말이 잘 나오지 않아 당황해 하는 모습을 보였다. 다음날 오전에 증상은 다시 호전되었으나 저녁에 다시 증상이 발생하였고 말의 표현과 이해 모두 장애를 보였다.
환자는 대학 졸업 후 대기업에서 7년간 일한 경력이 있었다. 환자에게는 아버지, 어머니, 오빠가 있었으며 이들 중 당뇨병, 청각장애 및 경련 등의 병력을 가지고 있는 사람은 없었다. 7년 전 임신 중 당뇨가 발생하여 당뇨병을 진단받고 합병증 없이 인슐린을 사용하면서 경과 관찰 중이었다. 환자의 아들은 발육상 큰 문제가 없었다.
내원 6개월 전부터 간헐적으로 의식소실 없이 오른 팔이 뻣뻣해진 상태로 규칙적으로 움찔거리듯 움직이는 모습이 보였다. 초기에는 3일에 한 번, 한 번 발생시 1분 미만으로 발생하였으나 점차 빈도 및 지속 시간이 늘어나 내원 당시 하루에 5회 이상 발생하였고, 10분 이상 지속되었다. 비슷한 시기부터 심한 어지러움과 머리 전체를 감싸는 듯한 시각통증등급(visual analogue scale) 8점의 두통이 발생하였다.
내원 두 달 전에는 오른 팔의 불수의적 운동이 10분 이상 지속되어 타 병원 응급실에 내원하였다. 당시 응급의학과 전공의가 진찰하던 중 좌측 안구편위 이후 전신근간대발작이 발생하였다. 로라제팜 투여 후 경련은 멈추었고 약 20분 간의 혼동증상이 동반되었다. 이후 의식은 명료해졌으나 신경과 전문의 문진 중 갑자기 보호자를 알아보지 못하고 모든 치료를 거부하며 병원 밖으로 나가려고 하는 증상을 보였고, 시야가 뿌옇게 보임을 호소하였다. 당시 촬영한 magnetic resonance imaging (MRI)에서는 양측 측두엽 및 우측 측두엽의 피질에서 다초점의 확산제한 및 조영증강이 보였다. 뇌염 감별을 위하여 시행한 뇌척수액검사에서는 백혈구는 관찰되지 않았으며 단백질 72.6 mg/dL (15-45 mg/dL), 포도당 124 mg/dL (40-70 mg/dL)로 단백질과 포도당이 조금 증가한 소견을 보였다. 뇌파검사상 뇌전증모양방전은 관찰되지 않았지만 뇌전증을 의심하여 발프로산 300 mg을 1일 3회 사용하면서 1주간 경과 관찰하였으며 오른 팔의 떨림 및 근간대경련은 재발하지 않았다. 인지기능도 점차 호전되어 평소와 비슷한 수준으로 일상 대화가 가능하게 되었으며, 시야장애도 호전되어 퇴원하였다. 퇴원 이후 의식소실, 인지기능장애 및 사지의 불수의운동 등은 발생하지 않았다.
본원에 입원하여 시행한 신체검사상 활력징후는 안정적이었고, 의식은 명료하였으나 언어의 이해, 유창성, 따라 말하기, 쓰기, 읽기, 이름대기 모두 불가능한 전실어증 소견을 보이고 있었다. 그 외 사지의 위약감, 안면마비, 감각감소, 실조증 등의 다른 뚜렷한 이상은 없었다. 심전도상 동성리듬이었으나 심실조기흥분(ventricular preexcitation)이 관찰되었고 혈청젖산농도가 31.6 mg/dL (4.5-19.8 mg/dL)로 증가되어 있었다. 젖산탈수소효소(lactate dehydrogenase) 또한 1,192 IU/L (208-450 IU/L)로 증가되어 있었다. 혈중나트륨농도는 137 mMol/L (135-145 mMol/L)로 정상범위였고, 당화혈색소는 8.4% (2.7-5.8%)였다. 이외의 혈액검사와 항핵항체(antinuclear antibody), 항인지질항체, 항카디오리핀(cardiolipin)항체, 루푸스항응고인자(lupus anticoagulant) 등을 포함한 자가면역 항체검사는 모두 정상이었다. 우리 병원에서 뇌척수액검사는 다시 시행하지 않았고 근육생검도 시행하지 않았다.
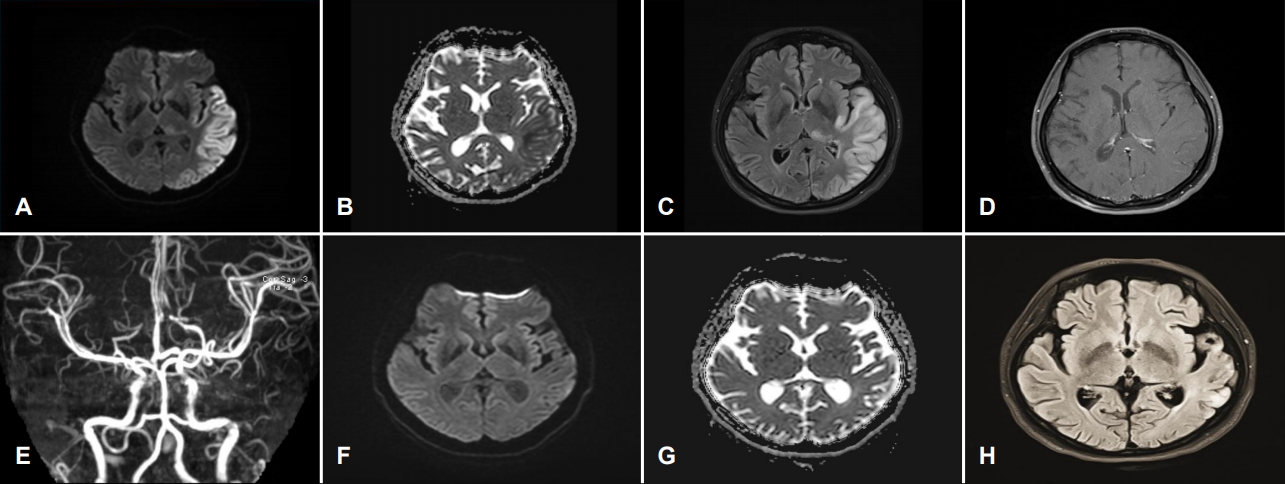
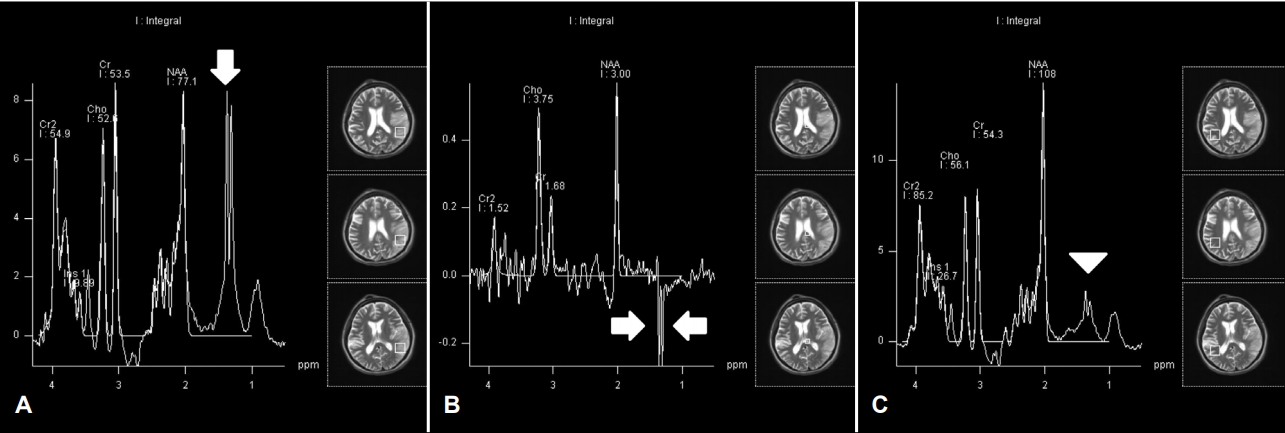
확산강조영상(diffusion-weighted image, DWI)에서 이전 MRI에서 관찰되었던 양측 측두엽 및 우측 측두엽피질의 다초점성 확산제한은 호전되었으나 좌측 두정엽, 측두엽과 후두엽의 피질 및 피질하영역 그리고 좌측 시상 일부에 확산제한이 보이고 있었다. 겉보기확산계수지도(apparent diffusion coefficient, ADC map)에서는 좌측 측두엽피질 및 피질하영역 일부에 신호강도 감소가 보였고, 나머지 부위에서는 동일한 신호강도를 보이고 있었다. 액체감쇠역전회복영상(fluid-attenuated inversion recovery [FLAIR] imaging)에서는 병변 부위의 신호 증가가 보였고, 대뇌피질의 경미한 부종 및 고랑의 소실이 보였다. Magnetic resonance (MR)혈관조영술에서는 대뇌혈관의 협착 또는 폐색은 관찰되지 않았고, 좌측 중대뇌동맥이 우측 중대뇌동맥과 비교하여 혈액유동신호(blood flow signal)가 증가되어 있었다(Fig. 1). 자기공명분광법(MR spectroscopy, MRS)에서는 좌측 측두엽의 병변 부위에서 젖산(1.3 ppm)의 증가 소견이 보였고, N-acetyl asparate (NAA)와 비슷한 정도로 측정되었다. DWI 및 T2강조영상에서 신호변화가 없는 우측 측두엽에서 측정하였을 때는 1.3 ppm에서 경도의 젖산 증가 소견이 보였다(Fig. 2).
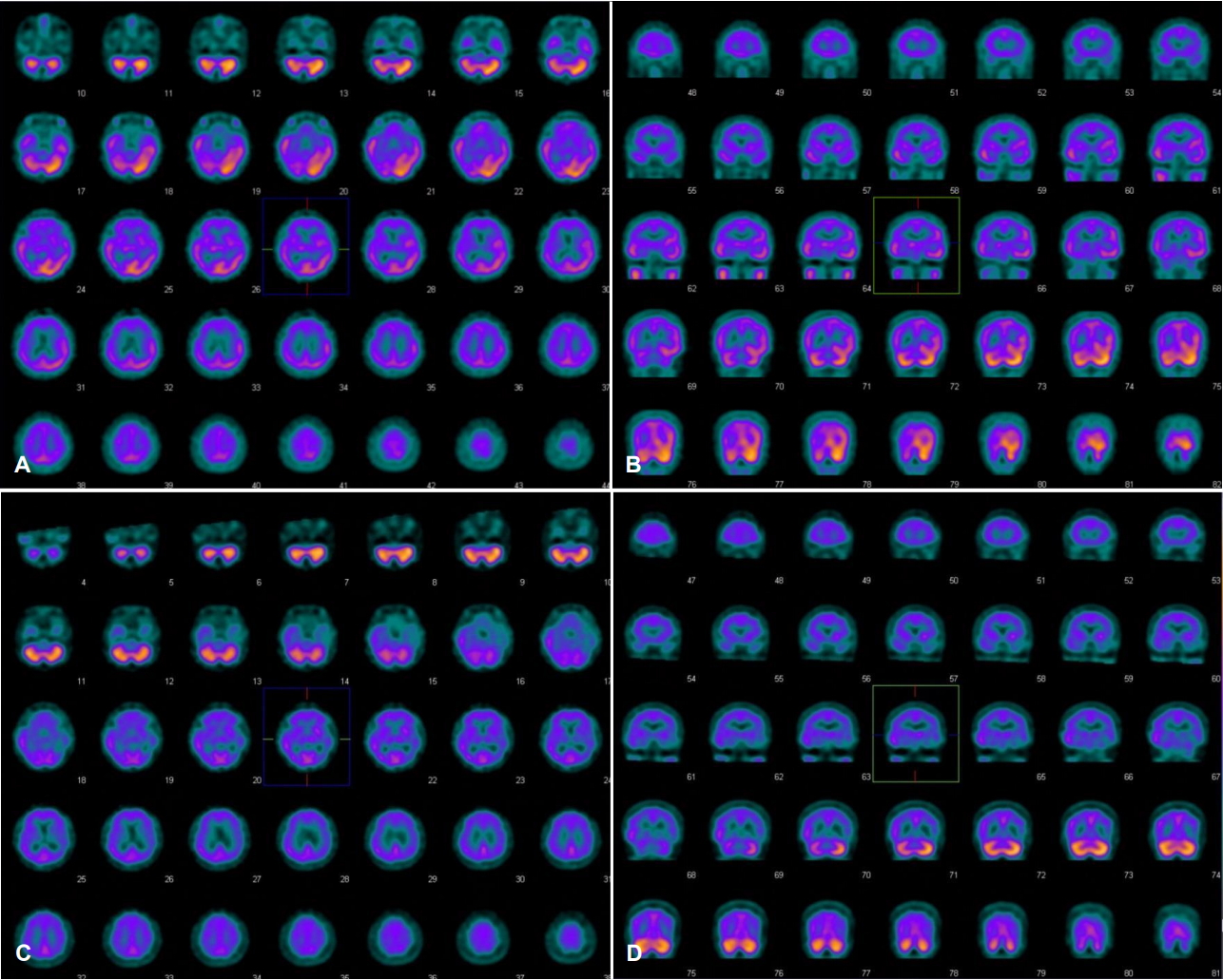
입원 4일째 시행한 단일광자방출전산화단층촬영술(single proton emission computed tomography, SPECT)상 좌측 측두엽, 두정엽, 후두엽 부위의 관류 증가 소견이 관찰되었고(Fig. 3-A, B), 비슷한 시기에 시행한 뇌파검사상 좌측 후두엽 부위의 발작간 뇌전증모양방전이 관찰되었다. 말초혈액백혈구의 미토콘드리아 DNA 서열분석을 시행하였고, 미토콘드리아 leucine 전달 RNA 3243 부위에서 아데닌 염기가 구아닌 염기로 점돌연변이가 발생한 것이 관찰되어 멜라스증후군에 합당한 소견이 관찰되었다.
발작의 재발 방지를 위하여 미토콘드리아대사에 비교적 적은 영향을 미치는 levetiracetam과 lacosamide를 투약하였고 이와 더불어 coenzyme Q10과 L-carnitine을 투여하였다. 이후 언어 재활 치료를 지속하였고, 약 한 달 후 언어의 이해 및 유창성 모두 호전되어 일상생활이 가능한 수준으로 회복하였다.
발병 약 4개월 후 추적한 검사에서 DWI에서는 확산제한 소견이 사라졌고, 같이 시행한 FLAIR에서는 좌측 측두엽의 피질하부위 일부에 신호강도 증가가 보였으나 나머지 부위에서는 신호강도 증가 및 부종은 소실되었다. SPECT 영상에서는 좌측 두정엽, 관자엽, 후두엽의 관류 감소가 관찰되었고(Fig. 3-C, D), 뇌파검사상 뇌전증모양방전은 관찰되지 않았다.
고 찰
미토콘드리아 유전질환은 비교적 드문 질환이지만 멜라스증후군은 그중에서 가장 흔한 질환으로 몇몇 증례가 보고되어 있다[1]. 멜라스증후군은 모계 유전이며, 미토콘드리아 DNA 중 leucine 운반 RNA를 encoding하는 MTLL1 유전자의 점돌연변이에 의하여 발생한다[1]. 점돌연변이 중 80% 이상을 차지하는 가장 흔한 위치는 3243이며 아데닌이 구아닌으로 치환되는 돌연변이가 발생한다. 이외에도 최소 29개 이상의 점돌연변이가 존재하는 것으로 알려져 있다[4]. 이로 인하여 미토콘드리아 내의 유산소 당합성 경로가 저해되어 무산소 당합성의 비율이 증가하게 되고 결과적으로 젖산이 축적된다. 또한 단백합성의 감소로 에너지 생성이 감소하여 내피세포기능 저해, 활성산소 증가 등으로 인하여 소혈관의 관류를 감소시키게 되며, 에너지 사용이 많은 장기의 기능장애를 일으키게 된다[5]. 근육병증, 뇌병증, 청각장애, 시각장애, 당뇨 등의 다양한 합병증이 발생할 수 있다. 뇌병증은 멜라스증후군에서 가장 흔한 합병증 중 하나이며, 일반적인 급성 뇌경색의 발병 연령에 비하여 젊은 연령(40대 이하)에서 주로 발생하게 된다[4,6].
멜라스증후군과 연관된 뇌졸중양 증상은 편마비, 피질성 반맹, 실어증 등의 국소화된 신경계증상을 나타내어 뇌졸중과 감별하기 어려운 경우도 있으나 두통, 발작, 어지러움, 인지기능의 변화 등으로 비특이적인 뇌병증 증상이 함께 나타내는 경우에는 뇌졸중과의 감별이 상대적으로 용이하다[5]. 영상 소견 또한 급성 뇌경색과 비슷하여 감별하기 어렵지만 몇 가지 구별되는 점이 있다. 먼저 주로 측두엽, 두정엽, 후두엽 등 뇌의 뒷부분을 주로 침범한다. 또한, 뇌혈관의 협착 또는 폐색이 보이지 않고, 병변의 부위가 혈관의 일반적인 지배 영역을 따르지 않는다. 일반적으로 측두엽에서 가장 먼저 병변이 발생하게 되며 이후 후두엽을 침범하게 되므로, 본 환자와 같은 병변 분포를 보이는 경우가 많다[1].
또한 대뇌피질에 가까운 부분에 병변이 주로 분포하는 것을 볼 수 있는데, 이는 에너지대사가 비교적 활발한 피질의 회백질영역이 가장 먼저 더 심하게 영향을 받기 때문인 것으로 추측된다. 수개월 후 조영증강 MRI로 경과 관찰을 하였을 때 백질의 병변은 회복되었으나 회백질에서는 피질층괴사(cortical laminar necrosis)가 발생한 경우도 있다[7]. DWI에서는 급성 뇌경색과 마찬가지로 확산제한이 관찰되지만 ADC에서는 주로 저신호강도를 보이는 급성 뇌경색과 달리 다양한 신호강도를 보이게 된다. 한 연구에서는 증상 발생 후 1주째 촬영한 ADC map에서 36%에서는 대조군에 비하여 신호강도가 증가되었고, 36%에서는 감소되었으며, 27%에서는 대조군과 같은 신호강도를 보였다[7]. 또한 SPECT에서는 ADC map의 신호강도와 무관하게 해당 부위의 관류가 증가한 소견이 관찰되었다. 이는 병변 부위의 젖산농도 증가로 인하여 혈관의 투과성, 자동조절(autoregulation)이 변화하고, 이로 인하여 관류의 증가 및 혈관성 부종이 발생하는 것에 기인하는 것으로 설명할 수 있다[7]. MRS에서는 허혈뇌졸중과는 달리 병소뿐만 아니라 병변이 없는 부위에도 젖산농도의 증가와 NAA의 감소를 보인다[7,8].
급성기 때 SPECT에서 보이는 관류 증가는 국소적인 젖산증에 의하여 나타날 수 있다. 뇌의 포도당대사에서 산소 이용이 제한되고 젖산의 과도한 침착이 나타나므로, 이에 반응하여 과관류가 나타나는 현상으로 해석이 가능하다. 또한 동반된 발작에 의하여 나타났을 가능성도 있다. 하지만 우리 환자의 경우 같은 시기의 뇌파에서 발작간 뇌전증모양방전은 보였지만 발작기 율동파는 보이지 않았으므로 발작에 의한 과관류라고 보기는 어렵다[5,9].
멜라스증후군의 진단을 위하여 근육생검을 시행하는 경우도 있다. 헤마톡실린과 에오신(hematoxylin & eosin) 염색에서 근섬유에 공포(vacuole)가 산발적으로 분포하고 그 주변을 투명한 띠가 둘러싸고 있는 것이 보인다. 많은 미토콘드리아질환에서 불균일적색근섬유(ragged red fiber)가 관찰되며 사이토크롬c산화효소(cytochrome c oxidase, COX)에 반응을 하지 않지만 멜라스증후군에서는 예외적으로 COX에 반응을 하게 된다[5]. 또한 평활근 또는 근육내 혈관의 내막을 숙신산탈수소효소(succinate dehydrogenase)로 염색시 미토콘드리아의 과증식이 보이게 된다[4]. 다른 질환과의 감별을 위하여 뇌척수액검사를 시행할 수 있고, 뇌척수액검사에서는 단백질의 증가가 보일 수 있으나 100 mg/dL를 넘는 경우는 흔하지 않고, 젖산농도의 증가를 보인다[10].
발작은 멜라스증후군의 예후에 큰 영향을 미치게 된다. 이미 에너지가 부족한 세포에서 발작이 발생하면 에너지 요구량을 더 증가시키며 반복적인 자극에 의하여 세포괴사를 일으키게 된다. 발작이 잘 조절되지 않을 경우 수개월 뒤 영상 추적검사에서 병변 부위의 증가 혹은 뇌연화증이 관찰될 수 있다[1]. 미토콘드리아 기능을 억제하는 발프론산, 페니토인 등은 경련의 발생 및 악화를 유발할 수 있어 사용하지 않는 것이 좋다[4].
멜라스증후군의 경과는 매우 다양하며 호전 및 악화가 모두 나타날 수 있다. 우리 환자처럼 임상 소견이 호전되는 경우 영상 소견도 함께 호전되는 경우가 일반적이며 MRI에서 보이는 병변이 감소 또는 소실될 수 있다[7]. 임상 소견이 악화되는 경우에는 뇌영상에서도 병변 크기의 증가, 뇌실질 부피의 감소, 피질층괴사가 나타날 수 있다[7].
멜라스증후군은 드문 미토콘드리아 유전질환으로, 뇌병증이 발생하는 경우에는 급성 뇌경색과 감별이 어렵다. 상대적으로 젊은 연령, 혈관 영역에 합당하지 않는 병변의 분포, ADC map에서의 다양한 신호강도, 정상 뇌혈관 소견, MRS상의 젖산증가 소견과 특징적인 핵의학영상 소견 등으로 뇌경색과의 감별이 가능하다. 빠른 진단과 후유증을 최소화하기 위한 적절한 치료를 위해서는 임상적 의심과 더불어 적절한 신경영상검사가 필수이다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




