다리뇌외수초용해증 환자에서 발생한 뇌전증지속상태
Status Epilepticus in a Patient with Extrapontine Myelinolysis
Article information
Trans Abstract
Extrapontine myelinolysis is a demyelinating disorder usually caused by rapid correction of chronic hyponatremia. We present an 82-year-old female patient with general weakness, and severe hyponatremia (103 mEq/L) which was corrected 14 mEq/L during 21 hours. She was stuporous and presented status epilepticus. Brain T2-weighted image showed high signal intensities of bilateral thalami and electroencephalogram monitoring indicated right hemisphere lateralized periodic discharges, maximal in the right frontal region. This case shows that status epilepticus can occur in a patient of extrapontine myelinolysis involved bilateral thalami without pontine lesions.
삼투성수초용해증후군(osmotic myelinolysis syndrome)은 수초용해 발생 부위에 따라 다리뇌 이외 부위는 다리뇌외수초용해증(extrapontine myelinolysis), 다리뇌의 중심부 발생은 중심성 다리뇌수초용해증(central pontine myelinolysis)으로 나뉘며, 이에 따라 임상양상이 다르다[1,2]. 다리뇌외수초용해증은 기저핵, 시상, 내포, 소뇌, 피질하백질, 중뇌 또는 연수를 침범하며, 마비, 보행실조, 파킨슨증, 무도증, 근긴장이상증, 근간대경련과 같은 증상이 나타난다. 다리뇌수초용해증은 마비, 구음장애, 삼킴곤란, 의식장애와 같은 증상이 나타날 수 있다[1,2]. 삼투성수초용해증후군의 가장 중요한 원인은 저나트륨혈증 및 이의 급속한 교정이며, 그 외 영양실조, 알코올 중독, 혈액 투석, 만성 신부전, 장기 이식이 있다. 저자들은 저나트륨혈증의 급속한 교정 이후 발생한 다리뇌외수초용해증에서 뇌전증지속상태가 동반된 예를 경험하였기에 이를 보고하고자 한다.
증 례
82세 여자가 5일 전부터 전신 무력감, 경구 섭취불량과 당일 발생한 구음장애와 의식저하로 내원하였다. 과거력으로 고혈압, 뇌경색 및 만성 신부전이 있었고 투석은 하지 않았다. 이뇨제가 포함된 고혈압약과 불면증으로 안정제 및 수면제를 복용 중이었으며, 항혈소판제는 복용하지 않았다. 음주 및 발작의 과거력은 없었다. 내원 당시 혈액검사 결과 당, 혈액요소질소, 크레아티닌은 정상이었고, 칼슘 7.8 mg/dL, 인산염 1.2 mg/dL, 마그네슘 0.67 mEq/L, 칼륨 2.9 mEq/L였다. 하지만 나트륨 수치가 낮게(103 mEq/L) 관찰되어 3% 식염수로 교정하였다. 내원 21시간 후 나트륨 수치는 117 mEq/L로 서서히 상승하는 양상을 보였다. 의식저하는 서서히 회복되었으나 구음장애는 점차 악화되었다.
내원 36시간 후 우측으로 얼굴경련과 안구편위 및 우측 팔을 굽힌 양상의 발작이 시작되었고 이후 전신강직간대발작으로 진행하면서 좌측 얼굴경련도 관찰되었다. 의식 회복 없이 3차례 이상, 5분 이상 발작이 지속되어 임상적으로 뇌전증지속상태로 진단하였다. 발작 직후 로라제팜 정주 및 페니토인 부하용량을 투여하였으며, 뇌 자기공명영상에서 특이 소견은 없었다. 이후 혼미한 의식상태가 지속되었고, 다음 날 전신강직간대발작이 재발하여 발프로산 부하용량 투여 후, 지속적 미다졸람 정주를 하였으며(최대 0.5 mg/kg/hr) 발작 재발은 없었다. 미다졸람 주입 이후 시행한 지속적 뇌파모니터링에서 우측으로 편위된 편측주기방전(lateralized periodic discharges)이 관찰되었으나 발작파(ictal discharges)는 나타나지 않았다(Fig. 1). 페니토인, 레베티라세탐, 라모트리진, 발프로산 및 토피라메이트를 사용하면서 미다졸람 투여는 중지하였다.
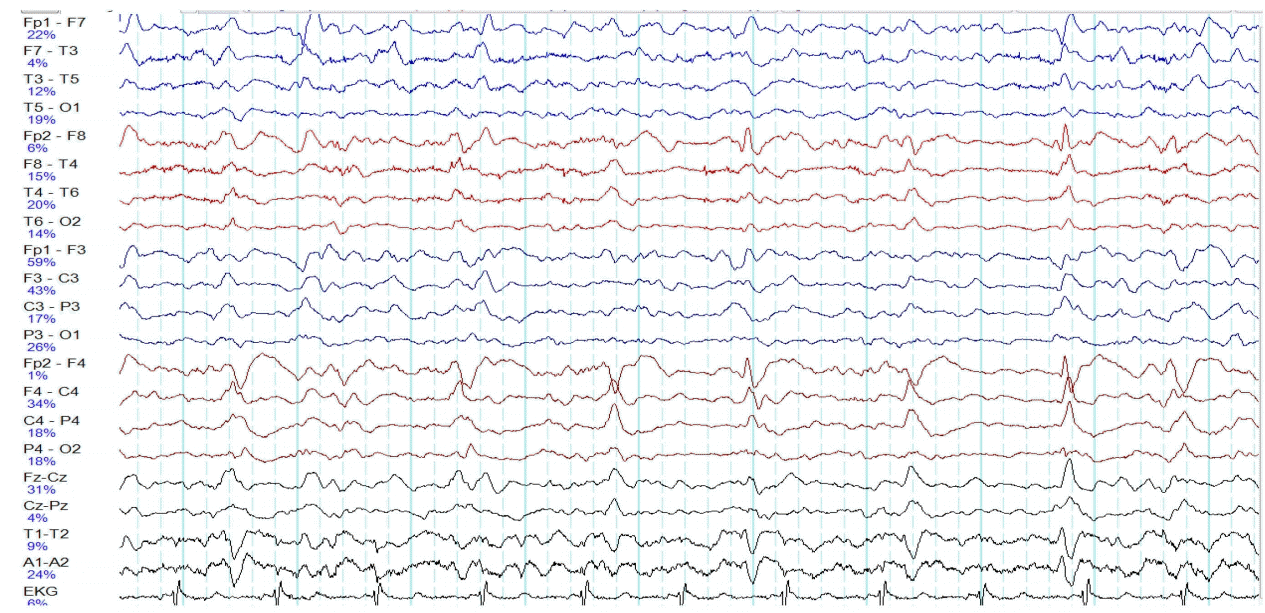
Electroencephalogram shows lateralized periodic discharges, maximal in the right frontal region at a frequency of 0.5 to 1 Hz.
발작 4일 후 추적 뇌 자기공명영상의 확산강조영상(diffusion weighted image)과 액체감쇠역전회복영상(fuid-attenuated inversion recovery image)에서 양측 시상에 대칭적으로 고신호강도가 보였다(Fig. 2-A, B). 조영증강 후 T1-강조영상에서 조영증강 병변은 관찰되지 않았다(Fig. 2-C). 임상적으로 다리뇌외수초용해증일 가능성이 높다고 생각하였으나 양측 시상에 대칭적인 병변을 일으킬 수 있는 베르니케뇌병증 및 일본뇌염의 가능성을 고려하여 이에 대한 추가 검사를 하였다. 혈청 비타민 B1은 213.2 nmol/L로 정상이었고, 혈청 및 뇌척수액의 일본뇌염 바이러스에 대한 중합효소연쇄반응검사는 음성이었다. 2주 후 추적 뇌 자기공명영상검사에서 확산제한 병변과 T2-강조영상에서의 고신호강도는 호전되었다(Fig. 2-D). 입원 1개월 이후 환자는 자발적으로 눈을 뜰 수는 있으나 명령에 따르거나 사람을 알아보지는 못하였다.

(A) DWI and (B) FLAIR brain MRI taken 4 days after the symptom onset shows high signal intensity lesions (white arrows) at bilateral thalami. (C) Gadolinium-enhanced T1-weighted image shows no abnormal enhancement. (D) DWI after 2 weeks shows slight improvement in the bilateral thalamic lesions (yellow arrows). DWI; diffusion-weighted image, FLAIR; fluid-attenuated inversion recovery, MRI; magnetic resonance imaging.
고 찰
삼투성수초용해증후군은 주로 저나트륨혈증의 급속한 교정 이후에 다리뇌 손상이 동반되지 않고 다리뇌외수초용해증만 발생하기도 하며[1-3] 본 증례에서는 다리뇌의 침범 없이 양측 시상에 국한된 병변을 보였다. 삼투성수초용해증후군에서 의식 변화는 저나트륨혈증에 의한 의식 변화와 감별이 중요하며, 이는 혈청 나트륨의 교정과 더불어 의식장애가 호전되다가 일정 기간 이후 다시 악화되는 특징적인 양상으로 감별할 수 있다[1,2]. 입원 초기에 저나트륨혈증을 급속하게 교정한 이후 일시적으로 의식수준이 호전되다가 악화되는 것으로 보아 발작 전 의식저하는 저나트륨혈증에 의한 것으로 생각된다.
본 증례의 나트륨은 3% 생리식염수로 치료하고 내원 21시간 만에 14 mEq/L 증가하였다. 의식수준은 일시적으로 호전되었으나 내원 36시간 후 전신강직간대발작이 발생하였다. 당시 나트륨은 초기와 비교하여 25 mEq/L 상승하여 과교정되었다. 삼투성수초용해증 예방을 위하여 저나트륨혈증의 교정은 24시간 동안 10-12 mEq/L, 48시간 동안 18 mEq/L를 초과하지 않아야 하며 알코올 중독, 영양실조, 저칼륨혈증 등 다른 동반 위험인자가 있을 경우에는 24시간동안 8 mEq/L 이상 교정하지 않아야 한다[4]. 다리뇌외수초용해증에서 발작이 관찰된 보고에 따르면[3], 초기 나트륨 110 mEq/L이 입원 2일째 137 mEq/L로 27 mEq/L 과교정되었고, 입원 4일째 전신발작이 나타났다. T2강조영상에서는 양측 조가비핵과 시상에 고신호 강도가 관찰되었다. 하지만 뇌전증지속상태 여부는 기술되어 있지 않으며, 시상에만 국한되어 있는 병변이 아니라는 점에서 본 증례와 차이가 있다.
삼투성수초용해증후군 환자에서 저나트륨혈증, 저혈당 등 대사 이상 자체가 원인이 되어 급성 증상 발작이 발생할 수 있으며 원인 교정을 통하여 조절할 수 있다. 하지만 본 증례에서는 저나트륨혈증의 교정 이후에 뇌전증지속상태가 발생하였고, 발작은 뇌전증약 투여 및 지속적 미다졸람 정주를 통하여 조절되었다. 또한, 저칼슘혈증, 저마그네슘혈증도 전신강직간대발작을 유발할 수 있으며, 임상증상은 수치의 저하된 정도와 관련이 있다[5]. 하지만 본 증례에서는 경미하게 감소되어 뇌전증지속상태의 주된 원인은 아닐 것으로 생각된다.
전신발작에서 시상은 시상-피질회로(thalamo-cortical circuits)를 통하여 발작의 발생 및 조절에 관여한다. 시상-피질 네트워크는 수면리듬의 형성과 유지에 중요하며 특히 전신극서파복합체 형성에 관여한다[6]. 시상을 비롯한 피질하 구조물은 발작의 역치, 지속시간 및 강도에 중요한 역할을 한다[6]. 또한 부분발작에서도 해마경화증을 동반한 측두엽뇌전증에서 같은 쪽 시상 용적의 감소가 확인되었고[7], 시상자극술로 발작의 완화가 관찰되었다[8]. 시상 외후핵(lateral-posterior nucleus)의 손상은 뇌전증 발생(epileptogenesis)의 초기 단계에서 발견되며, 만성 뇌전증 환자의 돌연사(sudden unexpected death in epilepsy)를 유발할 수 있다[9]. 이와 같은 뇌전증 병태생리와 연관된 시상의 역할을 고려할 때, 본 증례에서 확인된 양측 시상 병변이 뇌전증지속상태에 영향을 주었을 가능성이 있다. 뇌전증지속상태는 경미한 저칼슘혈증, 저마그네슘혈증 및 심한 저나트륨혈증 등 대사 이상으로 발생할 수도 있으나 나트륨 교정 이후 발생한 다리뇌외수초용해증의 증상으로 나타날 수 있으므로 주의가 필요할 것으로 판단된다.