파킨슨병의 약물 치료
Pharmacological Treatment in Parkinson’s Disease
Article information
Trans Abstract
Parkinson’s disease is one of the most common neurodegenerative disorders world widely. Although curable therapies are practically not available yet, symptomatic managements using anti-Parkinson medications have shown to be quite effective to improve patients’ quality of life. The discovery of dopaminergic deficits in Parkinson’s disease in 1960s have brought about the human clinical trials of levodopa, which opened an “Era of Dopamine” in treatment history of the Parkinson’s disease. Levodopa still remains gold standard. Dopamine agonists have proved their efficacies and delayed the development of long-term complications of levodopa use. Inhibitors of respective enzyme monoamine oxidase-B and catechol-O-methyltransferase, anticholinergics, and amantadine strengthen the therapeutic effects via either monotherapy or adjunctive way. Strategy of continuous dopaminergic stimulation and disease modification are weighing in current advances. This article is providing evidence-based review of pharmacological treatment of Parkinson’s disease from early to advanced stages as well as management its unavoidable adverse reactions.
서 론
파킨슨병은 알츠하이머병에 이어 노년기에서 관찰되는 가장 흔한 신경퇴행질환 중 하나로 운동완만, 경축, 안정시떨림 그리고 보행 및 균형장애 등의 운동장애를 특징으로 하는 질환이다. 현재는 그동안의 다양한 연구 및 관찰 등을 통하여 인지, 정동, 수면, 자율신경계, 통증 등 다양한 비운동장애도 수반하는 종합적인 퇴행질환으로 인식되고 있다.
생명체의 운동 조절에 도파민이 중요하고 특히 뇌 안에서는 선조체에 많이 분포하고 있다는 점을 Arvid Carlsson (2000년 노벨 생리의학상 수상) 등이 1950년대에 처음 발견한 이후 Hornykiewicz는 더 나아가 파킨슨병 환자의 중뇌 흑색질 내에 도파민이 현저히 감소되어 있는 것을 발견하여 파킨슨병 환자의 병인에 도파민의 소실이 핵심적 소견임을 발표하였다. 이를 바탕으로 1967년 Cotzias 등이 파킨슨병 환자를 대상으로 최초의 레보도파 치료를 성공함으로서 파킨슨병 치료에 있어 도파민의 시대(Era of Dopamine)가 열리게 되었다. 특히 당시 환자들의 획기적인 임상적 호전은 의미 있는 치료가 어려웠던 신경퇴행질환 연구에 중요한 전환점이 되었다[1].
이후 항콜린성제제의 임상적 이용이 있었으나 효과는 기대보다 미미하였고, 1980년대 이후 모노아민산화효소B억제제(monoamine oxidase-B [MAO-B] inhibitor)와 도파민 작용제(dopamine agonist)가 출시되면서 단독 및 추가 요법을 통하여 의미 있는 개선을 보여주었다. 도파민 약제의 오랜 치료 경험은 운동기복 현상(motor fluctuation)이나 이상운동증(dyskinesia) 등의 장기 부작용(long term complication)을 알게 해주었고, 이에 대한 예방 및 치료를 위하여 최대한 생리적으로 뇌 내 도파민 자극을 유지하고자 하는 지속적인 도파민 자극(continuous dopaminergic stimulation) 연구들이 이루어지게 되었다. 최근 들어서는 파킨슨병의 비운동증상뿐만 아니라 신경보호 효과를 위한 연구들이 활발하게 이루어지고 있다.
현 시점에서 파킨슨병은 질환의 근본적인 해결은 어렵지만 적극적인 대증 치료를 통하여 삶의 질을 의미 있는 수준으로 개선시킬 수 있다. 본 종설에서는 임상 현장에서 파킨슨병 환자의 일차 진료에 도움이 되고자 파킨슨병의 초기 및 진행 단계에 따른 약물 치료에 대하여 근거 중심으로 정리해보고, 치료 과정에서 발생 가능한 부작용의 대처에 대해서도 살펴보고자 한다.
본 론
1. 초기 파킨슨병의 약물 치료
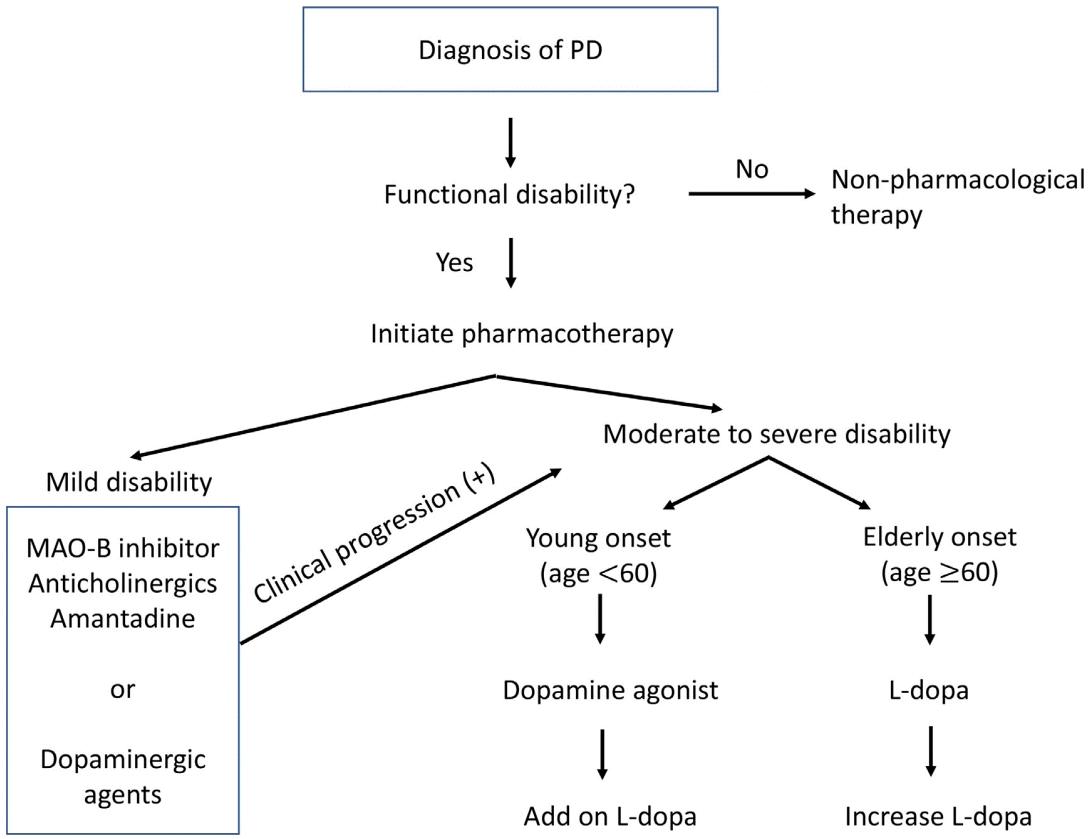
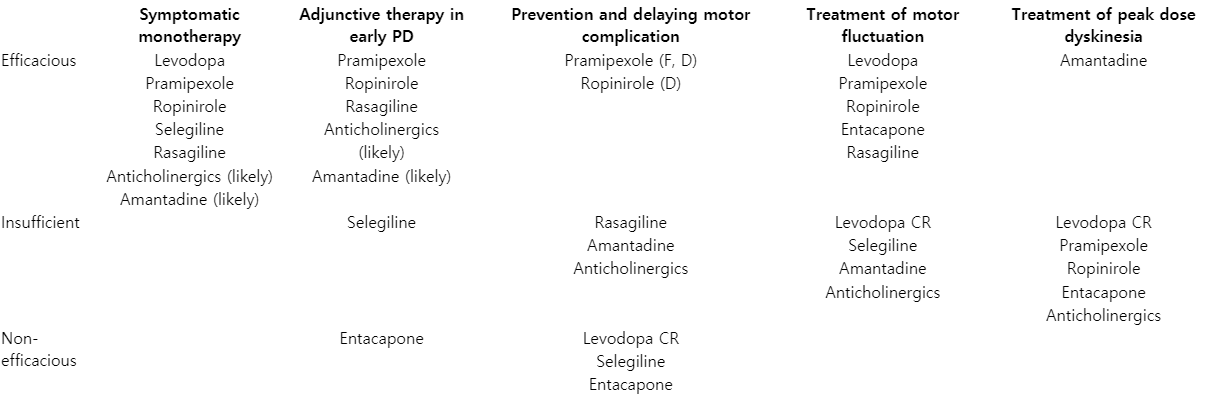
파킨슨병 치료를 위한 항파킨슨 약제의 연구 및 개발은 현재까지도 다양하게 시도 및 진행되고 있는데 충분한 과학적 근거와 임상적 경험을 갖춘 약으로는 레보도파, 도파민 작용제, MAO-B억제제, catechol-O-methyltransferase (COMT)억제제, 항콜린성제제, 아만타딘이 있다(Table 1). 파킨슨병 환자를 처음 진단하였을 때 약물 치료를 시작하는 시점은 개별 환자들이 기능적, 사회적 관계의 곤란함을 경험하기 시작하는 시기를 기준으로 삼는 것이 좋다. 연령과 임상양상의 정도가 주요 기준이 되며 기타 직업 환경, 인지 및 행동장애 유무, 동반 질환 등 다양한 요소에 대한 고려를 바탕으로 맞춤형 치료(tailored therapy)를 시작하는 것이 핵심이다. 역사적으로 약물 치료 시작을 진단 초기에 시작하는 것이 좋을지, 아니면 증상이 어느 정도 진행되는 시점까지 최대한 지연시키는 것이 좋을지에 대한 질문들이 꾸준히 있어 왔다. 특히 도파민 약제의 신경독성에 대한 연구 결과들이 보고되면서 이에 대한 지속적인 논란 및 의문은 학문적 논쟁을 불러 일으키기도 하였다. 몇몇 연구들에서 서로 상반되는 결과들이 있긴 하였지만[2,3], 현재까지의 결론은 다음과 같다.
1) 임상에서 사용되는 일반적 용량을 이용한 장기간 도파민 치료 시 대부분의 동물 및 인체 대상 연구에서 도파민 신경세포 소실의 가속화는 관찰되지 않았다[4,5]. 파킨슨병 치료의 메타분석에서도 도파민 치료를 받은 군이 그 어떤 사망이나 치명적 부작용의 발생이 높지 않았다[4].
2) 15년 이상의 도파민 치료를 받은 파킨슨병 환자군의 사후(postmortem) 뇌 병리 연구에서 도파민 복용량과 뇌 내 레비소체(Lewy bodies) 침착 사이에 의미 있는 관련성은 발견되지 않았다[2].
3) 도파민의 신경독성에 대한 거의 대부분의 보고는 생체 외(in vitro) 혹은 동물실험 등 실험실 연구가 주를 이루며, 생체 내(in vivo) 연구 근거는 뚜렷하게 보고된 바가 없다.
레보도파의 조기 투여는 지연 치료보다 삶의 질을 향상시키고[6], 기저핵 내 손상된 도파민 회로를 최대한 생리적인 상태에 가깝게 안정화시키는 효과도 있는 것으로 알려져 있어[7] 환자의 증상이 치료를 필요로 하는 상태라면 적극적인 치료를 하는 것이 도움이 되겠다. 단, 초기 파킨슨병 환자에서 레보도파의 지연 치료 여부를 통하여 질병-조절 효과(disease-modifying effect) 유무를 확인하고자 하였던 최근 연구에서는 조기 투여군에서 해당 효과가 존재하지 않는 것으로 확인되는 등[8] 아직까지 이에 대한 근거는 확립되어 있지 못하다.
일단 약물 치료를 시작하기로 하였다면 가장 우선 고려할 수 있는 사항은 임상증상의 정도(severity)가 될 수 있을 것이다. 파킨슨 증상이 심하지 않은 경증 환자의 경우에는 MAO-B억제제, 아만타딘 그리고 항콜린성제제를 이용한 단독 요법으로 시작이 가능하며, 증상이 중등도 이상인 환자는 초기부터 레보도파나 도파민 작용제 등의 투여를 고려할 수 있다.
MAO-B억제제는 도파민 분해효소 중 하나인 MAO-B를 억제함으로써 도파민 분해를 제한하고 이용률을 증가시킨다. MAO-B억제제 중 selegiline의 경우 레보도파와 함께 투여 시 위약군에 비하여 통합파킨슨병척도(Unified Parkinson’s Disease Rating Scale, UPDRS) III 점수가 개선되고 장기 부작용이 적게 관찰되었으며 레보도파 사용량이 적었다는 보고가 있다[9]. Rasagiline은 질병 초기 환자에서 단독 요법[10,11] 및 추가 요법[12] 모두에서 적은 부작용과 임상 효과를 입증하였다. MAO-B억제제의 부작용으로는 두통 및 어지럼 등 비특이적 증상이 발생할 수 있으며, 기타 도파민을 증가시키는 기전의 약물인 만큼 이와 관련한 부작용들이 나타날 수 있다. 또한 고용량 투여 시 MAO-A까지 억제되어 체내 티라민(tyramine) 증가에 의한 악성 고혈압이(cheese effect) 발생할 수 있는 것으로 알려져 있으나 권고 용량 범위 내 치료에서는 매우 드물고 안전한 편이다[13]. 보통 하루 1회나 2회 투약하므로 복용의 간편성이 장점으로 꼽히며, selegiline과 달리 rasagiline은 MAO-B를 비가역적으로 억제하고 암페타민으로 대사되지 않기에 불면증이나 교감신경흥분 작용이 없는 것이 특징이다.
항콜린성제제는 선조체의 무스카린수용체에 작용하여 도파민과 아세틸콜린 사이의 균형을 유지하며, 기타 도파민의 재흡수를 억제하여 도파민의 효과를 증진시키는 것으로 알려져 있다[14]. 파킨슨병에서 사용 가능한 종류에는 trihexyphenidyl, benztropine, procyclidine, diphenhydramine 등이 있으며, 단독[15] 및 추가 요법[16] 등을 통하여 운동증상을 개선시키나 효과는 경미한 수준이고 떨림증상에 대하여 더 특별한 효과가 존재하는지에 대해서는 서로 상반되는 결과들이 있어 확정적으로 결론 내리기 어렵다[17]. 구갈, 변비, 시야 흐림, 요 저류 등이 일반적인 부작용이며 폐쇄각녹내장, 빈맥, 전립샘비대증 환자에서는 중지 혹은 주의를 요한다. 특히 고령 환자에게 투여 시에는 환시, 인지저하, 혼돈 및 이상행동 등의 정신증상이 발생할 수 있으므로 세심한 추적관찰을 요한다.
아만타딘의 기전에 대해서는 아직 명확히 밝혀지지 않은 면이 있으나 N-methyl-D-aspartate 수용체 차단이 주된 작용으로 여겨지고 있으며 기타 항콜린성 작용 및 도파민의 분비 작용도 있는 것으로 사료된다. 단독[18] 및 추가 요법으로[19] 증상 개선에 효과가 있는 것으로 알려져 있으나 역시 오래된 연구들이 많고 연구 규모가 작으며 연구 설계에 문제가 지적된 경우도 있어 해석에 유의할 필요가 있다[20]. 결론적으로는 초기 파킨슨병 증상의 개선에 도움이 되는 것으로 생각되고 있으나 호전 정도가 크지 않아 단독 요법으로 많이 쓰이지는 않는다. 비교적 흔한 부작용으로는 두통 및 오심(5-10%) 등이 있으며 기타 어지럼, 불면, 불안 등이 발생 가능한데 대부분 정도는 경하다. 기타 하지에 그물망 형태의 혈관염인 그물울혈반(livedo reticularis)이 특이적으로 발생할 수 있으며(<5%), 항콜린성 부작용에 의한 이상행동 및 정신증상, 혼돈, 구갈 등이 발생 가능하므로 주의를 요한다[20].
상기 언급한 약제들을 투여함에도 임상적 호전이 적거나 시간이 경과하면서 증상이 진행할 경우에는 본격적으로 레보도파나 도파민 작용제를 고려한다. 인체 내에서 도파민은 혈액뇌장벽(blood-brain barrier)을 통과하지 못하여 중추신경계에 도달할 수 없기 때문에 실제 복용은 도파민의 전구체로서 혈액뇌장벽의 통과가 가능한 레보도파를 이용하게 된다. 하지만 체내에 흡수된 레보도파는 혈액뇌장벽 도달 전 체내 대사를 통하여 말초에서 도파민으로 변환이 가능하기에 이를 최소화하고자 전환효소억제제(dopamine decarboxylase inhibitor)인 carbidopa 혹은 benserazide와 결합한 복합 제형으로 제조가 이루어진다. 레보도파는 1960년대 처음 소개된 이후 치료의 최적표준(gold standard)으로 여겨질 정도로 가장 큰 임상적 효과를 지니며[20,21], 고용량일수록 효과도 크게 관찰된다[4]. 그리고 도파민작용제에서 관찰될 수 있는 다양한 부작용의 발생 빈도가 적은 점 역시 큰 장점으로 여겨진다. 표준형 제제의 짧은 반감기를 극복하고자 서방형 제제가 1980년대에 출시되어(Sinemet CR; MERCK & Co., Inc., Whitehouse Station, NJ, USA) 약효 지속 시간을 연장시키는 등 기대를 불러 일으켰다. 하지만 불안정한 약력학적 특징으로 인하여 체내 흡수가 불규칙하여 약효의 발생이 지연되거나 나타나지 않는 등 예측 불가한 점이 관찰되었고, 약물 유발 이상운동증을 더 악화시키기도 하는 단점이 보고되는 등 임상 적용 시 이들에 대한 고려가 필요하다[22]. 레보도파의 부작용으로는 위장관에 작용하여 오심, 구토 등이 비교적 흔하게 유발될 수 있으며, 중추신경계에 작용하여 정신증상, 환각, 수면장애 등이 발생할 수 있다. 또한 장기간 복용 시에는 약효 지속 시간이 짧아지거나 불규칙해지는 운동기복 증상 및 약물에 의하여 과운동 현상이 나타나는 이상운동증이 발생할 수 있다.
도파민작용제는 도파민 자체는 아니지만 도파민수용체에 대한 촉진 작용을 통하여 항파킨슨 작용을 나타내는 것으로 알려져 있다. 초기 운동증상 치료에 효과가 좋고[23], 레보도파에 비하여 약물 유발 이상운동증의 발생이 적어[24,25], 특히 조기 발현(young onset) 환자에서 도파민 장기 투여 부작용의 예방 및 지연을 위하여 단독 요법으로 시작하는 것이 도움이 된다. 그러나 일반적으로 약 2-5년 이상의 시간이 경과하면 도파민작용제만으로는 증상 조절이 어려워 레보도파를 투여하게 되는 경우가 많다[26]. Ergot과 비ergot 계열로 분류하며, 전자의 경우 pergolide, cabergoline, dihydroergocryptine, bromocriptine, lisuride 등이 있는데 심장판막질환을 비롯하여 심장, 폐, 후복막 등에 발생하는 섬유화 및 다양한 부작용들로 인하여 전 세계적으로 최근에는 투여 빈도가 줄었으며 1차 도파민 작용제로 권고되지 않는다[27]. 특히 pergolide의 경우 심장판막질환 발생 위험으로 2007년 미국 및 국내에서는 시판이 중지되었다. 후자에 해당하는 약물에는 pramipexole, ropinirole, apomorphine, piribedil 등이 있으며 약물의 효과 및 부작용 등 모든 면에서 전자와 비슷한 수준이거나 우월하다. 각각의 도파민작용제는 다양한 수용체 아형(dopamine receptor subtype)에 대한 친화성이 서로 다른데, cabergoline이나 pergolide는 D2 외에 D1수용체에도 상대적으로 강하게 작용하고 기타 다수의 ergot 계열 약제들이 D3수용체 친화성이 강한데 반하여 pramipexole과 ropinirole은 주로 D2수용체에만 작용하는 것으로 알려져 있다. 항파킨슨 효과는 주로 D2수용체 자극과 관련이 많고, D1수용체는 이상운동증 발생에 역할을 하는 것으로 생각되고 있으며, D3수용체의 항파킨슨 효과는 아직 구체적으로 알려진 바가 없다. 국내에서 주로 사용되는 pramipexole [28,29]과 ropinirole [30-32]의 경우 표준형과 서방형 등 다양한 제형에서 광범위하게 효과를 입증하였다. 부작용은 전신에 분포하는 도파민수용체에 작용하였을 때 발생 가능한 증상들을 생각해볼 수 있겠다. 위장관계에 작용하여 오심, 구토를 유발할 수 있으며, 심혈관계에 작용하여 기립저혈압, 다리 부종 등을 나타낼 수 있다. 신경계에 작용하여 과도한 주간 졸림, 이상행동 및 정신증, 환각 등을 유발할 수 있으며, 이러한 부작용들은 같은 도파민제제인 레보도파보다 더 높은 비율로 관찰되는 편이므로[33] 투여에 주의를 요한다. 특히 고령에서는 인지저하, 환시, 혼돈, 저혈압 등의 발생 위험이 높으므로 더욱 세심한 추적관찰이 필요하다.
상기 열거한 약물들의 임상적 개선 효과를 UPDRS III를 통하여 대략적으로 비교해보면 레보도파는 약 7-8점, 도파민작용제는 약 3-5점 그리고 MAO-B억제제는 약 2-3점 정도로 알려져 있다[34]. 정리해보면 증상이 경한 초기에는 비도파민 약물 등으로 시작이 가능하나 추후 시간이 경과하면서 증상이 진행될 경우 궁극적으로는 레보도파나 도파민작용제 등 조금 더 효능이 강한 약물을 필요로 하게 되며 이 때 증상의 정도나 환자의 연령, 인지저하 여부 등을 고려하여 적절한 약물의 선택이 중요하다. 이후 도파민 장기 치료 부작용이 발생하기 전까지는 레보도파나 도파민작용제의 추가 및 증량 혹은 다른 종류로 변경 등을 통하여 진행되는 증상에 대한 적절한 대응을 하며 치료를 유지할 수 있다(Fig.).
2. 진행기 파킨슨병 약물 치료
파킨슨 약물 치료 시작 후 초기 3년 정도의 별다른 부작용 없이 증상 조절이 잘 되고 안정적인 시기를 “밀월 기간(honeymoon period)”이라 부르는데, 이 시기가 지나고 나면 대략 5년 기점 약 30-50%의 환자에서 도파민 장기 치료에 의한 부작용이 발생하기 시작한다. 대표적으로 운동기복 현상과 이상운동증이 있으며 기타 보행 동결, 균형장애, 체간증상 등 약물로 조절이 어려운 증상들이 동반되기 시작하는데 이를 진행기(advanced stage)로 판단한다. 운동기복이란 파킨슨 약물 복용에도 불구하고 약효 지속 시간이 짧아지고 불규칙하게 사라지기도 하는 등 약효 종료 시간(off time)의 출현을 일컫는다. 즉, 주간 약물 복용 시간 중 늘 약효 개시 시간(on time)만 존재하던 상황에서 약효 종료 시간이 간헐적으로 발생하기 시작하면서 개시와 종료 시간이 서로 교대되고 요동침을 뜻한다. 다음 약 복용 전 약효가 소진되고(wearing off), 약효 발현이 지연되거나 아예 나타나지 않으며(delayed or no on), 개시와 종료 시간이 불규칙하게 반복되거나(random on-off) 또는 갑자기 약효가 사라지기도(sudden off) 하는 등 다양한 형태가 존재한다. 이상운동증은 레도도파나 도파민작용제 복용 후 과운동이 발생하는 것을 의미한다. 약물의 혈중 농도가 높을 때 주로 발생하며(peak dose dyskinesia), 무도증(choreiform) 형태가 가장 흔하고 기타 근긴장이상(dystonia)이나 근간대경련(myoclonus) 형태를 보이는 경우도 있다. 드물게는 이상성 이상운동증(diphasic dyskinesia)이라 하여 1회 약물 복용 후 약효가 시작되거나 약효가 사라지기 시작할 때 각 1회씩 전체 2회에 걸쳐 이상운동증이 발생하는 경우도 있으며 주로 하지에 발생한다. 이상운동증은 임상증상이 심할수록, 도파민 약제 치료 기간이 길수록, 복용량이 고용량일수록 그리고 젊은 연령일수록 높은 발생률을 보인다[35].
환자에게 상기의 장기 치료 부작용이 발생하였을 경우에는 세심한 병력 청취 및 진찰을 통하여 어느 유형인지를 확인하고, 약물 복용 시점과 상관관계를 유추하는 것이 추가적인 약물 조절에 핵심적이다. 파킨슨 일기를 통하여 환자나 보호자가 직접 체크하도록 하는 것이 실질적인 도움을 줄 수 있다. 단, 모든 이상운동증을 치료할 필요는 없다. 증상 조절을 위한 약물 감량 혹은 증량은 또 다른 증상의 악화로 이어질 수 있기에 환자가 해당 증상에 대하여 불편을 느끼는 정도에 따라 판단을 할 필요가 있다. 환자들의 선호도가 개별적으로 다를 수 있지만 보통 이상운동증이 있더라도 약효 개시 시간을 이상운동증이 없는 약효 종료 시간보다 더 선호하는 경우가 많다[14].
3. 운동기복의 치료
운동기복의 여러 현상 중 가장 대표적인 것은 약효 소진이다. 약효 소진 현상은 다음 도파민 약제 복용 전에 약효가 감소하는 것으로 도파민 절전신경의 도파민 저장 및 완충 능력(presynaptic storage and buffering capacity)의 저하 및 절후신경의 수용체 변이에 따른 현상으로 추정된다. 약효 소진으로 인한 약효 종료 시간 증가를 감소시키기 위해서는 1) 레보도파 1회 복용량을 증가시키거나 2) 복용 횟수를 증가시키거나 3) 혹은 다른 종류의 파킨슨 약제를 추가하는 전략을 고려해볼 수 있다. 4) 아울러 이상운동증이 동반된 환자의 경우라면 1회 용량을 줄이는 대신 복용 횟수를 증가시키는 분획화(fractionation) 방법도 좋은 효과를 기대할 수 있다.
도파민 혈중 농도를 비교적 일정하고 연속적으로 유지시키는 전략의 일환으로 탄생한 레보도파 서방형 제제는 연장된 약효 시간으로 종료 시간의 감소가 기대되었으나 아쉽게도 의미 있는 class I 연구가 있지 못하였다. 대부분의 연구에서 표준형 제제와 차이가 없거나 있더라도 사소한 수준이었고 효과가 오래 지속되지 못하여 실질적으로 긍정적인 효과를 보이지는 못하였다[18,36,37]. 또한 도파민 장기 치료 부작용의 예방 및 지연이라는 측면에서도 의미 있는 결과를 보여주지 못하였다. 최근에는 이를 개선한 서방형 제제인 Rytary (Impax Laboratories, Inc., Hayward, CA, USA)가 운동기복과 이상운동증을 감소시키고 약효 개시 시간을 의미 있게 연장시킨 것으로 보고되었으며[38] 이를 바탕으로 2015년 미국 식품의약국에서 판매 허가를 받았다. 기타 최선의 파킨슨 약물 치료를 시행함에도 약효 종료 시간이 발생하는 진행기 환자를 대상으로 위장관 펌프를 이용한 도파민 젤(Abbvie Inc., North Chicago, IL, USA) 투여 치료 역시 표준형 도파민 제형에 비하여 약효 종료 시간을 1.91시간 정도 감소시키고, 이상운동증 없는 약효 개시 시간을 1.86시간 정도 증가시키는 등 진행성 파킨슨병 치료에서 의미있는 결과를 보여 주었다[39]. 하지만 경피공장조루술(percutaneous jejunostomy)을 시행해야 하는 불편함이 있고, 치료 유지에 고비용이 요구되는 등 아직 해결되어야 할 단점들이 있다. 기타 흡입형 또는 경피적 패치 제형의 레보도파가 임상시험을 통한 연구 중에 있다[40,41].
도파민작용제는 레보도파보다 긴 반감기를 바탕으로(6-8시간 vs. 1-1.5시간) 지속적인 도파민 자극 측면에서 레보도파보다 유리하다. 아울러 도파민작용제 투여에 따른 레보도파 감량 효과도 기대해볼 수 있기에 이상운동증의 치료에 있어서 도움이 된다. Pramipexole [42,43]과 ropinirole [44,45] 모두 운동기복 현상의 치료에 있어 표준형, 서방형 제제의 근거가 있으며, 도파민작용제는 여러 파킨슨 약제 중 도파민 장기 치료 부작용의 발생을 거의 유일하게 지연시킬 수 있는 효과를 가진 것으로 알려져 있다[23,46,47].
COMT는 레보도파의 대사 및 분해에 관여하는 효소로 이에 대한 억제제를 통하여 체내 도파민 사용을 증진시킨다. Entacapone과 tolcapone이 있으며 최근에는 opicapone이 미국 식품의약국의 허가를 받았다. 국내에는 entacapone만이 출시되어 있으며 이는 말초에 존재하는 COMT에 단독으로 작용하여 레보도파가 중추신경계에 도달하기 전 분해를 억제한다. 반면 tolcapone은 말초 및 중추신경계에 모두 작용하여 레보도파의 생체 이용률을 증가시킨다. 단독 요법의 근거는 없으며 운동기복 증상이 있는 진행성 파킨슨병 환자에서 도움이 된다. 단, 운동기복 증상이 없는 초기 환자에서 추가 요법은 위약 대비 우위를 보이지 못하였으며 기타 이상운동증의 발생 위험을 증가시킬 수도 있는 것으로도 알려져 있으므로 처방에 유의를 요한다[20]. COMT억제제는 궁극적으로 도파민 효과를 증진시키는 기전의 약물이기에 도파민 증진 계열 약제들에서 공통적으로 관찰되는 부작용을 보일 수 있다. 어지럼, 오심 등이 대표적이며, 소변이나 땀 등이 적갈색 변색을 보이기도 하는데 이는 약제의 대사 과정에서 발생하는 산물로 인체에 유해성은 없으나 환자 및 보호자들이 예기치 못하게 당황하는 경우가 있으므로 투약 전 미리 고지할 필요가 있다. Tolcapone의 경우는 드물지만 전격간기능상실(fulminant hepatic failure) 같은 심각한 간독성을 보일 수 있으며, 이에 대한 예방을 위하여 투약 기간 중에는 간수치에 대한 정기적인 혈액검사 모니터링을 필요로 하는 번거로움이 요구된다.
MAO-B억제제는 단독 요법 외에 운동기복 환자의 추가 요법에서도 약효 시간을 증가시키는 것으로 알려져 있으며 selegiline과 rasagiline 모두 임상적 근거를 갖추고 있다[23]. 최근에는 새로운 MAO-B억제제인 safinamide도 운동기복 현상에서 추가 요법에 대하여 임상적 효과를 입증하여 미국 식품의약국의 허가를 받은 바 있다[48]. 기타 아만타딘과 항콜린성제제의 운동기복 현상에 대한 치료 근거는 부족하다[23].
4. 이상운동증의 치료
이상운동증은 아직 치료가 제한적이다. 레보도파를 분획화해서 복용하는 방법이 도움이 될 수 있겠으나 증상이 심하게 진행한 환자들의 경우에는 하루 중 이상적인 조절 시간 없이 오직 심한 약효 종료 시간과 이상운동증만 관찰되기도 하는 등 전략적으로 한계가 있다. 아만타딘은 거의 유일하게 이상운동증의 치료에 과학적 근거를 보인 약제로 진행성 파킨슨 환자에서 이상운동증의 정도와 시간을 감소시킬 수 있는 것으로 알려져 있다[23]. 하지만 이러한 효과가 8개월 이내로 비교적 짧게 유지된다는 보고도 있어 해당 현상을 완전히 해결하기에는 미흡하다[49]. 항정신병 약제 중에서는 clozapine이 소규모 연구에서 이상운동증의 감소에 효과를 보였으며 아만타딘으로 조절에 제한이 있는 환자의 경우에 투여를 고려해볼 수 있다[20]. 기타 다른 파킨슨 약제는 유의미한 치료 효과를 입증하지 못하였다(Table 2).
5. 약물 부작용 및 대처
1) 어지럼과 오심
도파민 약제를 복용하는 파킨슨병 환자에서 약 20% 수준까지 비교적 흔하게 발생할 수 있는 부작용이며[50] 말초에서 레보도파의 도파민 전환에 의한 위장관 운동저하로 발생한다. 도파민 전환효소억제제인 carbidopa나 benserazide 혼합 제제를 사용하는 중요한 이유이기도 하다. 증상 조절을 위해서는 도파민 약제를 천천히 증량하거나 필요 시 식사와 함께 복용하도록 하는 것이 도움이 된다. 레보도파는 음식물, 특히 단백질 성분과 경쟁적 흡수가 이루어지면서 70% 정도까지 흡수율이 저하될 수 있기 때문이다. 기타 대증 치료를 위하여 추가적인 carbidopa 복용이나 말초성 D2수용체 길항제인 domperidone 등을 통하여 증상을 개선할 수 있으나 후자의 경우 QT연장에 의한 급성 심장발작 등 심장독성이 이슈화되어 2014년 유럽에서는 투여 제한을 발표하기도 하는 등 투약에 주의를 요한다. 기타 metoclopramide, levosulpiride, prochloperazine, promethazine 등은 중추 D2수용체에도 작용하여 파킨슨 증상을 악화시킬 수 있으므로 가급적 피하도록 한다.
2) 정신증상
파킨슨병 치료 과정 중 발생하는 정신증상에는 망상, 환시 등이 대표적이며, 많은 경우 60%까지 발생할 수 있고 인지저하가 있는 경우에는 75%까지 관찰되는 등 발생률이 낮지 않다[51]. 가능한 원인은 대단히 광범위하다. 간, 신장기능 저하, 전해질 불균형 등 다양한 대사질환과 내분비질환부터 감염, 뇌 내 구조 병변 등에 이르기까지 여러 일차적 원인들에 대한 감별이 필요하며 최종적으로 상기 요인들에 해당이 없다면 도파민 약물 부작용이나 인지저하 등에 의한 발생을 우선 고려할 수 있다. 증상 개선을 위하여 투여 중인 도파민 약물 감량을 고려할 수 있겠으며, 단 이로 인하여 파킨슨 증상의 악화가 가능하기에 환자의 임상증상과 타협을 통하여 판단을 하는 것이 좋겠다. 항정신병 약물 중에서는 clozapine이 대증 조절에 효과를 입증하였으며 quetiapine 역시 도움이 되나 무작위 연구들에서는 의미 있는 결과를 보여 주지 못하였다[20]. Clozapine의 경우 부작용으로 무과립구증(agranulocytosis)이 발생가능하므로 정기적인 채혈검사를 요한다. 최근에는 세로토닌 수용체에 작용하는 pimavanserin이라는 약제가 파킨슨병에서 운동증상 악화 없이 정신증상을 유의미하게 개선시킨 것으로 보고가 되어 추후 국내 도입이 기대가 된다[52]. 기타 인지저하 여부에 대한 확인이 도움이 될 수 있겠으며, donepezil과 rivastigmine 투여 후 증상 호전 등에 대한 연구가 있다[20].
3) 충동조절장애
주로 도파민작용제에 의하여 발생하는 경우가 많으나 레보도파나 기타 제제에 의해서도 발생 가능하며, 파킨슨병 환자의 14-60% 수준에서 관찰되는 것으로 알려져 있다[53]. 강박적 쇼핑, 섭식, 도박 그리고 과도한 성충동 등을 특징으로 하며, 위험인자로는 조기 발병, 남성, 과거 우울증이나 물질 중독, 충동조절장애의 병력 및 가족력이 있는 경우 그리고 렘수면장애나 이상운동증 등이 있으므로 해당 요인이 있는 환자의 경우에는 치료에 주의를 요한다. 증상 발생 시에는 도파민작용제의 감량 및 중단 등이 필요하다. 대부분의 충동조절장애는 잘 조절이 되는 편이나 난치성 경과를 밟는 경우도 있다. 도파민작용제 감량 및 중단 과정에 도파민작용제금단증후군(dopamine agonist withdrawal syndrome)이 발생하여 정신증, 불안, 우울, 피로, 약물 갈망 등이 나타날 수 있으므로 필요시 주의깊은 대증 치료를 요한다. 도파민작용제 감량에 따른 파킨슨 증상 악화는 레보도파 증량 등을 통하여 증상 개선을 시도해볼 수 있다. 기타 근거등급이 낮고 소규모 연구들이긴 하지만 아만타딘, 발프로산, zonisamide, topiramate 등을 이용하여 증상 개선을 이루었다는 연구 결과들도 있다[20].
4) 저혈압
진행성 파킨슨병 환자의 약 30% 정도에서 비교적 흔하게 관찰되는 현상으로[54] 비운동증상인 자율신경장애가 원인일 수 있지만 파킨슨 약물의 부작용으로 더 발생 가능하므로 이에 대한 감별을 요한다. 처음부터 약물 조절을 시도하기보다는 생활 교정을 통한 치료를 우선 시도해볼 수 있다. 한 번에 과량의 식사나 음주, 과도한 땀 분비를 피하고, 고혈압이나 배뇨장애에 대한 약물을 복용하고 있다면 해당 약들에 대한 조절을 고려한다. 염분 함유 식이 및 충분한 수분 섭취, 수면 시 상체를 살짝 거상하거나 압박스타킹을 이용해볼 수도 있다. 도파민작용제나 레보도파를 감량해볼 수 있으며 전자가 저혈압 발생 비율이 더 높고 도파민 효능이 상대적으로 낮으므로 우선 감량을 고려한다. MAO-B억제제 역시 저혈압을 유발할 수 있으므로 약물 조절 시 고려가 필요하며, 혈압 강하의 수준은 레보도파나 도파민작용제보다 작은 편이다[21]. 상기 조치에도 불구하고 저혈압이 반복되거나 실신 등이 동반되는 증상저혈압일 경우에는 승압 치료를 고려할 수 있으며, fludrocortisone, midodrine, domperidone, droxidopa, pyridostigmine, indomethacin 등 다양한 제제에 대한 근거들이 존재한다[55].
6. 파킨슨병에서 신경보호 치료
신경퇴행질환에서 신경보호(neuroprotection) 혹은 질병-조절 치료(disease-modifying treatment)란 신경의 퇴행을 늦추거나 처음 상태로 회복시키는 과정을 통하여 질환의 궁극적인 해결에 초점을 맞춘 치료를 일컫는다. 파킨슨병에서는 항산화 작용을 기반으로 하여 MAO-B억제제, 도파민작용제, 보조효소Q10, 요산, 비타민E 등이 시도되었고, 세포외독성(excitotoxicity) 억제 기전을 이용한 약제로는 크레아틴, riluzole, isradipine 등이 있었다. 기타 항염증 작용을 기반으로 하는 minocycline 등이 있었고, 세포 생존을 증진시키기 위한 교세포유래신경영양인자(glial cell derived neurotrophic factor)나 neurturin 등의 신경영양인자(neurotrophic factor)를 이용한 연구 등이 있었으나 아쉽게도 예비 연구나 무작위 연구 등에서 추가적인 의미 있는 결과를 보여주지 못하였다[57]. 위와 같이 많은 연구들이 예비 연구 수준에서는 희망적인 결과를 보였으나 이후 진행된 인체 연구에서는 효과를 입증하지 못 하였는데 이에 대해서는 다양한 요인들을 고려해볼 수 있겠다. 우선 파킨슨병의 병인에 대한 근본적인 이해가 부족할 수 있다. 파킨슨병은 다양한 유전, 환경 요인이 복합적으로 작용하는 것으로 알려져 있으며, 예컨대 조기 발현 파킨슨병의 경우 parkin돌연변이가 비교적 흔하며, LRRK2돌연변이는 전체 파킨슨병의 2%를 차지한다는 보고가 있을 정도로 드물지 않은 편이다. 즉, 모든 파킨슨병 환자가 단순하게 공통된 병인을 가지고 있다고 보기 어려운 것이다. 두 번째로 파킨슨 동물모델이 실제 인간 파킨슨병을 완전히 반영하지 못 하며, 세 번째로 임상 연구를 시도하는 약물의 유형과 용량, 용법 등이 신경보호 효과를 나타내기에 충분한지 불확실하다. 마지막으로 신경보호 효과 여부를 판단하기 위하여 평가하는 UPDRS나 다양한 생물표지자(therapeutic biomarkers)들이 과연 정확한 지표가 될 수 있는지에 대해서도 체계적으로 입증된 바는 없다. 추후 다양한 새로운 약물 시도와 함께 이러한 요인들의 개선이 이루어진다면 조금 더 희망적인 결과를 기대해볼 수 있을 것이다.
결 론
파킨슨병 치료에는 다양한 약물 이용이 가능하고 단독 치료나 추가 요법으로 그 효과들이 입증되었지만 아직까지는 레보도파가 가장 효과적인 치료제다. 치료 시작 전 환자의 연령과 증상 정도를 고려하여 약제를 선택해야 하며, 투약 치료를 시작한 후에는 각 약물들의 발생 가능한 다양한 부작용 및 도파민 장기 치료의 부작용을 미리 숙지하여 해당 이상이 발생하였을 경우 적절한 치료가 이루어지도록 해야 한다. 약물 치료로 충분한 조절에 제한이 있고 장기 부작용이 극심한 환자들의 경우에는 뇌심부자극술 등의 수술적 치료를 이용해볼 수 있으며 최근에는 집속 초음파를 이용한 수술(focused ultrasound surgery)이 새로운 치료 도구로 떠오르고 있다.
아직까지 파킨슨병의 경과를 변경할 수 있는 수준의 근본적인 치료는 정립되지 못하였다. 하지만 줄기세포, 유전자, 단클론항체 등 다양한 과학적 방법을 이용한 치료들이 지속적으로 시도되고 있으며, 병인에 대한 연구도 다변화되면서 새로운 목표 물질들에 대한 제시가 이어지고 있다. 임상의사와 기초 연구자들의 지속적인 도전은 추후 효과적이고 안전한 근본적인 치료에 대한 현실화를 가능하게 해줄 것으로 기대된다.