서 론
환경 오염은 현재 전 세계에서 각종 질병과 조기 사망(premature death)을 일으키는 가장 중요한 원인이다. 2015년 기준으로 환경 오염 관련 질환에 의한 조기 사망자 수는 900만 명으로 전 세계 사망의 16%를 차지하였다. 이는 AIDS, 결핵, 말라리아에 의한 사망을 합친 것보다 많은 숫자이다. 오염이 가장 심한 국가에서는 사망 원인의 1/4 이상이 환경 오염에 의한 것으로 추정된다[1]. 오염은 대기 오염, 토양 오염, 수질 오염 및 독성 화학물질(toxic chemical)오염으로 구분할 수 있는데 우리 건강에 가장 심각한 영향을 미치는 것은 대기 오염(ambient air pollution)이다. 대기 오염에 의한 조기 사망은 대부분 급성 허혈/색전성 심혈관질환(acute ischemic/thrombotic cardiovascular events)에 의한 것이다[2]. 공기역학(aerodynamic) 특성상 대기 오염 시 오염 물질이 한 장소에 정체되어 있지 않고 다른 지역 또는 다른 나라로 자유롭게 이동할 수 있다는 점이다. 미국, 중국, 영국 학자의 공동 연구에 의하면 미국 서부 지역 오염 발생 원인의 12-24%가 세계 최대 인위적(anthropogenic) 오염 물질 배출 국가인 중국의 대기 오염 때문인 것으로 밝혀졌다[3].
대기 오염은 모든 원인에 의한 사망(all-cause mortality)을 증가시키고 호흡기질환, 심혈관 대사(carddiometabolic) 이상, 인지장애 및 유아 발달(early childhood development)장애 같은 비전염성질환(non-communicable disease)과 연관성이 높다[4].
과학 기술의 발전으로 산업이 고도화되면서 삶이 양적으로 팽창하고 편리해졌으나 산업화에 동반된 환경 오염 때문에 인류는 재앙 수준의 건강 위험에 처하면서 역설적으로 삶의 질은 점차 악화되어가고 있다. 2018년 발표된 세계보건기구(World Health Organization, WHO) 자료에 의하면 2016년 기준으로 세계 인구 91% 이상이 WHO 공기질 권장 기준(WHO air quality guidelines level)에 미치지 못하는 지역에 살고 있으며 대기 오염에 의한 조기 사망이 연간 420만 명에 이른다[5].
본 론
1. 용어와 분류
1) 대기(atmosphere)
대기는 천체를 둘러싸고 있는 기체로 이루어진 겉층(envelope)을 말하며, 일반적으로 지구를 둘러싸고 있는 공기를 말한다. 지구의 대기는 중력으로 유지되며 상당 부분 지구와 같이 회전한다. 공기는 표준 상태(0℃, 760 mmHg)에서 질소 78.084%, 산소 20.946%, 이산화탄소 0.033%, 아르곤 0.934% 등의 기체로 이루어진 혼합가스이다. 생명 현상을 유지하는 데 필수적인 산소를 체내로 흡수하고 조직에서 발생한 노폐물인 이산화탄소를 배출하는 일은 호흡을 통하여 이루어진다. 휴식 상태에서 정상인은 분당 12-15번 호흡을 하고 한 번 호흡에 약 500 mL의 공기를 들이 마시며, 이는 분당 사용되는 공기 부피 6-8 L에 해당한다. 호흡을 통하여 정상 성인에서 분당 250 mL의 산소가 체내로 유입되고 200 mL의 이산화탄소가 배출된다[11]. 그런데 공기에는 산소 외에도 미세 먼지를 포함한 다양한 오염 물질이 포함되어 함께 유입되므로 건강에 부정적인 영향을 미친다.
2) 대기 오염 물질
대기 오염의 정의는 나라마다 조금씩 차이가 있지만, WHO는 ‘대기 중에 인위적으로 배출된 오염 물질이 한 가지 또는 그 이상이 존재하여 오염 물질의 양, 농도 및 지속 시간이 어떤 지역의 불특정 다수에게 불쾌감을 일으키거나 해당 지역의 공중 보건에 해를 끼치고, 인간이나 동‧식물의 활동에 해를 주어 생활과 재산을 향유할 정당한 권리를 방해받는 상태’로 정의하고 있다(국립환경과학원, 2018). 대기 오염을 유발하는 물질은 매연, 먼지, 가스 및 악취 등으로 사람의 건강 또는 재산에 해를 미치거나 동‧식물의 생육 환경 등 자연 환경에 악영향을 미치는 물질을 말하며, 이는 다시 가스 물질과 입자 물질로 크게 나눌 수 있다. 가스 물질은 연소, 합성, 분해 시 발생하거나 물리적 성질에 의하여 발생되는 기체 물질로 황산화물, 질소산화물, 오존 등을 말하며, 입자 물질은 물질의 파쇄, 선별 등 기계적 처리 또는 연소, 합성, 분해 시에 발생하는 고체 또는 액체의 미세한 물질을 말한다. 대기 오염 물질은 배출원에서 직접 배출되는 일차 오염 물질과 다른 전구 물질이 배출되어 대기 중에서 화학 반응을 통하여 만들어지는 이차 오염 물질로 구분되는데, 일차 오염 물질에 대해서는 대기 오염 배출량을 추정할 수 있으나 이차 오염 물질에 대해서는 직접 배출량을 산출하는 것은 불가능하다. 우리나라는 대기환경보전법 시행 규칙을 통하여 대기 오염 물질을 아황산가스(sulphur dioxide), 일산화탄소(carbon monoxide), 이산화질소(nitrogen dioxide, NO2) 등 가스 물질(악취 포함)과 먼지 같은 입자 물질을 포함한 총 64종으로 정하고 있으며, 이 중 카드뮴(cadmium) 등 35종을 특정대기유해물질로 정하여 관리하고 있다[12].
3) 미세 먼지
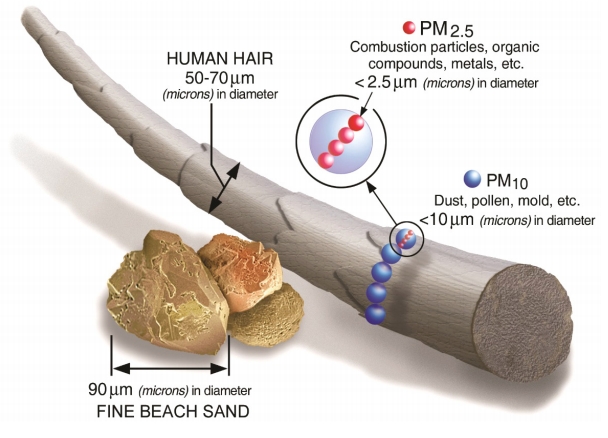
미세 먼지(particulate matter, PM)는 단일 물질이 아니라 대기 중에 떠 있는 유기질과 무기질 성분의 미세한 고체와 액체 입자로 이루어진 복합 혼합물(complex mixture)이다. 미세 먼지는 생성과정에 따라 일차 미세 먼지와 이차 미세 먼지로 구분할 수 있는데, 일차 미세 먼지는 산업 시설의 굴뚝, 자동차 배기구와 같이 화석 연료가 연소되어 발생하는 검댕, 자연에서 생기는 흙먼지(황사)와 꽃가루 등이 공기 중으로 직접 배출되는 것을 말하고, 이차 미세 먼지는 대기 중에 이미 배출되어 있는 오염 물질(예, 황산화물, 질산화물, 암모니아)이 화학 반응을 통하여 생성되는 것(예, 황산염, 질산염, 유기 성분을 포함하는 에어로졸)을 말한다. 생명체에 미치는 독성 영향과 직접 관련이 있을 것으로 추정되는 PM의 크기, 물리화학적 구성 성분, 생물학적 특성은 PM이 발생되는 시간과 공간(계절과 지역), 토질 및 기후 조건과 같은 요소에 크게 영향을 받는다. 환경부는 대기 중에 떠다니거나 흩날리면서 지표로 내려오는 입자 물질을 크기에 따라 총 먼지(total suspended particles [TSP], 입자의 크기가 50 μm 이하)와 미세 먼지(PM)로 구분하였는데, 입자의 크기가 작을수록 건강에 유해하다는 사실이 밝혀짐에 따라 미세 먼지를 PM10 (입자 지름이 10 μm보다 작은 경우)과 PM2.5 (입자 지름이 2.5 μm보다 작은 경우)로 세분화하여 미세 먼지와 초미세 먼지로 지칭하여 왔다(Fig. 1). 그러나 국제적으로는 TSP를 크기에 따라 ‘coarse, fine, ultrafine’으로 나누고 coarse particle (PM10), fine particle (PM2.5), ultrafine particle (smaller than 0.1 μm)로 명명하고 있어 초미세 먼지의 정의가 우리와 다르다. 이에 따라 정부는 국제 용례에 따라 2017년 3월부터 PM10은 '부유 먼지'로, PM2.5는 '미세 먼지'로, 이 둘을 합쳐서 '흡입성 먼지'라는 용어를 사용하기로 하였으나 현재까지도 용어가 통일되지 않고 미세 먼지 또는 초미세 먼지가 혼용되고 있다. 본 종설에서는 대기 오염 장·단기 노출에 의하여 건강 문제를 야기하는 핵심 요소인 미세 먼지를 중심으로 기술하고자 한다. 용어의 혼란을 없애기 위하여 미세 먼지 중 공기역학적 지름(aerodynamic diameter)이 2.5-10.0 μm인 것을 PM10, 2.5 μm 이하인 것을 PM2.5으로 표기한다.
2. 미세 먼지가 인체 건강에 미치는 영향(Table)
대기 오염을 유발하는 모든 성분이 건강을 위협하는 유해 물질이지만 PM의 독성이 가장 강력하다. PM의 생물학적 독성은 PM의 크기, 구조 및 구성 성분에 따라 달라진다. 예를 들면 산성이 강할수록 PM의 독성이 더 강해지는데 이는 PM의 표면에 달라붙어 있는 성분에 따라 인체 조직에 미치는 독성이 다르기 때문이다. PM 표면에 달라붙어 독성을 나타내는 물질(toxic hitch hiker)은 비소, 납, 카드뮴과 같은 중금속이나 연소 과정에서 생산된 황산 혹은 다환 방향족 탄화수소(sulfuric acid or polycyclic aromatic hydrocarbons) 같은 물질이 있다.
미세 먼지의 유해성은 입자의 공기역학지름에 반비례하여 나타난다. 즉, 미세 먼지의 농도와 성 분이 동일하다면 크기가 작을수록 건강에 더욱 해로운데, 같은 농도일 경우 PM2.5는 PM10보다 표면적이 넓어서 입자에 더 많은 유해 물질이 흡착되고 입자 크기가 작을수록 기관지에서 다른 인체 기관으로 이동이 수월하기 때문이다[13]. 미세 먼지의 농도와 모든 원인에 의한 상대적 사망 위험도(relative risk for all-cause mortality)를 보면 PM10이 20 μg/mm3 증가할 때마다 위험도는 0.4-1.5% 높아지고, PM2.5의 경우 10 μg/mm3 증가할 때마다 위험도는 0.6-1.2% 증가한다[14]. Schwartz 등[15]은 PM2.5 발생을 줄여 대기질을 개선하면 평균 수명이 0.9년 증가할 것으로 추정하였다. PM2.5에 대한 지속적인 연구를 통하여 인체 여러 장기에 발생하는 질환 가운데 심혈관질환과 폐질환의 발생에 PM2.5이 중요한 위험인자이며 특히, 심근경색[16-18], 고혈압[19,20], 울혈심부전[21], 부정맥[22] 및 심혈관 사망(cardiovascular mortality) [22,23]과 PM2.5의 직접적인 인과 관계가 확인되었다. 또한 역학 연구와 분자생물학적 근거에 기반하여 PM2.5이 만성 폐색성 호흡기질환(chronic obstructive pulmonary disease, COPD)과 폐암의 원인 물질이라는 것이 밝혀짐에 따라 2013년 10월 WHO 산하 국제암연구소(International Agency for Research on Cancer)는 미세 먼지를 발암 물질 1군으로 규정하였다[24].
3. 미세 먼지에 대한 선택적 취약성
PM에 대한 역학 연구와 통제된 인간 노출(controlled human exposure) 연구 결과 소아와 노인처럼 PM의 유해성에 특히 취약한 집단이 있음을 알게 되었다. 모든 질환은 환경 위험인자와 개체의 감수성 사이의 상호작용에 의하여 발생하는데 생애 단계(life stage)에 따라 발생률이 달라진다. 이는 일반 인구와 소아 및 노인 인구의 생리적 특성에 차이가 있기 때문이다[32,33].
4. 미세 먼지가 치매 발생에 영향을 미칠까?
노년기의 인지장애와 치매 증상 발현에는 알츠하이머병과 같은 퇴행성 병리기전과 혈관질환에 의한 혈관성 병리기전이 동반 상승효과를 나타낸다. 여기에 연령 증가(개체의 노화)에 따라 정상적인 회복 기능과 보상 기전(compensatory mechanism)이 불완전하여 퇴행성 질환, 특히 생활습관병이라 일컬어지는 연령 관련 질환의 임상증상 발현이 많아진다. 연구마다 차이가 있겠으나 일반적으로 65세 이상 인구의 약 10%가 치매 환자이며 그보다 3-4배 많은 30-40%가 경도 인지장애에 해당한다. 정상적인 사회 생활을 유지하던 사람이 독립적 일상생활을 유지할 수 없을 정도로 인지기능이 저하되었을 때 치매라고 진단한다. ‘나이듦’ 자체가 모든 질환 발생의 가장 강력한 위험인자이다. 장기간의 역학 조사와 관찰 연구에 의하면 대기 오염에 만성적으로 노출된 사람은 오염 물질이 소아기부터 퇴행성 뇌질환을 유발하는데 기여한다고 보고하였다[46]. 멕시코의 부검 연구에 의하면 대기 오염이 심한 지역에 거주하면 오염도가 낮은 지역에 거주하는 주민에 비하여 신경세포와 성상교 세포에 아밀로이드베타단백(amyloid beta protein, Aβ)이 더 많이 축적되었다[47]. 대기 오염에 장기간 노출되었을 때 집행 기능, 시각 삽화 기억, 의미 기억은 비교적 잘 유지되는 반면, 언어 학습(verbal learning)이 저하되는 경우가 많았다[48]. 후속 연구에서도 다른 인지기능에는 변화가 거의 없으나 공간 지각력(visuospatial ability) 장애가 심하였다[41]. 여성 노인을 대상으로 한 대규모 코호트 연구에서 전반적 인지기능, 언어 기억, 작업 기억 및 주의력을 추적 조사하였는데 장기간 PM에 노출된 군(4-7년)에서 단기간(1개월 이하) 노출된 군에 비하여 인지기능이 더 빠르게 감소하였다. PM 농도가 10 μg/m3 증가할 때마다 약 2년에 해당하는 인지 노화의 효과가 나타나는 것으로 추정하였다[49]. 타이완에서 65세 이상 노인을 대상으로 10년 동안 추적 조사한 대규모 코호트 연구에서는 오존 농도가 9.63 ppb 증가할 때마다 Alzheimer disease (AD)의 발병 위험은 211% 증가하였고 PM2.5 농도가 4.34 μg/m3 증가할 때마다 AD 발병 위험이 138%씩 높아지는 것으로 나타났다[50].
만성적으로 PM2.5에 노출되면 뇌의 부피가 작아진다는 연구가 관심을 모았다. Framingham Offspring Study에서 치매와 뇌졸중이 없는 60세 이상 노인을 대상으로 PM2.5 노출 정도와 전체 뇌부피, 해마 부피, 백질변성의 부피를 조사하였는데, PM2.5 농도가 2 μg/m3 증가할수록 부피는 0.32% 감소하였으며 무증상 뇌경색의 위험은 1.46배 증가하였다[51].
치매가 없는 여성 1,403명을 추적관찰한 Women’s Health Initiative Memory Study (WHIMS)에서 높은 농도의 PM2.5에 노출된 사람의 백질 부피가 6.23 cm3 작았고 총 뇌 부피는 4.47 cm3 작았으나 회백질(gray matter) 부피는 차이가 없었다[52]. 다른 WHIMS 연구에서는 71-89세 여성 1,365명의 magnetic resonance imaging 데이터를 분석하였는데 PM2.5에 장기간 노출된 군에서 피질 부피와 피질하백질 부피가 모두 작았다[53]. 이 연구의 공통된 결론은 대기 오염 노출이 노인의 뇌기능뿐 아니라 뇌의 구조에도 영향을 미친다는 것이다.
5. 발생기전(contributing factor and/or mechanism)
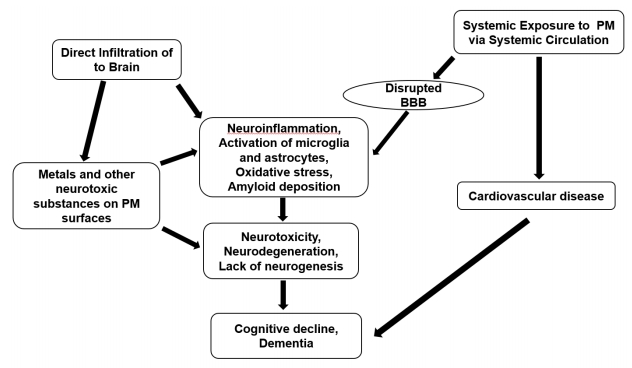
1) 미세 먼지가 뇌로 전달되는 경로(Fig. 2)
대기 오염이 뇌의 구조적·기능적 변화를 유도하여 인지기능 장애를 유발할 수 있다. 호흡을 통하여 흡입된 PM이 뇌조직에 도달할 수 있는 방법이 동물 실험을 통하여 제시되었는데, 체순환을 통하거나 혈뇌장벽(blood brain barrier, BBB)을 우회 또는 후각망울(olfactory bulb) 통하여 직접 전달되는 경로가 있다. PM은 후각망울을 통하여 직접 뇌조직으로 이동한 후 노인반에 침착되어 염증 반응을 악화시키거나 교세포를 자극하여 아밀로이드 생성을 촉진시킨다[54]. 다른 경로는 PM이 비강에서 비강상피세포(nasal epithelium)를 침범하여 염증을 유발한 후 뇌조직을 손상시킨다. 또 다른 경로는 흡입된 PM 중 점액세포청소(mucocilliary clearance)에 의하여 제거되지 않고 폐포까지 도달한 오염 물질이 염증을 일으키고 염증 촉진 사이토카인(proinflammatory cytokine)을 생산한다. 이 염증 촉진 사이토카인이 전신 순환을 통하여 뇌조직으로 전달되어 신경 염증을 확산시킨다[55]. PM 중 입자 크기가 작은 나노 입자(nanoparticle)는 망상내피세포계(reticuloendotheial system)의 식균세포를 벗어나 직접 BBB를 자극하여 기능을 약화시킨다. BBB 기능이 불완전해지면 투과성이 증가하여 여러 가지 병원균이나 독성 물질이 자유롭게 뇌조직으로 유입될 수 있다[56].
2) 염증 반응
심한 대기 오염에 노출된 어린이의 뇌에도 신경 염증이 증가되었는데, 신경 염증 반응이 뇌 발달에 해로운 영향을 주어 구조기능 이상이 발생하였으며, 그 결과 인지기능도 저하되었다[57]. 멕시코의 부검 연구에 의하면 대기 오염이 심한 지역에 거주하는 사람의 후각망울(olfactory bulb), 전두엽, 흑질, 미주신경에서 cyclooxygenase-2, IL-1beta, CD14의 농도가 증가되었고 BBB 파괴, 산화 스트레스, 염증세포의 이동을 확인하였다[47]. 이는 대기 오염이 신경 염증을 일으켜 뇌의 내인성 염증 반응을 초래하고 청소년기부터 Aβ42 α-synuclein이 축적될 수 있음을 시사한다.
3) 산화 스트레스
대기 오염 물질, 특히 PM2.5는 지질과 단백질에 직접 산화촉진제(prooxidant)로 작용하는데 항산화 효소의 활성이 부족한 경우 산화 스트레스를 촉진하여 자유기(free radical) 생산자 역할도 한다[58]. 도시에서 PM에 노출된 사람을 대상으로 한 부검 연구에서 전두엽이 대조군에 비하여 산화 스트레스나 염증 반응에 관련된 유전자 발현은 2배 높았고 신경세포 보호 기능을 하는 유전자 발현은 15배 적게 발현되었다. 대기 오염이 중추신경계를 손상시키는 기전에 산화성 손상과 신경 염증이 중요인자임을 시사하는 결과이다[59].
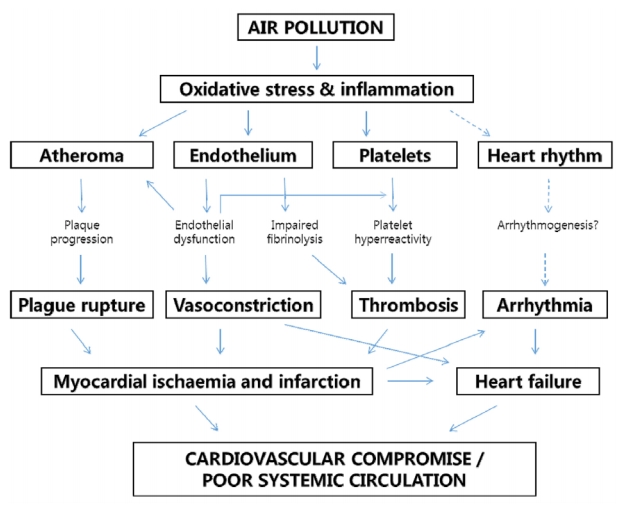
4) 뇌혈관 변화(Fig. 3)
PM은 심혈관에도 산화 스트레스와 염증 반응을 일으켜 죽상경화증을 촉진하고, 혈관내피세포 기능을 저하시켜 혈류의 원활한 흐름을 방해한다. 또한 PM은 부정맥을 유발하고 혈소판 기능에도 영향을 미쳐 혈전이 생기기 쉬운 상태를 만든다. 혈관 또는 혈류의 변화가 생기면 적절한 뇌혈류 유지가 어려워지므로 인지기능에 영향을 미칠 수 있다.
6. 대책
1) 오염 발생원의 대책
PM으로 인한 건강 위협에 대한 근본 대책은 오염 발생원을 줄이는 일이다. 그러나 화산 폭발, 산불, 꽃가루, 소금 분진, 황사, 각종 유기물의 분해 과정으로부터 발생되는 ‘자연 배출’을 통제하기는 어렵다. 그러나 화석 연료 연소 즉, 인간의 활동에 의하여 발생되는 ‘인위 배출’은 노력에 따라 어느 정도 통제가 가능하다. 지구 전체로 보면 인위 배출량보다는 자연 배출량이 월등하게 많다. 그러나 인위적 배출원은 인구가 밀집된 생활 환경에 인접해 있기 때문에, 상대적인 배출량에 비하여 건강에 미치는 영향은 매우 크다. 우리나라의 대기 중 미세 먼지 농도는 꾸준히 개선되어 왔으나 최근 국외에서 유입되는 대기 오염은 날로 심해져서 우리나라만의 노력으로 미세 먼지를 획기적으로 감소시키기는 쉽지 않으므로 정부 차원의 국제 공조가 필요하다. 미세 먼지 노출에 의한 건강 유해성을 줄이기 위한 개인적인 노력은 그 효과가 제한적이지만 정부와 사회는 미세 먼지를 근본적으로 감소시키기 위한 정책적 노력을 계속하여야 할 것이다.
2) 개인적인 대책
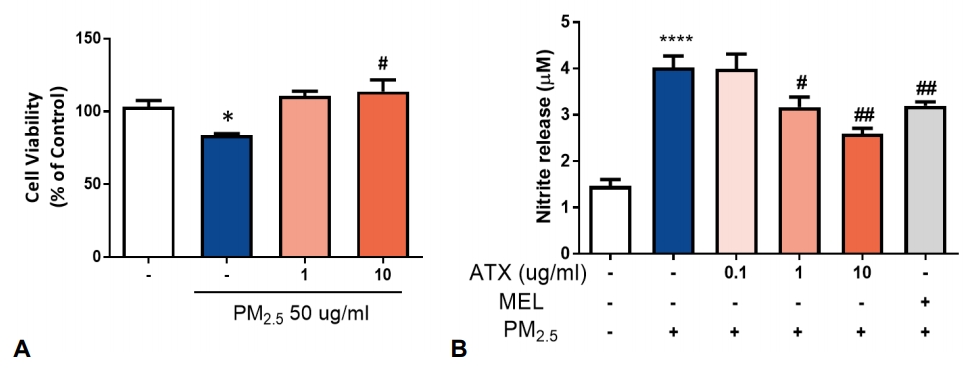
개인적으로 일상생활에서 PM에 노출되는 시간을 최소화 해야한다. 대기 중 PM 농도가 높을 때에는 실내에 공기청정기 가동, 외출할 때는 PM용 마스크 착용을 생활화 해야 한다. 체내에 흡수된 미세 먼지는 면역 시스템을 통하여 배출되지만 일부 크기가 작은 입자는 여러 경로를 통하여 중추신경계로 유입되어 영향을 미친다. 특히 PM2.5는 신경 염증과 산화 스트레스를 유발하는 강력한 환경 위험인자로 알려져 있으며 만성적으로 노출될 경우 심각한 건강 문제를 초래할 수 있다. 따라서 항산화 물질이나 항염증 작용이 있는 영양소를 충분히 섭취함으로써 PM에 의한 독성 위험을 경감시킬 수 있을 것이다. 현재 치매 진행을 억제하거나 질병 경과를 변화시킬 수 있는 약물은 없다. 따라서 효과가 입증된 치료제가 개발되기 전까지는 건강한 생활 습관과 같은 ‘예방 전략(preventive strategies)’이 중요하다. 최근 Péter 등[60]은 대기 오염에 의한 건강 위협을 약화시키기 위하여 영양학적 해법을 제시하였다. 연구진은 B vitamins, vitamin C, vitamin E, vitamin D 및 omega-3 polyunsaturated fatty acid 등의 micronutrinet가 PM의 독성을 완화시킬 수 있다고 주장한다[60]. 강력한 항산화 및 항염증 효과를 가진 astaxanthin (AXT)은 미세 조류인 Haematococcus pluvialis에 의하여 합성되는 phytonutrient로 짙은 붉은 색을 띠고 있다. 이것을 주로 먹는 크릴새우나 연어가 붉은 색을 띠는 것도 AXT 성분 때문이다. 최근 AX의 신경세포 보호 효과가 알려지면서 퇴행성 신경질환 치료제로서 가능성에 대한 연구가 활발히 진행되고 있다[61,62]. 저자의 실험실에서도 PM2.5으로 유도된 신경 독성이 AXT의 항산화, 항염증 작용에 의하여 완화될 수 있음을 확인하였다(Fig. 4) [63].
결 론
전 세계적으로 대기 오염은 호흡기질환과 심혈관질환에 의한 조기 사망을 유발하는 매우 심각한 환경 위험인자이다. 대기 오염 발생을 줄이기 위한 끊임없는 노력에도 불구하고 가까운 시일 내에 이 문제가 완전히 해결될 가능성은 그리 높지 않다. 우리나라의 경우 급속한 고령화와 함께 대기 질도 악화되고 있어 PM2.5와 같은 환경 독성 물질에 취약한 사람이 증가하고 있으며 이에 따라 퇴행성 뇌질환 발생도 증가할 것이다.
일차적으로 국가와 지역 자치단체가 대기 오염 발생을 근원적으로 줄이는 로드맵을 제시해야 하며, 개인과 가정에서도 PM2.5를 비롯한 대기 오염 발생을 줄이고 이에 노출되는 위험도 줄여야 한다. 평소 항산화, 항염증 성분이 든 영양소를 충분히 섭취하여 우리 몸의 감시 체계를 피하여 침투한 PM2.5의 유해 작용을 억제시킬 수 있어야 한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




