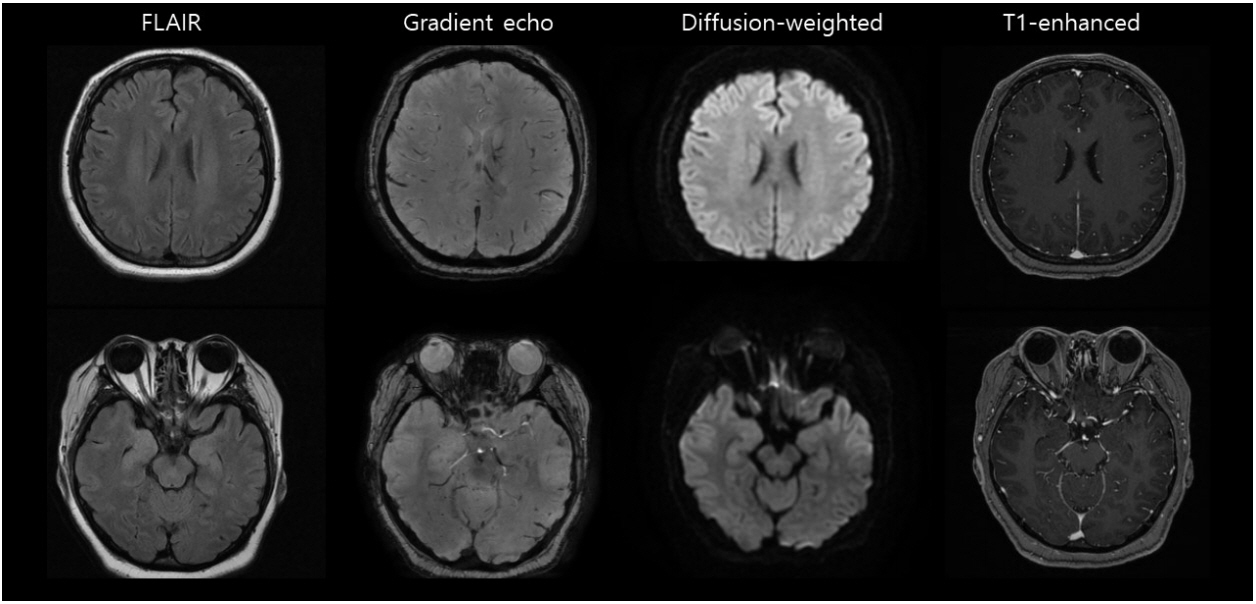
26세 여자가 이상행동과 의식저하로 응급실에 왔다. 환자는 2주 전 감기몸살 기운이 하루 이틀 있었다(발열 37.8도). 그즈음 남자친구와 싸우고 헤어졌으며 그날부터 우울해하고 밤에 잠을 못 자면서 두통을 호소하였다. 7일 전부터 5일 전까지는 허공을 보며 대화를 하거나, 식사 중에 부모에게 이유 없이 화를 내고 방으로 뛰어 들어가거나, 새벽에 직장 동료들이 찾아왔다며 밖으로 나가려고 하였다. 이후로 심한 단기 기억저하가 생겼다. 이에 5일 전 집 근처 정신과에 방문하여 항정신병약(aripiprazole)을 복용하기 시작하였다. 내원 2일 전 의식소실을 동반한 경련발작을 수 분 동안 하였으며, 인근 병원 응급실을 방문하여 levetiracetam을 1,000 mg 하루 두 번씩 정맥주사하기 시작하였고, 이후 경련은 없으나 다음날까지 의식회복 없이 전신과 입 주변에 씰룩거리는 이상운동이 발생하였다. 이에 acyclovir를 10 mg/kg q8hr 용량으로 시작하면서 본 병원의 응급실로 이송되었다. 과거에 건강하고 질병이 없었으며, 발병 이전에 먹는 약물은 없었다. 회계 담당 회사원이며, 2개월 뒤 결혼 예정이었다. 신체 진찰에서 생체징후는 정상이고 의식은 혼미(stupor)상태로 의사소통이 되지 않았다. 뇌신경계 진찰에서 전정안반사(vestibular ocular reflex)가 감소되어 있었고 스스로 삼키지 못하여 코위관을 갖고 있었다. 사지의 근력은 정상이지만 입과 팔에 반복적인 이상운동과 양팔에 긴장증(catatonia)이 있었다. 심부건반사의 항진은 없고, 경부강직(neck stiffness)도 없었다. 일반혈구검사, 일반화학검사, 전해질, 혈중 크레아틴키나아제(creatine kinase) 수치도 모두 정상이고, 임신 호르몬 반응은 음성이었다. 이전 병원에서 최초 경련 직후 촬영한 뇌 magnetic resonance imaging (MRI)는 T2영상에서 양측 내측 측두엽에 T2고신호가 있었고, 확산강조영상, 조영증강 T1영상, 기울기에코영상(gradient echo image)은 정상이었다(
Fig. 1). 뇌척수액검사에서 압력은 18 cmH
2O, 혈구 수치는 0, 단백질 52 mg/dL, 포도당 68 mg/dL (혈중 포도당 102 mg/dL)였다. 뇌파는 전반적인 서파(diffuse slowing)가 나오고 있었다. 응급실에서 검사하던 도중 환자의 자발 호흡이 약해져서 기도삽관 후 기계환기를 시작하였다.
질문 1. 이 환자의 감별진단은?
신경학적 감별진단은 국소화(localization), 증후군 진단(syndrome diagnosis), 원인(etiologic diagnosis)으로 생각해 나가는 것이 원칙이다. 환자는 2주 사이 아급성으로 진행하는 이상행동, 경련발작, 기억력저하, 의식저하, 이상운동을 보였다. 이상행동, 경련발작, 기억력저하는 변연계(limbic) 증상으로 정리되고, 의식저하는 뇌 전반적인 문제로, 전정안반사저하, 호흡저하는 뇌줄기 증상으로 추정된다. 증후군으로서는 흔히 외우기 쉽게 VITAMIN-CD의 약자대로 혈관성(vascular), 감염성(infectious), 외상(traumatic), 자가면역(autoimmune), 대사성(metabolic), 의인성(iatrogenic), 종양성(neoplastic), 선천성(congenital), 퇴행성(degenerative)으로 분류하여 생각해 볼 수 있다. 그러나 뇌염 의심환자는 구체적인 신경해부학적 국소화보다는 대략 4가지의 핵심 병변 그룹으로 분류하는 것이 복잡한 환자의 임상양상을 정리하는데 도움이 된다. 바로 변연뇌염(limbic encephalitis), 뇌줄기뇌염(brainstem encephalitis), 소뇌염(cerebellitis)과 이들이 복합된 뇌척수염(encephalomyelitis)으로의 분류이다[
1]. 변연뇌염은 기억 감소, 경련발작, 정신 이상증상이, 뇌줄기뇌염은 뇌줄기 기능장애(안구 운동이상, 파킨슨증 등)와 호흡저하가 있을 수 있다. 이 환자는 변연뇌염으로 시작하여 뇌줄기뇌염으로 확장된 것으로 생각된다.
뇌염 의심환자에서 감별해야 할 원인질환은
Table 1과 같이 매우 광범위하다. 이 환자는 그중 핵심 원인들에 대하여 아래와 같이 고찰할 수 있다.
1) 바이러스뇌염: 바이러스 감염은 수일 이상의 장기간 발열이 지속되는 경우가 흔하고[
2], 자가면역질환은 면역감작 시기에 하루 이틀 발열이 있을 수 있다[
1]. 바이러스에 의한 변연계 뇌염은 MRI에서 증상의 정도와 비례하는 T2 신호변화를 동반하는 경우가 대부분이다[
2]. 그러나 이 환자의 MRI는 비록 내측두엽에 T2 변화가 있지만 환자의 심각한 증상을 설명하기에 부족하다. 이런 증상-MRI 부조화(mismatch)는 오히려 항체매개의 자가면역질환을 시사한다. 그럼에도 불구하고 바이러스 감염은 주요 배제질환이므로 확인검사가 필요하다. 특히 헤르페스뇌염 환자의 27%에서 자가면역뇌염이 뒤따라 오는 것으로 알려져 있고[
3], 바이러스 감염이 자가면역뇌염의 선행인자가 될 수도 있으므로, 자가면역뇌염이 확진된 환자에서도 바이러스 감염 여부를 확인해 볼 필요가 있다.
2) 스트레스: 이 환자가 남자친구와 싸워서 스트레스로 병이 발병하였기보다는 이미 환자가 망상이나 병적 정신증상이 있으면서 다툼의 원인이 되었을 수 있다.
3) 세균: 뇌척수액 백혈구 증가가 없으므로 일반적인 세균성 수막염은 배제할 수 있다. 다만 리스테리아(
Listeria)는 면역저하 환자(암 환자, 면역억제제 사용 환자)에서 특히 중요한 세균성 뇌염의 원인인데, 기저핵과 중뇌를 침범하는 마름뇌염(rhombencephalitis)으로 잘 발현하고 초기에는 뇌척수액검사에서 백혈구 증가가 뚜렷하지 않고, 림프구성으로도 발현할 수 있다[
4].
4) 기타 감염: JC바이러스는 두정엽이나 소뇌각(cerebellar peduncle)을 침범하는 경우가 많고, 드물게 수막염을 일으킬 수도 있으나[
2], 이 환자에서는 맞지 않는다. 크로이츠펠트-야콥병(Creutzfeldt-Jakob disease)도 빠르게 진행하는 인지기능 장애가 가능하고, 변형 크로이츠펠트-야콥병의 경우 초기에 정신이상 증상이 나오지만, 진행한 상태에서는 특징적인 MRI를 보이는 경우가 대부분이므로[
2], 혼수상태로 진행한 현재 이러한 의심 소견이 없어서 배제가 가능하다.
5) 자가면역: 환자는 심한 정신이상 증상과 이상운동, 호흡저하가 있는데 항NMDA수용체 뇌염(anti-N-methyl-D-aspartate receptor encephalitis)의 특징적인 증상이다. 각 자가면역 뇌염별로 특징적인 임상양상이 있기 때문에 증상만으로도 원인 항체를 추정할 수 있는 경우들이 있다. 전신 자가면역질환의 중추신경계 침범 증상에 대한 배제도 필요하다. 특히 자가면역질환은 여러 개를 복합적으로 갖고 있는 경우가 있으므로, 자가면역뇌염이 확진되었더라도 전신 자가면역질환의 동반 여부를 확인하는 것이 좋다.
6) 대사성 질환: 대사성 질환은 치료 가능한 원인이라는 점에서 놓쳐서는 안되기 때문에 뇌염 환자에서 항상 배제가 필요하다.
7) 종양: 내측두엽에 발생하는 교종(glioma)은 변연뇌염(limbic encephalitis)으로 오인되는 경우가 있고, 반대로 변연뇌염을 교종으로 오인하여 수술하는 경우도 있다. 종양은 MRI에서 보이는 병변 모두가 신경 손상을 주는 것은 아니기 때문에 MRI에 비하여 증상이 경미한 경우가 많고, 1-2개월 간격으로 MRI를 다시 촬영할 경우 병변이 소실되지 않고 위축(atrophy)도 발생하지 않으며 오히려 부피가 커지는 소견이 염증성 병변과 감별된다.
8) 혈관성: 뇌정맥동 혈전증(cerebral venous sinus thrombosis)도 경련이나 MRI 소견이 뇌염과 유사하여 감별이 필요하다. 다만 내측 측두엽으로 발생하는 경우는 드물다.
9) 유전성/발달성: 미토콘드리아 질환도 경련과 피질 증상이 생기므로, 뇌염의 감별에 들어간다. 필요한 검사로 배제하면 된다. 피질이형성증(cortical dysplasia)이 있어서 반복 경련하는 환자를 뇌염으로 혼동하여서도 안 된다. 무병변성 뇌전증(non-lesional epilepsy)중 일부는 자가면역뇌염일 수는 있지만, 그렇지 않은 뇌전증 환자인 경우들이 많으므로 합리적인 검사와 판단이 항상 필수적이다.
10) 퇴행성: 알츠하이머병 환자들 중 일부는 경련발작이나 비발작성 뇌전증지속상태(non-convulsive status epilepticus)를 보이는 경우가 있다. 고령 환자는 MRI에서 기저에 알츠하이머병 소견이 있는지 고려할 필요가 있다.
질문 2. 이 환자의 진단을 위하여 해야 할 검사는?
뇌염 의심환자의 원인 진단(etiologic diagnosis)을 위해서는
Table 1의 질환들을 감별하는 적절한 검사를 시행해야 한다. 환자의 상태에 따라 검사의 종류를 제한하여 집중할 수 있으므로, 임상적 판단이 제일 중요하다.
1) 자가면역뇌염 진단검사: 자가면역뇌염에 대해서는 혈액과 뇌척수액에서 자가면역뇌염 원인 항체검사를 하고 전신 자가면역질환을 동반하고 있는지에 대하여 혈액에서 다양한 항체검사를 한다. 항체가 없는 자가면역뇌염도 있으므로, 임상적으로 의심되면 항체 진단 없이도 진단하는 것이 적절하다.
2) 바이러스뇌염검사: 뇌척수액에서 바이러스 polymerase chain reaction (PCR)으로 배제하고, 흔한 뇌염 원인 바이러스인 엔테로바이러스 71 (enterovirus 71)의 경우 항체로 진단할 수 있다. 바이러스 PCR은 바이러스 자체의 존재 유무에 대해서는 매우 특이적인 검사이지만, 뇌척수액에서 바이러스가 존재한다고 해서 반드시 뇌염의 원인으로 단정할 수 없다는 점에 유의해야 한다. 예를 들어 엡스타인바바이러스(Epstein-Barr virus)의 경우 혈액 속에 존재하기 때문에 뇌척수액으로 들어간 백혈구에 의하여 PCR 양성으로 검출될 수 있다. 따라서 뇌척수액에서 PCR이 양성이라도 각 바이러스의 임상 양상과 맞지 않으면 원인인지 의심해야 한다.
3) 종양 확인을 위한 computed tomography (CT): 자가면역뇌염에 동반된 종양 확인을 위해서는 흉부 저선량 CT(비조영증강)와 복부 골반 CT(조영증강), 유방 촬영(40세 이전이거나 일어설 수 없는 환자는 유방 초음파), 산부인과 암 검진(Pap 도말검사 등, 남성의 경우 고환 초음파), 종양 마커(human chorionic gonadotropin, alpha-fetoprotein, CA125)검사가 필요하다. 항NMDA수용체 뇌염의 경우 골반 MRI(비조영증강)가 필요한데, 지방을 시사하는 T1 고신호병변이 있는 경우 난소 기형종을 의심할 수 있고, CT에서 보이지 않아도 MRI에서 확인되는 경우가 있으므로 가능하면 골반 MRI까지 촬영해야 한다. 전신 18-fluoro-deoxyglucose positron emission tomography (FDG-PET)는 림프종이 의심되거나 뇌 내 병변이 염증인지 불명확할 때 뇌를 포함하여 전신 FDG-PET을 촬영할 경우 감별에 도움이 되지만, 일반 종양의 초기 진단을 위해서는 CT가 더 우수하다.
입원 경과
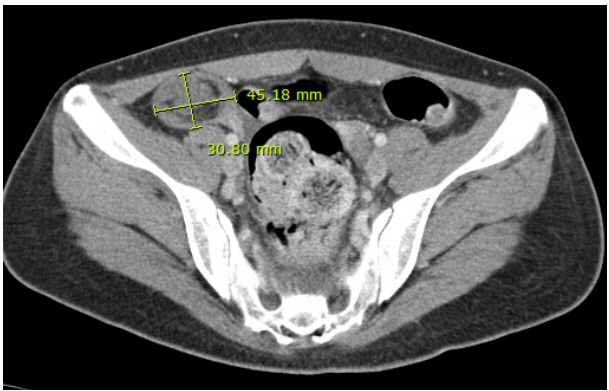
환자의 뇌척수액 바이러스PCR (HSV1, HSV2, VZV, EBV, CMV, enterovirus)은 음성이고, 뇌척수액과 혈청에서 자가항체검사 결과는 아직 보고되지 않았다. 다른 배제 진단을 위한 검사에서도 특이 소견이 없었다. 환자의 복부 CT에서 우측 난소에 기형종이 의심되는 소견이 있었다(
Fig. 2).
질문 3. 이 환자의 진단과 치료는?
이 환자는 기억 감소, 경련발작, 정신이상 증상이 아급성으로 진행하는 변연계 뇌염으로 판단된다. 자가면역뇌염 외의 다른 감별진단들은 적절히 배제된 상태로, MRI에서 뇌염을 시사하는 이상 소견, 국소신경학적 증상, 설명되지 않는 경련발작을 종합할 때, 자가면역 변연계 뇌염 가능성이 높다(
Table 2). 특히 지속적인 얼굴과 팔의 이상운동이 동반되어 있고, 난소의 기형종 의심 소견으로 볼 때는 항NMDA수용체 뇌염으로 보고 치료할 수 있는 상황이다. 치료의 첫 단계는 원인 종양을 제거하는 것이다. 종양 제거가 늦어지면 투병 기간이 길어진다. 그 다음으로는 질병 조절을 위하여 면역조절제를 사용하는데, 환자의 상태와 증후군에 따른 맞춤 치료가 필요하다. 일차치료 약제로 면역글로불린정맥주사(immunoglobulin) (0.4 g/kd/day, 5일간 투여)나 고용량 스테로이드(methylprednisolone 1,000 mg/day, 5일간 투여)를 사용한다.
일차치료제에 1-2주 이내에 반응이 없으면 이차치료 약제를 고려한다. 이차치료 약제는 rituximab (375 mg/m
2, 주 1회 4주간 투여), cyclophosphamide (750 mg/m
2, 월 1회 최대 6회 투여)를 포함하며, tocilizumab (4 mg/kg, 매월 투여)도 표준치료로 고려되고 있다[
5-
7]. Rituximab은 4주간 사용한 뒤에 매월 유지 용량을 고려할 수도 있다. Cyclophosphamide는 불임과 이차적인 암 발생 가능성이 있어서 젊거나 가임기 여성 환자에게는 우선 사용하기 어렵고, 난치성인 경우 난소보호제(GnRH 호용제)와 함께 사용을 고려할 수 있다. Tocilizumab은 인터루킨-6 수용체 억제제로서, rituximab에 불응하는 환자에서도 효과가 있다.
다른 자가면역질환에서는 면역글로불린 대신 혈장분리교환술(plasmapheresis)을 선택하는 경우가 있는데, 자가면역뇌염에서는 좋은 선택은 아니다. 혈장교환술은 항체약물도 제거하기 때문에 rituximab이나 tocilizumab과 같이 사용할 수 없는데 반하여, 자가면역뇌염은 다른 신경계 면역질환과 달리 장기간 반복적이고 다약제의 면역억제 치료가 필요할 가능성이 높기 때문이다. 그럼에도 혈장교환술은 면역글로불린과 효과는 동등하다고 판단된다. LGI1 뇌염(leucine-rich, glioma inactivated 1 encephalitis)이나 신생물딸림증후군같이 같이 T세포 침윤이 유발되는 기전이 있으면 스테로이드를 유지하면서 mycophenolate mofetil, azathioprine, tacrolimus를 추가하여 감량한다.
항NMDA수용체 뇌염 환자가 사망하는 원인은 호흡저하로 인한 저산소성 손상, 횡문근융해증, 자율신경계 불안정성에 의한 저혈압, 폐렴과 같은 이차적 감염이다. 항정신병약은 항NMDA수용체 뇌염 환자의 정신이상 증상에 효과적이지 않고, 도파민차단제는 근긴장증을 악화시킬 수 있어서 사용에 주의해야 한다. 심한 이상운동 및 근긴장증은 diazepam을 고용량(하루 10-180 mg)으로 사용하여 조절해 볼 수 있다[
8]. 과도한 침분비로 인하여 폐흡인되는 것을 예방해야 하며, 항콜린계 약물은 침분비를 부분적으로 줄일 수 있으나, 이상운동과 혈압 불안정성을 악화시킬 수 있다. 침샘에 대한 보툴리눔 독소 주사가 침분비를 낮춘다[
9]. 예후는 장기적으로는 우수한 편이나, 급성기에는 중환자 치료가 필요하고 사망할 수도 있다. 2년 결과로 평가할 때, 다양한 면역치료제를 통하여 약 50% 환자는 무증상으로 호전되며, 30%는 일부 증상(언어 유창성 저하, 초조)이 남으나 일상생활이 가능하고, 10%는 독립적인 일상생활 수행이 되지 않는 장애를 갖게 되며, 10%는 사망한다. 최근에는 대부분 rituximab을 사용하는데 rituximab은 재발률을 낮춘다[
5].
입원경과
환자는 난소 종괴를 복강경으로 제거하였고, 기형종으로 확인되었다. 이에 항NMDA수용체 뇌염으로 의심하고 면역글로불린과 고용량 스테로이드 정맥주사를 사용하였다. 수 일 뒤 뇌척수액 및 혈청에서 항NMDA수용체 자가항체가 양성으로 보고되었다. 환자는 아직 뚜렷한 임상적 호전이 없어서 rituximab, tocilizumab을 순차적으로 사용하였고, 이후 6개월에 걸쳐 차츰 호전되어 완전한 일상생활이 가능하게 되었다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



