사람면역결핍바이러스감염증 치료 중 발생한 중대뇌동맥협착의 악화 및 재발성 뇌경색
Recurrent Ischemic Strokes with Progression of Middle Cerebral Artery Stenosis during HIV Treatment
Article information
Trans Abstract
Human immunodeficiency virus (HIV) infection can result in ischemic stroke via several mechanisms, including opportunistic infection, vasculopathy, cardioembolism, and coagulopathy. HIV-vasculopathy is related to endothelial dysfunction, stenosis and aneurysm formation, infectious vasculitis, dissection and accelerated atherosclerosis during highly active antiretroviral therapy (HAART). We represent a case of HIV infection manifested as an acute ischemic stroke attack. After 4 months during HAART, our patient experienced a recurrent ischemic stroke with progression of middle cerebral artery stenosis.
국내 사람면역결핍바이러스(human immunodeficiency virus, HIV) 감염자는 1985년 첫 번째 증례가 보고된 이후 누적 수가 2015년 1만 명이 넘게 되었고, 매년 1,000명 이상씩 증가하고 있다[1]. HIV 감염자는 체내에 HIV를 가지고 있는 사람을 총칭하는 말이며 후천면역결핍증후군(acquired immune deficiency syndrome)은 HIV에 감염된 후 면역결핍으로 인한 기회감염 또는 종양 등 합병증이 발생한 경우로 모두 강력하고 지속적으로 바이러스를 억제하고 면역기능을 회복시키기 위한 항레트로바이러스 치료가 중요하다.
HIV 감염과 연관된 뇌졸중은 기회감염, 심장성색전증, 응고장애, 혈관염 등의 다양한 원인에 의하여 발생한다[2]. 또한 HIV 관련 혈관병증은 직간접적으로 대뇌혈관내 내피 기능 이상을 유발하여 협착이나 동맥류를 형성하거나 동맥경화증을 악화시킬 수 있다. HIV 감염의 장기적인 억제를 유도하는 초강력항레트로바이러스제병용요법(highly active antiretroviral therapy, HAART)은 이상지질혈증 및 인슐린저항성과 체지방분포이상과 같은 대사이상증후군을 초래하여 허혈뇌졸중의 발생과 연관이 있을 수 있다고 알려져 있다[3].
저자들은 뇌경색으로 입원한 젊은 환자에서 HIV 감염을 확진 후 항레트로바이러스 치료를 하던 중 중대뇌동맥협착 악화로 인한 뇌경색이 재발한 환자를 경험하여 보고하고자 한다.
증 례
31세 여자가 갑작스럽게 발생한 우측 편마비로 본원 응급실을 방문하였다. 이전에는 건강하였다고 하며, 조짐편두통, 두부외상, 임신, 반복적인 정맥혈전증 등의 과거병력은 없었다. 신장은 170 cm, 체중은 63 kg으로, 계산한 체질량지수(body mass index)는 21.8 kg/m2로 정상 체중이었다. 3년 이상 주 5회 소주 1-2병의 음주력과 10갑년(pack year) 흡연력이 있었고, 6개월 전 경구피임제 2달 복용 이외 최근 복용 중인 약물은 없었다. 내원 당시 신경계진찰에서 의식은 명료하였고, 구음장애와 우측 안면마비가 관찰되었다. 운동기능검사에서 우측 상하지 위약은 Medical Research Council (MRC) 등급으로 3/3이었으며 NIH 뇌졸중척도(National Institute of Health Stroke Scale, NIHSS)는 6점이었다. 발열, 피로, 체중감소와 같은 전신 증상이나 두통, 흉통, 피부 병변 등은 없었으며, 활력징후는 혈압 130/80 mmHg, 맥박수 92회/분, 호흡수 20회/분, 체온 36.6도였다. 급성 뇌졸중을 의심하여 시행한 뇌 computed tomography상 출혈 소견은 보이지 않아 증상 발생 후 3시간 30분경 정맥내 재조합조직플라스미노젠활성제(intravenous recombinant tissue plasminogen activator) 투여를 시작하였다. 증상 발생 후 4시간 30분 만에 촬영한 뇌 자기공명영상확산강조영상에서 좌측 기저핵(basal ganglia)에 고신호강도로 초기 뇌허혈 변화가 확인되었고, 뇌 자기공명혈관조영술에서는 뚜렷한 두개내 혈관의 협착 소견은 발견되지 않았다(Fig. 1).

Brain magnetic resonance imaging and magnetic resonance angiography (MRA) images at first admission. (A) Diffusion-weighted image shows early ischemic changes on the left basal ganglia and internal capsule (white arrows). (B) No definite steno-occlusive lesions are found in time-of-flight-MRA.
당화혈색소 5.2%, 총 콜레스테롤은 150 mg/dL (정상 130-240), 중성지방 103 mg/dL (정상 28-150), 저밀도콜레스테롤은 90 mg/dL (정상 <120)로 일반생화학검사, 일반혈액검사, 호모시스테인, 갑상선호르몬, 프로트롬빈시간, 활성부분트롬보플라스틴시간은 모두 정상이었다. 입원 후 시행한 항핵항체, 항중성구세포질항체(anti-neutrophil cytoplasmic antibody)와 항카디오리핀항체를 포함한 자가면역항체는 모두 음성이었으며, 혈액응고인자분석에서 C단백질활성도, S단백질활성도, 항트롬빈 III, 피브리노겐, D-이량체 역시 모두 정상범위로 젊은 환자의 뇌졸중 발생에 기여하는 인자도 없었다. 열공뇌경색을 고려하여 아스피린과 아트로바스타틴(atorvastatin) 40 mg을 투약하였고, 증상 발생 4일 후에 우측 위약감은 MRC 4/4까지 회복되었다. 이후 혈청 항HIV검사와 웨스턴블럿(western blot)검사에서 모두 양성이 확인되었다. 다른 성병검사 및 뇌척수액검사는 정상이었으나 혈중 CD4+ T림프구의 절대수치가 13/μL (정상 500-1,200/μL)로 매우 감소되었고, CD4/CD8 ratio=0.03 (정상 2.0)으로 낮아져 있었으며, HIV RNA정량검사는 4.5×104 copies/mL로 확인되었다. HIV 감염증으로 진단하고 감염내과 상의하여 dolutegravir (integrase strand transfer inhibitor), abacavir (non-nucleoside reverse transcriptase inhibitor, NNRTI), lamivudine (NRTI)을 병합한 초강력항레트로바이러스제병용(HAART) 약물 Trimeq® (ViiV Healthcare, Brentford, UK) 복용 후 퇴원하였다.
환자는 이후 신경계증상이 모두 호전되었고 기존 약물을 잘 복용하며 외래 경과를 관찰하던 중 4개월째 우측 편마비가 재발하였다. 당시 활력징후는 혈압 132/85 mmHg, 맥박수 58회/분, 호흡수 19회/분, 체온 36.3℃였다. 증상 발생 3시간 후 시행한 신경계 진찰에서 의식은 명료하였고, 구음장애와 우측 안면마비, 우측 상하지 위약감은 MRC 등급으로 4/4이었으며 NIH 뇌졸중척도(NIHSS)는 4점이었다. 증상 재발 4시간 만에 촬영한 뇌 자기공명영상확산강조영상에서 좌측 기저핵(basal ganglia)에 고신호강도로 급성기 뇌허혈 변화가 확인되었고, 조영증강 뇌 자기공명혈관조영술에서 좌측 중대뇌동맥 M1 부위의 협착 소견이 새롭게 관찰되었다(Fig. 2). CD4+ T림프구 절대 수치가 260/μL까지 상승되었고, HIV RNA 정량검사는 <20 copies/mL 미만으로 호전되고, 뇌수막염을 포함한 다른 전신 기회감염은 동반되지 않아 HIV 감염증은 잘 조절되었다고 판단하였다. 재발시 당화혈색소 5.1%, 중성지방 62 mg/dL, 고밀도콜레스테롤 45 mg/dL, 저밀도콜레스테롤 51 mg/dL로 전체 콜레스테롤을 포함한 일반생화학검사, 일반혈액검사, 프로트롬빈시간, 활성부분트롬보플라스틴시간은 모두 정상으로 처음 내원 당시와 의미 있는 변화는 없었다. 재발 후 시행한 심장초음파 등의 검사상 추가적인 심장성 색전증은 발견되지 않았고, 항포스포리피드 관련 항체와 같은 혈액응고 관련 검사도 정상이었다. 재조합조직플라스미노겐활성제 정맥내 투여 24시간 후 중대뇌동맥협착 악화를 고려하여 클로피도그렐(clopidogrel)을 추가하고 아트로바스타틴(atorvastatin)의 양을 80 mg으로 증량하였다. 입원 7일 후 경미한 구음장애와 우측 상지 위약감은 남아있었으나 NIH 뇌졸중척도 2점으로 회복되어 퇴원하였다.
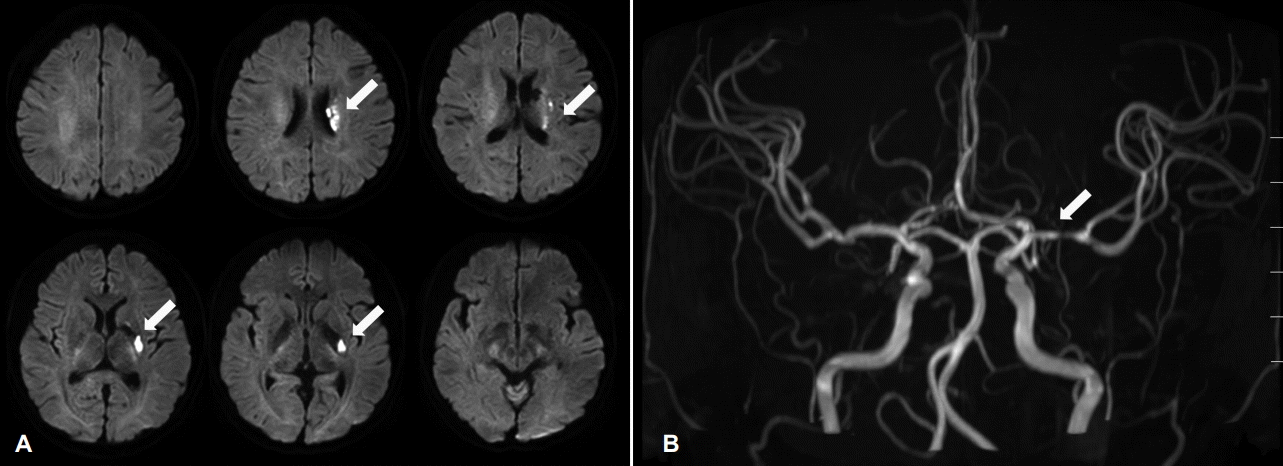
Brain magnetic resonance imaging and magnetic resonance angiography (MRA) images at 4 months after the first admission. (A) Diffusion-weighted image shows early ischemic changes on the left corona radiata, basal ganglia and internal capsule (white arrows). (B) Time-of-flight MRA shows focal stenosis at the M1 segment of the left middle cerebral artery (white arrow).
고 찰
임상적으로는 HIV 감염 환자의 1-5%에서 뇌졸중이 발생하는 것으로 알려져 있으나, 사후 부검 연구에 따르면 감염자의 4-34% 이상에서 허혈대뇌병변이 보고되었다[4]. 최근 코호트 연구에서는 HIV 감염자의 38%에서 동맥류, 협착 및 폐색 대뇌혈관협착 등의 대뇌혈관이상 소견이 관찰되었다[5]. 이와 관련된 기전으로는 HIV 감염으로 인한 직간접적인 혈관염, 혈관 내피세포 기능이상, 혈류장애, 응고장애 및 HAART의 부작용 등이 연관이 있을 것으로 추정된다[2-6].
본 증례에서는 젊은 환자가 뇌경색으로 내원하여 HIV 감염증이 확진되었다. 당시 발생한 뇌경색의 기전으로는 심장성 색전증을 포함하여 젊은 환자의 뇌졸중 발생에 기여하는 인자들이 확인되지 않았고, 큰동맥 협착 또한 뚜렷하지 않아 소동맥폐색으로 인한 열공뇌경색으로 분류하였다. 뇌척수액검사 등을 통하여 기회감염이 배제되었으므로 증례 환자의 소혈관폐색은 HIV 감염으로 인한 직접적인 뇌혈관 손상과 혈관염 등이 원인이 되었을 수 있다. 이전 임상 연구들에 따르면 HIV 감염증 연관 동맥혈관염(단, 기회감염증 포함)은 뇌경색의 13-28%를 차지한다고 하였다[7]. 혈관염의 확인을 위해서는 면역 침착 및 T세포 유도 성장인자와 같은 염증물질들로 인한 직접적인 혈관벽 손상과 관련 혈관내 염증세포들을 조직학적으로 확인하여야 하나 침습적 검사에 따른 위험성을 고려하여 본 환자에게는 시행하지 않았다[6].
환자는 첫 번째 뇌경색 발병 후 아스피린과 고지혈증 약물을 꾸준히 잘 복용하면서 신경학적으로 완전히 회복되고, HAART를 통하여 HIV 감염증도 잘 조절되던 중 4개월째 동일 부위 중대뇌동맥협착을 동반한 뇌경색이 재발하였다. 현재 HIV 감염증의 일차 표준치료제로 권장되는 초강력 항레트로바이러스제병용요법(HAART)은 3제 이상의 강력한 항레트로바이러스 복합제의 도입으로 약물순응도가 높아지고 HIV 감염이 효과적으로 억제되게 되었다[8]. 그러나 HAART에 포함되는 항프로테아제(antiprotease)와 같은 일부 약물은 직접적으로 혈관 내벽 손상을 초래하거나 이상지질혈증과 인슐린저항성과 같은 대사이상을 유발하여 죽경화성 동맥경화로 인한 큰동맥폐색을 악화시켜 뇌졸중이나 심근경색의 발생률을 높일 수 있다[9]. 이러한 HIV 감염증 치료 중 악화된 중대뇌동맥 협착은 대부분 수개월 이상의 장기간 HAART로 인한 대사성 합병증과 관련하여 큰동맥경화의 가속화, 만성 전신염증반응, C형간염이나 거대세포바이러스(cytomegalovirus)와 같은 중복감염 등과 관련이 있다[2,9]. 증례 환자의 경우 HAART에 항프로테아제 약물은 포함되지 않았으며, 재발 당시 대사성 합병증도 발생하지 않았다. 만성 전신염증수치는 정상이었으며 관련 중복감염은 동반되지 않았다. 따라서 HIV 치료 시작 후 비교적 단기간 이내 기회감염이나 중복감염 없이 HIV 감염증이 비교적 잘 조절되던 상태에서 대뇌동맥협착이 동반된 뇌경색의 재발은 본 증례의 특이점이라 하겠다.
이와 관련된 기전들로는 전신 HIV 감염증의 활성도는 억제되었으나 뇌혈관내 염증반응이 연관 큰대뇌동맥에서 지속적으로 진행되어 혈관 내피세포 기능이상 및 혈류장애로 인한 협착이 초래되었을 가능성이 있다[2]. 또한 HIV 혈관병증으로 인하여 취약해진 혈관벽에 혈관박리가 새롭게 발생하였거나 악화되었을 가능성도 고려된다[10]. 이를 위하여 뇌 자기공명혈관조영술로는 판단이 제한적이므로 플라크 뇌 자기공명혈관조영술 등의 추가검사가 도움이 되었을 것으로 사료된다.
1990년대 중반 HAART 도입 이후 HIV 감염증 환자의 뇌경색 발생률이 증가하고 있으나 이와 관련한 전향적 연구들은 희박한 실정이다[2]. 현재까지 HIV 감염증 환자의 장기 생존율 향상으로 인한 일반적인 뇌경색 발생률의 증가를 배제하고, HIV 감염증과 직접적인 뇌경색 발생 위험률을 추정하기는 어렵다. 다만 본 증례와 같이 HIV 감염증 진단 초기에 허혈뇌졸중으로 발현하여 대뇌혈관 협착으로 인한 뇌경색이 재발할 수 있으므로 주의를 요한다. 향후 HIV 감염증의 치료 중 뇌졸중 발생을 예방하기 위하여 두개내 혈관협착 발생과 관련된 예측인자와 기전에 대한 좀 더 많은 연구를 통하여 대뇌혈관병증을 고려한 이상적인 예방 약제 선택이 필요하겠다.