| J Korean Neurol Assoc > Volume 35(1); 2017 > Article |
|
Abstract
Myasthenia gravis (MG) is estimated to be refractory in approximately 10% of patients with generalized MG. A 35-year-old man was diagnosed as generalized MG with thymoma. Despite aggressive immunotherapies, his myasthenic symptoms relapsed five times within one year. We therefore administered rituximab for treating the refractory MG, and this resulted in remission. There are few reports on treating MG with rituximab, but this case suggests that rituximab can be an effective treatment option for refractory MG.
중증근무력증은 반복되는 근력약화와 피로가 특징이며 전신형의 약 85%에서 아세틸콜린수용체에 대한 항체가 양성인 대표적인 신경근육이음부의 자가면역질환이다[1]. 중증근무력증의 치료목표는 환자의 증상호전이나 완화를 얻는 것이며, 그 과정에 따른 부작용은 줄이는 것이다. 이를 위해 아세틸콜린에스테라아제억제제(acetylcholine esterase inhibitor), 스테로이드(steroid), 혈장분리교환술(plasmapheresis), 면역글로불린(immunoglobulin)정맥주사와 다양한 면역억제제를 사용한다. 대부분의 환자들은 이러한 치료에 좋은 반응을 보이지만, 약 10% 정도에서는 만족스러운 치료목표에 도달하지 못하게 되며 일상생활장애를 초래하며 이러한 경우 난치성중증근무력증(refractory myasthenia gravis)으로 분류한다[2]. 리툭시맙(rituximab, RTX)은 B세포의 활성화, 분화 및 증식을 감소시키는 면역억제제로서 다양한 자가면역질환에서 치료제로 사용되며 최근에는 이러한 난치성중증근무력증에서도 그 효과를 인정받고 있다[3]. 저자들은 난치성중증근무력증 환자 치료에 리툭시맙을 사용하였고, 효과적으로 병의 완화를 경험하여 이를 보고하고자 한다.
35세 남자가 2개월 동안 반복되는 복시와 안검하수로 방문하였다. 1개월 전부터는 삼킴곤란증상이 나타났고, 사지의 근력저하도 동반되었다. 환자의 과거력에서 특이소견은 없었다. 신경학적진찰에서 환자의 의식은 명료하였으나 경도의 구음장애가 있었으며, 팔, 다리 근위부의 근력은 Medical Research Council (MRC)등급 4로 확인되었다. 입둘레근(orbicularis oris)과 승모근(trapezius)의 저빈도자극반복신경자극검사에서 10% 이상의 의미있는 감소를 보였다. 혈액검사에서 아세틸콜린수용체항체(acetylcholine receptor antibody)는 13.76 nmol/L로 증가되었으며, 류마티스인자(rheumatoid factor), 항핵항체(anti-nuclear antibody), 항중성구세포질항체(anti-neutrophil cytoplasmic antibody), 루푸스항응고인자(lupus anticoagulant)는 모두 음성이었다. 그리고 흉부컴퓨터단층촬영에서 2.8 cm 크기의 흉선종(thymoma)이 확인되어, 흉성종을 동반한 전신중증근무력증으로 진단하였다. 이후 피리도스티그민(pyridostigmine)과 함께 프레드니솔론(prednisolone) 60 mg/day을 투여하였고 흉선종절제술을 시행하였다. 환자의 복시, 안검하수와 근력이 모두 호전되어 프레드니솔론을 30 mg/day까지 서서히 감량을 하였다. 하지만 3개월 후 복시가 다시 발생하여 프레드니솔론을 60 mg으로 다시 증량하고, 아자티오프린(azathioprine) 100 mg/day를 추가로 투여하면서 복시는 호전되었다. 5개월째에 안검하수, 목근육의 근력저하(MRC 4)와 삼킴곤란이 발생하여 5일간 고용량메틸프레드니솔론(methylprednisolone)정맥주사치료(1 g/day)를 하였다. 이후 삼킴장애가 호전되다가 한달 뒤 급격하게 악화되어 고용량메틸프레드니솔론정맥주사치료를 재시행하였으나 근력은 MRC 2까지 악화되었고, 삼킴곤란도 더 심해져 5일간 면역글로불린정맥주사를 투여하였다. 일시적인 근력의 호전이 있었으나 다시 악화되어 결국 혈장분리교환술을 시행한 이후 임상호전을 보였다. 이후 프레드니솔론 50 mg/day을 지속하며 아자티오프린을 중지하고 미코페놀레이트모페틸(mycophenolate mofetil)을 하루 1,000 mg 투여하는 것으로 변경하였으나 10개월 째 다시 복시, 삼킴곤란 및 근력저하로 인해 재입원을 하였고 호흡부전으로 기계환기까지 시행하였다. 당시 MG중증도는 Myasthenia Gravis Foundation of America (MGFA) 기준으로 Class IIIa였다. 환자는 이전에 면역글로불린치료가 효과적이지 않아 바로 혈장분리교환술을 시행하였고 조금씩 증상의 호전을 보였다. 처음 증상이 발생한 이후 1년 이내에 5번의 악화를 보이며 임상적 완화에 도달하지 못하여 난치성중증근무력증으로 판단하였다. 난치성중중근무력증치료를 위해서 고용량프레드니솔론을 유지하면서, 리툭시맙을 매주 한번씩 375 mg/m2을 4주간 투여하였고 4주 간격으로 375 mg/m2 을 3회 투여하는 강화요법을 시행하였다. 리툭시맙치료 전 B세포의 비율은 24.9% (B cell/lymphocyte)였으나, 3번의 강화요법을 시행 후에는 0.0%로 억제되는 것을 확인할 수 있었다. 리툭시맙투여 전 MGFA IIa로 안검하수와 복시, 목근육의 근력 저하(MRC 4)만 있는 상태였고 리툭시맙을 투여하는 동안 증상의 변화는 뚜렷하게 없었으나 7회의 전체 치료를 마치고 증상은 완화로 호전되었다. 리툭시맙치료 이후 현재까지 약 14개월 동안 프레드니솔론은 10 mg/day으로 감량하였고, 현재까지 약리완화(pharmacologic remission)상태를 유지하고 있으며(Fig.), 아세틸콜린수용체항체는 4.23 nmol/L, B세포의 비율은 0%로 확인되었다.
중증근무력증은 대표적인 신경근육이음부질환으로 아세틸콜린수용체에 항아세틸콜린항체, muscle-specific tyrosine kinase (MuSK)항체 그리고 근래에는 low density lipoprotein receptor-related protein 4 (LRP4)항체 등이 시냅스후수용체에 작용하여 아세틸콜린수용체의 수를 감소시켜 다양한 신경계증상을 유발한다[4]. 아세틸콜린수용체는 아직 명확한 기전은 밝혀지지 않았지만 B세포 및 T세포에 모두 영향을 받는다[5]. 이전의 중증근무력증치료는 비정상신경근육이음부에 작용하는 약물이 주를 이루었으나 근래에는 전신자가면역질환에 준하여 치료를 하고 있다. 그럼에도 불구하고 치료에 잘 반응하지 않는 난치성중증근무력증이 약 10%를 차지한다[2]. 난치성중증근무력증의 명확한 정의는 없으나 일반적으로 (1) 적절한 약물용량/치료기간에도 불구하고 호전이 없는 경우, (2) 치료에 도달하는 과정에서 심각한 부작용이 나타나는 경우, (3) 잠재부작용을 가질 만큼 고용량의 약물이 필요한 경우, (4) 치료에 도달하기 힘든 다른 질환이 있는 경우, (5) 면역글로불린이나 혈장분리교환술과 같은 단기면역치료가 반복적으로 필요한 경우, (6) 빈번하게 근무력증위기가 나타나는 경우로 정의한다[6].
Suh 등[7]은 난치성중증근무력증이 여성에서, 발병나이가 젊을수록, 그리고 흉선종이 확인된 경우에 빈도가 높다고 보고하였다. 이 문헌에는 모든 난치성중증근무력증 환자가 MuSK항체 또는 아세틸콜린항체에 양성이었고 각각의 빈도는 비슷하였으나 아세틸콜린항체양성인 경우(53%)가 MuSK항체양성인 경우(47%)보다 더 많았다. 그러나 아세틸콜린항체가 양성인 82명의 중증근무력증 환자 중 난치성 환자가 10명인데 반해서, MuSK항체양성인 11명의 중증근무력증 환자 중 9명의 환자가 난치성으로 확인되어, MuSK양성인 중증근무력증이 난치성으로 진행할 가능성이 높아 보인다[7].
난치성중증근무력증은 중증근무력증위기로 쉽게 진행하기 때문에 더욱더 적극적인 치료가 필요하다. 아직 충분한 의학적 근거를 가진 치료지침은 없지만 고용량시클로포스파미드, 리툭시맙 그리고 근래에 들어 에쿨리주맙이 소규모 문헌을 통해 효과가 입증되어 있다.
최근 중증근무력증치료에 리툭시맙의 치료효과를 메타분석하였다. 이 문헌에서는 난치성중증근무력증 환자가 86% 이상 포함되었으며, 리툭시맙에 83.9%의 높은 치료반응을 보였다[3]. 통계적으로 유의하지는 않았지만 MuSK항체양성군에서 가장 좋은 치료효과를 보였고, 리툭시맙의 치료효과는 환자의 중등도와는 상관없었으며 질환의 유병기간과도 통계적으로는 유의하지 않았으나 연관성이 있는 것으로 보고하였다. 리툭시맙의 부작용은 전체 168명 중 7명(4.2%)에서 발생하였으며 한명의 환자에서 심부전이 발생하였으나 대부분에서 심각한 부작용은 발생하지 않았다[3].
리툭시맙은 항CD20단클론키메라항체(chimeric monoclonal anti-CD20 antibody)로서 형질 세포(plasma cell)의 전구세포인 B세포에 작용하여 일차적으로 B세포의 활성화, 분화 및 증식을 감소시킨다[3]. 리툭시맙은 T세포에도 영향을 주는데, 첫째로 조절T세포(regulatory T cell)의 비율을 증가시키고, 두번째로 B세포의 항원 제시기능을 무력화시키고 다른 종류의 T세포를 자극할 수 있는 수지상세포(dendritic cell)나 대식세포(macrophage)에 방향전환(redirecting)을 유도하며, 마지막으로 염증전구물질을 생성하여 CD20을 발현하는 데 영향을 주는 T세포를 억제한다[3]. 또, 리툭시맙이 CD4+조절T세포의 자가관용에도 연관이 있다는 보고도 있다[8]. 리툭시맙의 B세포억제효과는 1년 이상 지속되는 되는 것으로 보고되었으며[3], Catzola 등[8]은 MuSK양성의 난치성중증근무력증 환자에서 리툭시맙치료 후에 B세포가 치료 전의 수로 회복되어도 조절T세포는 치료 20개월까지도 증가된 채로 유지되었지만, 항아세틸콜린항체양성인 환자에서는 조절T세포가 높게 유지되지 않으며 임상경과에서도 뚜렷한 호전을 보이지 않아 리툭시맙의 재치료가 필요하였다고 보고하였다. 항아세틸콜린항체양성인 본 증례에서는 조절T세포의 수치를 확인하지는 않았으나 리툭시맙치료 이후에 B세포수는 1년 이상 효과적으로 억제되고 있음을 확인하였고 임상호전상태가 잘 유지되고 있어 리툭시맙의 치료효과를 확인할 수 있었으며, 조절T세포의 수치변화가 리툭시맙의 치료반응의 예후인자인지에 대해서는 추가적인 연구가 필요할 것으로 생각된다.
난치성중증근무력증에서 리툭시맙치료를 하는데 확립된 용법은 없으나 소규모 문헌들에서는 375 mg/m2 을 매주 4-6회 주사 후 매달 주사하는 방법으로 2-6개월 간 사용하였으며 대부분의 환자들이 완화를 보이고 스테로이드의 유지용량을 효과적으로 줄일 수 있었다(Table).
현재까지 국내에서는 중증근무력증 환자를 대상으로 리툭시맙의 효과를 입증한 보고는 없다. 이전의 외국의 소규모 연구들과 이번 국내 보고를 통해서 난치성중증근무력증의 치료의 폭이 확대될 수 있기를 바라며, 향후 더 명확한 난치성중증근무력증의 정의와 리툭시맙의 적절한 치료 용법과 안전성에 대한 체계적인 전향연구가 필요하다고 생각된다.
REFERENCES
1. McGrogan A, Sneddon S, de Vries CS. The incidence of myasthenia gravis: a systematic literature review. Neuroepidemiology 2010;34:171-183.


2. Drachman DB, Adams RN, Hu R, Jones RJ, Brodsky RA. Rebooting the immune system with high-dose cyclophosphamide for treatment of refractory myasthenia gravis. Ann N Y Acad Sci 2008;1132:305-314.



3. Iorio R, Damato V, Alboini PE, Evoli A. Efficacy and safety of rituximab for myasthenia gravis: a systematic review and meta-analysis. J Neurol 2015;262:1115-1119.


4. Zisimopoulou P, Evangelakou P, Tzartos J, Lazaridis K, Zouvelow V, Mantegazza R, et al. A comprehensive analysis of the epidemiology and clinical characteristics of anti-LRP4 in myasthenia gravis. J Autoimmun 2014;52:139-145.


5. Sun F, Ladha SS, Yang Li, Liu Q, Shi SX, Su N, et al. Interleulin-10 producing-B cells and their association with responsiveness to rituximab in myasthenia gravis. Muscle Nerve 2014;49:487-494.


6. Silvestri NJ, Wolfe GI. Treatment-refractory myasthenia gravis. J Clin Neuromuscul Dis 2014;15:167-178.


7. Suh J, Goldstein JM, Nowak RJ. Clinical characteristics of refractory myasthenia gravis patients. Yale J Biol Med 2013;86:255-260.


8. Catzola V, Battaglia A, Buzzonetti A, Fossati M, Scuderi F, Fattorossi A, et al. Changes in regulatory T cells after rituximab in two patients with refractory myasthenia gravis. J Neurol 2013;260:2163-2165.


Figure.
Clinical course of the patient. The severity of the patient was measured by MG composite scale (0-50). MG; myasthenia gravis, IVIG; intravenous immunoglobulin.
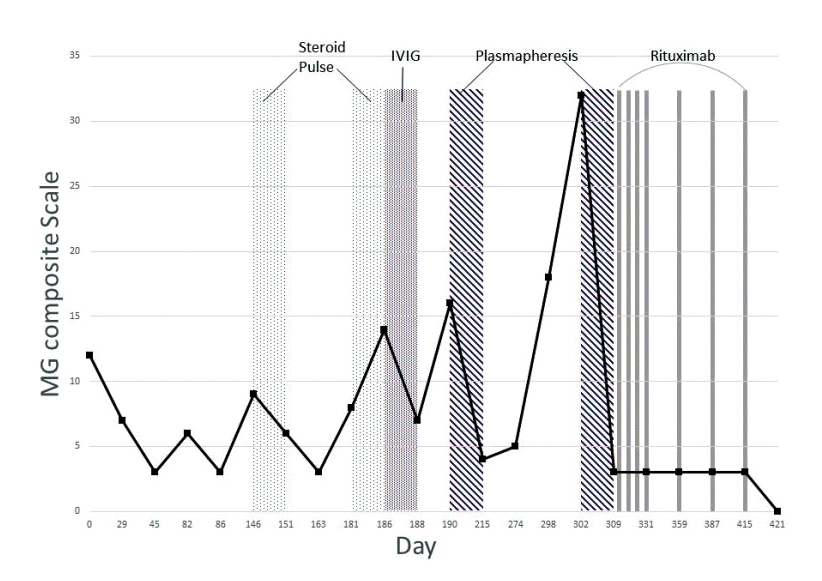
Table.
Dosing Regimen and the effects of treatment used in published literatures
| Study | Patients | Rituximab dosing | Clinical response (improving rate) |
|---|---|---|---|
| Illa et al.a | 3 AChR, 3 MuSK | 375 mg/m2 weekly ×4 weeks, then a single dose monthly for 2 months | 100% (total=6, improved=6) |
| Lebrun et al.a | 1 AChR, 3 MuSK, 2 SN | 375 mg/m2 weekly ×4 weeks, then monthly for 2 months | 100% (total=6, improved=6) |
| Zebardast et al.a | 2 AChR, 4 MuSK | 375 mg/m2 weekly ×4 weeks or 6 weeks | 66% (total=6, improved=4) |
| Nowak et al.a | 6 AChR, 8 MuSK | 375 mg/m2 weekly ×4 weeks, then 375 mg/m2 weekly for 4 weeks for 6 months | 100% (total=14, improved=14) |
| Maddison et al. [9] | 7 AChR, 3 MuSK, 2 VGCC (LEMS) | 375 mg/m2 weekly ×4 weeks in 8 patients | 66% (total=12, improved=8) |
| 375 mg/m2 one or two infusion in 4 patients | |||
| Diaz-Manera et al.a | 11 AChR, 6 MuSK | 375 mg/m2 weekly ×4 weeks, then monthly for 2 months | 94% (total=17, improved=16) |
| Collongues et al.a | 7 AChR, 3 MuSK, 1 AChR + MuSK, 2 SN | (1) 375 mg/m2 weekly ×4 weeks, then 375 mg/m2 every 3 months or | 100% (total=13, improved=13) |
| (2) 2 infusions of 1 g each 2 weeks apart | |||
| Anderson et al. [10] | 5 AChR, 6 MuSK, 3 SN | (1) 375 mg/m2 weekly ×4 weeks, then monthly for 2 months or | 100% (total=14, improved=14) |
| (2) 750 mg/m2 every 2 weeks for 1 month |
a Modified from Silvestri et al. [6]
- TOOLS
-
METRICS

-
- 2 Crossref
- 0 Scopus
- 13,164 View
- 246 Download
- Related articles
-
Ageusia in the Patients with Myasthenia Gravis2015 November;33(4)
The History of Myasthenia Gravis2009 ;27(2)
Laboratory Tests and Their Significances in Myasthenia Gravis1994 ;12(4)
Effect of Thymectomy in Myasthenia Gravis1991 ;9(4)
Tensilon Tonometry in Diagnosis of Myasthenia Gravis1988 ;6(2)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



