독시플루리딘으로 인해 위암 환자에 발생한 가역적백질뇌병증
Reversible Leukoencephlaopathy Caused by Doxifluridine in a Patient with Gastric Cancer
Article information
Trans Abstract
Doxifluridine neurotoxicity is more rare than 5-FU neurotoxicity. We report a case of leukoencephalopathy caused by long-term use of doxifluridine and which was resolved after discontinuation. A 37-year-old woman who had been on doxifluridine for 4 months after gastrectomy presented with dysarthria. Diffusion-weighted MRI imaging revealed multifocal hyperintense lesions in subcortical areas. Her symptoms disappeared after discontinuing doxifluridine, and lesions on follow-up MRI were resolved. These findings suggest that doxifluridine is a plausible cause of reversible leukoencephalopathy.
독시플루리딘(doxifluridine)은 경구용 fluoropyrimidine 계열의 5’-deoxy-5-fluorouridine으로 소화기암, 유방암 등에 사용되며, 5-fluorouracil (5-FU)의 전구약물로 알려져 있다[1]. 독시플루리딘은 암조직에 많이 분포되어 있는 티미딘인산화효소(thymidine phosphorylase)에 의해 5-FU로 체내에서 대사되어 약효를 발현하는 것으로 보고되고 있다. 5-FU의 신경독성에 대해서는 비교적 많이 알려져 있지만[2] 그 전구약물인 독시플루리딘과 연관된 신경독성에 대해서는 많이 알려져 있지 않다. 독시플루리딘으로 인해 발생한 신경독성은 드물게 중추신경계의 백질변성 또는 말초신경계의 감각신경병증의 형태로 보고되어 있지만[1] 5-FU에 발생하는 신경독성에 비해 흔치 않아 명확한 기전과 임상 양상에 대해서는 많이 밝혀지지 않았다.
저자들은 진행성 위암 환자에서 장기간 고용량의 독시플루리딘 투약 중에 가역적백질변성이 발생한 증례를 보고하며, 독시플루리딘과 같은 항암제의 신경독성을 예측하는데 약물 대사와 관련된 유전자 연구의 필요성에 대해 설명하고자 하는 바이다.
증 례
37세 여자가 방문 하루 전부터 시작된 구음장애와 입술 주변 부위 감각이상으로 왔다. 증상 발생 당시에는 혀가 잘 움직여지지 않고 오른쪽 팔에 위약감을 호소하고 있었다. 환자는 약 2년 전 진행위암(advanced gastric cancer)으로 진단 받아 위아전절제술(radical subtotal gastrectomy)을 받았고 이후로 항암요법으로 TS-1 (tegafur, gimeracil, oteracil) 을 8차에 걸쳐 치료 받았지만, 치료 당시에는 특별한 신경독성을 의심할 수 있는 증상은 보이지 않았다. 증상 발병 4개월 전부터는 독시플루리딘(900 mg/d)으로 변경하여 복용하기 시작하였다. 가족력에서 아버지는 위암으로, 어머니는 뇌경색으로 사망하였다. 항암치료 이외의 약물 복용력, 외상의 병력, 사회력에서 특이 사항은 없었고, 활력징후를 포함한 신체진찰은 모두 정상이었다.
응급실 방문 당시 신경학적 진찰에서 의식 수준은 명료하였고 뇌신경검사에서 구음장애, 삼킴곤란, 입술 주위의 감각저하와 눈감기를 잘 할 수 없는 얼굴근육마비를 보이고 있었다. 응급실 방문 이후에는 오른쪽 팔의 위약감은 호전되어 양측 상하지 근력 및 감각은 모두 정상이었다. 소뇌기능검사 중 손가락코검사에서 겨냥이상이 발견되고, 발꿈치정강이검사에서 운동실조가 보이고 있었다. 심부건반사는 정상이고 병적 반사는 보이지 않았다.
입원 시 시행한 뇌자기공명영상에서 뇌확산강조영상과 액체감쇠역전회복영상(fluid-attenuated inversion recovering imaging, FALIR)에서 뇌실 주변 피질하백질 영역에 대칭적인 고신호강도를 보였고, 겉보기확산계수(apparent diffusion coefficient) 영상에서 저신호강도를 보여 세포독성에 의한 병변으로 추정할 수 있었다(Fig. A). 자기공명혈관조영검사는 정상이었다. 혈액검사에서 헤모글로빈 수치가 9.7 g/dL (정상 12.0-16,0 g/dL)로 저하된 것을 제외하고는 자가면역질환, 신생물딸림항체를 포함한 혈청검사는 정상이었다. 뇌척수액검사에서 염증반응이나 감염을 시사하는 소견은 발견되지 않았으며, 혈청 및 뇌척수액단백전기영동검사, 올리고클론띠(oligoclonal band)도 음성이었고 소변검사는 정상이었다. 입원 후 독시플루리딘의 독성에 대한 약물유전학적 설명을 위해 독시플루리딘 대사의 속도제한효소인 dihydropyrimidine dehydrogenase (DPD) 효소의 코딩유전자인 DPYD를 직접염기서열분석법(direct sequencing)을 이용하여 분석하였다[3]. 그 결과 엑손부위에서 3개의 이형접합변이, 인트론에서 2개의 이형접합변이와 2개의 동형접합변이(IVS22+55 TT, IVS23-69 GG), 3’-비해독부위 (3’-UTR)에서 1개의 동형접합변이(3’-UTR+73 GG)가 발견되었다(Table).
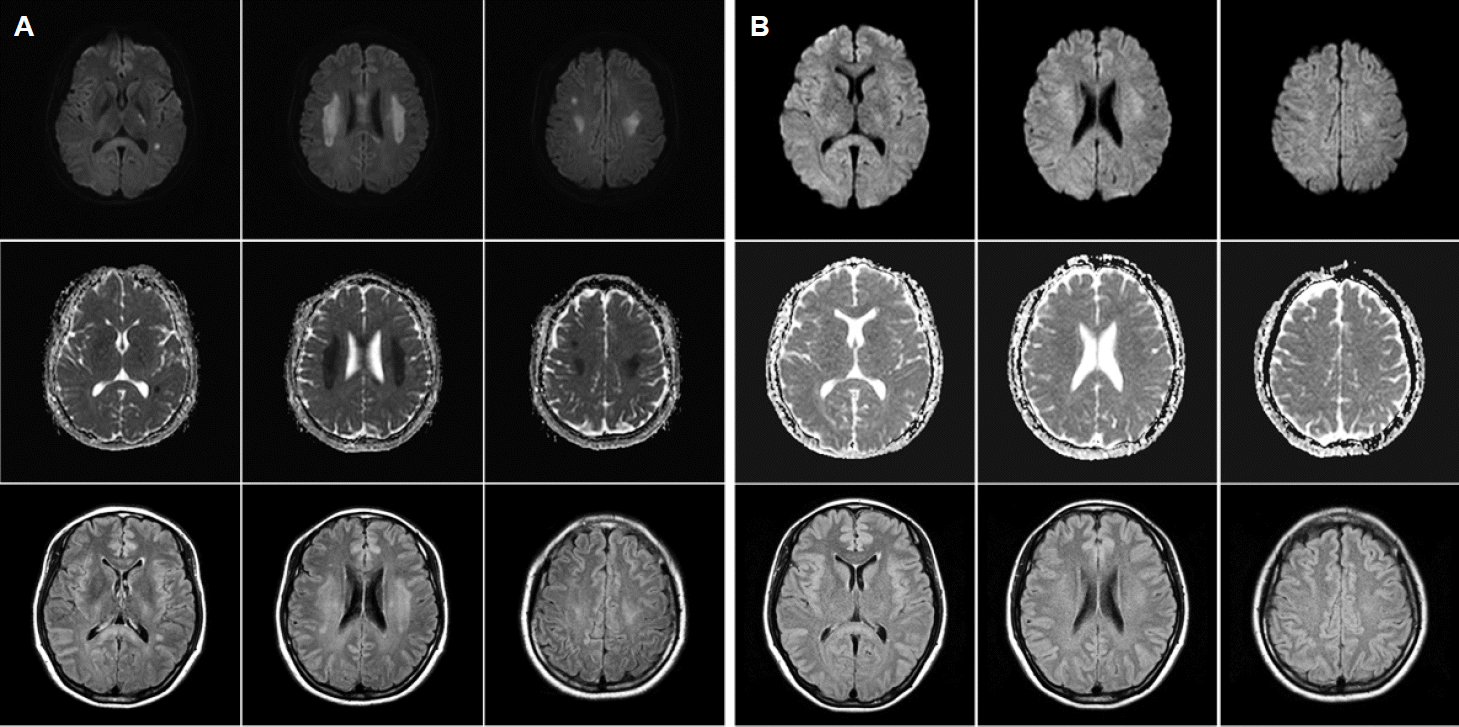
Initial and follow-up brain magnetic resonance imaging of the patient. Diffusion-weighted imaging (DWI) and fluid-attenuated inversion recovering imaging (FALIR) showed hyperintense lesion on the multifocal subcortical areas including posterior limb of internal capsule, centrum semiovale, corpus callosum, frontotemporal subcortical regions, and apparent diffusion coefficent (ADC) map in corresponding areas showed hypointense signal, suggesting cytotoxic edema (A). Follow-up brain DWI and FLAIR images 5 days after discontinuation of doxifluridine showed decreased signal intensities in the subcortical whitematter and corona radiata, and ADC map were resolved (B).
독시플루리딘을 중단하였으며 보존적 치료를 하였다. 입원 5일째에 확인한 뇌자기공명영상 중 뇌확산강조영상과 FLAIR 영상에서 고신호강도의 감소를 확인할 수 있었고, 겉보기확산계수는 정상화되었다(Fig. B). 입원 2일째 이후 구음장애와 입술 주위의 감각이상의 신경계증상은 빠르게 호전되어 발병 이전의 상태로 대부분 호전되어 입원 7일째에 퇴원하였다. 퇴원 2개월 후 5개월 동안 저용량 독시플루리딘(300 mg/d)을 사용하며 관찰 중이며 증상의 재발은 관찰되지 않았다.
고 찰
항암제와 연관된 가역적뇌병증이나 백질뇌병증은 고혈압성뇌증, 산후뇌혈관병증, 자간증, 신장질환 등의 질환에서 주로 발생하며, 또한 면역억제제, 항암제 등의 약물치료 이후에 발생할 수 있으므로 이에 대한 감별진단이 필요하다. 항암제와 연관된 뇌병증은 주로 메토트렉세이트(methotrexate), 사이타라빈(cytarabine), vincrstine, 5-FU 등의 약물을 투약할 경우 나타나며 주로 가역적후뇌병증증후군(posterior reversible encephalopathy syndrome, PRES) 또는 백질병변의 두 가지 형태로 나타나게 된다는 보고가 있지만[4] 독시플루리딘에 의한 뇌병증에 대한 보고는 드물다. 독시플루리딘으로 인해 발생한 신경독성은 드물게 발생하며, 중추신경계에서 백질변성 또는 급성 소뇌병증, 말초신경계에는 감각신경병증의 형태로 발생한다[1].
독시플루리딘은 5-FU의 전구약물이며 정확한 기전은 아직 밝혀지지 않았지만 대사과정을 통해 생성된 5-FU로 인한 티아민의 부족이 신경독성 기전으로 설명되고 있다[5]. 현재까지 밝혀진 바로는 독시플루리딘의 신경독성은 약물용량과 투입방법의 차이, 고령, 전신 건강상태의 악화 등과 관련되어 있다. 뿐만 아니라 5-FU의 신경독성 연구를 통해 DPD 활성도와 관련되어 DPD 활성이 저하된 환자들에게서 신경독성이 유발된다는 것을 확인할 수 있었지만[5], Kim 등[1]에 의한 연구에는 DPD 활성이 정상임에도 불구하고 독시플루리딘의 복용으로 인해 신경독성이 발생할 수 있다고 발표하였다. 현재까지 DPD 활성을 감소시키는 것으로 알려진 유전자변이로는 DPYD*9B, *10 등이 있으며, DPD 효소를 불활성화시키는 유전자변이로는 *2A, *3, *7, *8, *11, *12, *13, 496A>G, IVS10-15T>C, 1156G>T, 1845G>T 등이 알려져 있다[6].
이들 결과에 근거하여 최근 미국, 유럽 등에서는 기능감소 또는 기능불활성 유전자변이에 따른 5-FU 등의 fluoropyrimidine계 항암제의 맞춤치료 가이드라인을 제시하고 있다. 이에 따르면, 기능이 감소/불활성 DPYD 유전자변이의 이형접합변이(heterozygote)인 경우에는 fluoropyrimidine 계 항암제의 약물용량을 50% 정도 감량, 동형접합변이(homozygote)인 경우 다른 계열의 항암제로 대체하도록 권고하고 있다[7].
본 증례에서 볼 수 있는 독시플루리딘에 의한 가역적백질뇌병증은 매우 드문 질환으로 Kim 등[1]의 연구를 통해 보고 되었다. Kim 등[1]에 의한 연구에는 양측 소뇌 치아핵에 병변이 있었으며, 발병 초기 뇌자기공명영상에서 세포독성 부종의 양상으로 나타난 후 18일 뒤에 다시 촬영한 뇌자기공명영상에서 호전경과를 보였다. 발병 부위는 본 증례의 뇌실 주변 피질하백질과는 위치가 다르지만 발병 기전을 유추할 수 있는 세포독성부종을 보였다는 점에서 유사점이 있었다. 본 증례는 임상 경과의 빠른 호전을 보여 5일 만에 촬영한 뇌자기공명영상에서 백질뇌병증의 호전이 나타났지만, Kim 등[1]에 의한 연구에는 18일 뒤에 촬영한 뇌자기공명영상에서 호전을 나타냈다. 본 증례에서 발생한 백질뇌병증은 다른 항암제에 의해서 발생하는 백질뇌병증에서 뇌자기공명영상을 통해 볼 수 있는 혈관성부종과 달리 세포독성부종의 영상 소견을 보이고 있다[1,7]. 이에 대한 정확한 설명은 아직 완전히 연구되어 있지 않지만, 독시플루리딘의 대사물질 중의 하나인 fluorocitrate에 의한 사립체 기능이상에 의한 병리기전이 세포독성부종의 발생 가능성이 제시되기도 한다. 뿐만 아니라 본 증례와 Kim 등[1]에 의한 증례에서 뇌자기공명영상에서 호전 기간의 차이는 임상 경과와 뇌자기공명영상의 촬영 시기에 따라 기간이 다양하게 나타날 수 있으므로 추후 연구를 통해 임상경과와 영상경과의 관계를 밝혀야 할 것이다.
독시플루리딘의 중단을 통해 증상이 빠르게 호전되었고 이후 약물을 투여하지 않은 기간에는 재발이 없었다는 점을 통해 독시플루리딘이 백질병변을 유발할 수 있다는 것을 알 수 있었으며, 저용량 독시플루리딘의 재사용 이후에는 증상의 재발이 되지 않는 점을 통해 약물용량과 신경독성과의 관계를 확인할 수 있는 증례라고 볼 수 있다. 이에 본 증례에서는 독시플루리딘의 약동학(주로 5-FU의 혈중농도)에 영향을 줄 수 있는 유전적 인자인 DPYD의 유전적 다형성을 탐색하고자 하였다.
본 증례에서는 DPD 코딩유전자인 DPYD 유전자의 유전형분석을 수행하였고, 엑손 부위에서 3개의 이형접합변이, 인트론에서 2개의 이형접합변이와 3개의 동형접합변이를 확인하였다. 관측된 변이 유전자 중, DPYD*5B (1627A>G, IVS13+39C>T) 변이는 DPD 활성에 영향을 주지 않는 것으로 알려져 있으며[8], 이외 엑손 부위에서 관측된 1896T>C 변이도 효소활성에 영향을 주지 않는 것으로 보고되고 있다[9]. 그러나, 동형접합변이인 IVS22+55 TT, IVS23-69 GG 3’-UTR+73 GG는 아시안에서 1% 미만으로 보고되고 있으며[10], 그 기능에 대해서는 알려진 바 없다. 따라서, 상기 유전자 변이를 가지는 사람에서 DPD 활성도 측정을 통해 유전자형과 표현형의 관계에 대한 상관성 연구가 추가적으로 필요할 것이다.
본 증례를 통해 독시플루리딘이 가역적백질병증을 유발할 수 있는 것을 확인함에 따라 가역적백질병증의 원인으로써 독시플루리딘과 같은 항암제에 대한 주의 깊은 관찰이 필요함을 알 수 있다. 뿐만 아니라 항암제에 의한 신경독성을 예측할 때 항암제 대사에서 작용하는 효소의 활성도 측정 외에 효소를 발현하는 유전자 연구를 통해 유전형과 표현형의 관계에 대한 해석이 필요하며, 이를 통해 신경독성을 예방하는 방법으로 임상적 요인에 대한 조절 외에도 유전학적인 연구가 필요할 것이다.
Acknowledgements
본 연구는 보건복지부의 재원으로 한국보건산업진흥원의 보건의료기술연구개발사업 지원에 의하여 이루어진 것임 (과제고유번호: HI14C1063).
