| J Korean Neurol Assoc > Volume 33(4); 2015 > Article |
Abstract
Background:
Periodic lateralized epileptiform discharges (PLEDs) are associated with altered consciousness in 75% of patients. Major controversy about PLEDs is whether they are ictal or interictal phenomenon. Diagnosis of non-convulsive status epilepticus is often guided by response to benzodiazepine. We conducted a study to evaluate quantitative differences of EEG activity with PLEDs according to their response to acute benzodiazepine trial.
Methods:
Nineteen patients with altered consciousness (stupor or coma) for whom the electroencephalography (EEG) recording with acute benzodiazepine trial was undertaken within 24 hours of onset of altered consciousness were retrospectively enrolled. Morphology of PLEDs including amplitude, frequency, and variability of the frequency was analyzed. Quantitative analysis of EEGs includes spectral power, spectral coherence, and graph theory analysis. Results of the analyses were compared between patients whose PLEDs were abolished by benzodiazepine (BDZ-R group) and those whose PLEDs persisted (BDZ-NR group).
Results:
Morphologic variables were not different between two groups. In BDZ-R group, alpha-1 activity was increased in both frontopolar areas. Beta activity was also increased in both frontal areas while delta activity was reduced. In BDZ-R group, alpha-1 and beta activities were more coherent between bilateral hemispheres in frontal, anterior temporal, and central areas. Coherence line topographic map also revealed more bilaterally symmetric pattern in BDZ-R group. Network characteristics revealed by graph theory analysis did not differ between the two groups.
주기편측뇌전증모양방전(periodic lateralized epileptiform discharges, PLEDs)은 1964년 Chatrian 등이 최초로 기술한 이후, 한 쪽 대뇌반구 혹은 반구의 한 영역에서 나타나는 주기적이거나 준 주기적인 뇌전증모양방전을 의미하는 단어로 사용되어 왔다[1-3]. 급성 혹은 만성기의 뇌혈관계 장애(뇌경색 혹은 뇌출혈)가 가장 흔한 기저질환으로 알려져 있으나, 중추신경계 감염 및 염증성 질환(herpes simplex encephalitis, La Cross virus encephalitis, subacute sclerosing panencephalitis, Creutzfeldt-Jacob disease, neuro-turberculosis), 중추신경계 신생물, 외상, 대사장애 등의 다양한 상태들에 의해 PLEDs가 유발될 수 있는 것으로 알려져 있다[4].
Reiher 등은 PLEDs를 PLEDs proper와 PLEDs plus로 분류하기도 하였으며, PLEDs proper는 단조로운 파형과 주기성을 유지하는 상태로, PLEDs plus는 복합적인 모양과 비교적 긴 후 탈분극, 발작간 뇌전증모양방전이 발생하는 것으로 정의하였다[5]. 최근 연구들에서는 PLEDs plus의 경우에서 임상적 발작 혹은 뇌전증지속상태(status epilepticus)와 더 강한 상관관계가 있다고 보고하고 있다[6].
뇌파에서 PLEDs를 보인 환자의 약 75%에서 의식저하가 동반된다[4]. 전체 뇌파에서 PLEDs가 관찰되는 비율은 0.1-1%로 비교적 드물지만[7,8], 응급 상황에서 시행되는 뇌파검사에서는 약 4%로 드물지 않게 관찰된다[4]. 또한 의식저하는 뇌전증 발작과 더불어 PLEDs를 보인 응급 뇌파가 시행된 주된 이유이다[3]. PLEDs가 뇌전증 발작현상(ictal phenomenon)인지 혹은 뇌병변에 의하여 나타나는 이차적인 현상인지에 대하여 많은 논란이 있어 왔으나 임상적인 의미에 대하여는 명확히 규명되지 않았다[1]. 많은 연구에서 PLEDs의 존재가 장기적으로 불량한 예후와 관련이 있으며, 주의 깊은 감시가 필요한 상태로 생각되어 왔으며[2], 일부는 뇌전증지속상태의 한 형태라고 주장하기도 하였다. Assal 등[9]은 PLEDs 환자의 SPECT 검사에서 과관류가 보였던 점과 PLEDs가 기록되기 전 경련이 선행했다는 점을 들어 PLEDs가 뇌전증발작의 현상 혹은 대뇌의 대사가 항진된 상태이라고 보았다. 이런 연구들의 연장선상에서, PLEDs를 발작 현상으로서 뇌손상을 악화시킬 수 있는 뇌전증지속상태의 한 형태로 보아 항경련제치료가 필요하다고 하는 의견이 지지를 받고 있는 바[10] PLEDs의 예후를 예측하기 위한 노력으로 다양한 연구들이 있어 왔다. 원인 질환이 뇌종양이나 급성기 뇌졸중인 경우 가역성이 있는 원인에 의한 경우보다 예후가 나쁜 것으로 알려져 있으며[6], 뇌파에서 관찰되는 뇌전증모양방전의 진폭이 클수록 불량한 예후를 시사한다는 보고도 있었다[11].
본 연구에서는 PLEDs를 적극적인 항경련제의 투약이 필요한 상태로 보고, 뇌전증지속상태와 마찬가지로 초기 치료의 반응 여부가 예후에 영향을 미칠 것으로 추정하였다. 또한 이 초기 치료에 대한 반응성이 뇌전증모양방전의 형태적 특징과 약물 주입 전 뇌파의 성상과 관련이 있을 것으로 생각하였다. 이에 뇌전증지속상태의 초기 치료 및 모호한 뇌파 패턴의 감별 진단에 사용되는 γ-amino-butyric acid (GABA) 수용체에 작용하는 벤조디아제핀(benzodiazepine) 계열 약물에 대한 반응 여부에 따른 형태학적, 정량적 뇌파의 차이를 분석해 보았다.
2004년 8월 1일부터 2014년 10월 31일까지 충남대학교병원에서 시행한 뇌파검사에서 PLEDs를 보인 환자 225명 중 다음의 선정기준을 만족하는 환자들을 선정하여 후향적으로 분석하였다. 대상환자 선정기준은 (1) 뇌파검사에서 PLEDs가 보이고, (2) 뇌파검사 시 평가한 의식수준이 stupor, semicoma, 혹은 coma이며, (3) 뇌파검사 중 PLEDs가 관찰되는 중에 벤조디아제핀이 투여된 경우로 하였다. 뇌파검사 상 PLEDs 외에 뚜렷한 발작 패턴(seizure pattern)이 기록된 경우(23명), 의식 저하 발생 후 30일 경과 이전에 의식수준의 호전을 보이지 않은 상태로 퇴원 혹은 전원되어 임상결과의 평가가 불가능한 환자(37명), 의식저하가 발생한 후 처음 검사한 뇌파에서는 PLEDs가 관찰되지 않다가 나중에 PLEDs가 나온 환자(41명), 의식저하가 발생한지 48시간 이후 뇌파검사를 시행했던 환자(62명), 뇌파검사 전 벤조디아제핀이 투여된 경우(24명), 벤조디아제핀 투여 여부 혹은 투여 시점이 기록되지 않은 경우(12명), 벤조디아제핀이 투여되지 않은 경우(7명)는 대상에서 제외하였다.
환자들은 벤조디아제핀 투여 이후 뇌파의 변화에 따라 벤조디아제핀 반응군과 벤조디아제핀 비반응군으로 분류하였다. 벤조디아제핀 반응군은 벤조디아제핀 투여 이후 PLEDs가 소실되었거나, 주기성 방전의 진폭이 50% 이상 감소한 군으로 정의하였고, 벤조디아제핀 비반응군은 벤조디아제핀 투여 이후에 PLEDs가 소실되지 않고, 방전의 진폭이 증가하거나, 이전과 같은 수준을 유지하거나 혹은 50% 미만으로 감소한 경우로 정의하였다.
환자들의 임상결과는 뇌파기록 당시의 의식수준을 기준으로 비교하여 (1) 환자의 의식수준이 발병 30일 이내에 발병 이전 상태로 완전히 회복된 경우 ‘완전 회복’, (2) 발병 30일 이내에 완전치 않은 호전이 있는 경우 ‘부분 회복’, (3) 발병 30일째의 의식수준이 호전이 없거나 악화된 경우 ‘무회복’, (4) 발병 30일 이내에 사망한 경우 ‘사망’으로 분류하였다.
모든 환자에서 뇌파기록은 의식저하의 발생 48시간 내에 시행되었다. 국제 10-20 전극계에 따른 전극 19개(Fp1, Fp2, F7, F3, Fz, F4, F8, T7, C3, Cz, C4, T8, P7, P3, Pz, P4, P8, O1, O2)와 두 개의 전측두부 전극(FT9, FT10)을 부착하고 Pz를 기준 전극으로 하였으며, E-series (Compumedics, Victoria, Austrailia) 장비를 사용하여 디지털로 기록하였다. 기록 중 임피던스(impedence)는 5 kΩ 미만으로 유지하였고, 샘플링 레이트(sampling rate)는 256 Hz를 사용하여 약 30분에서 60분간 기록하였다.
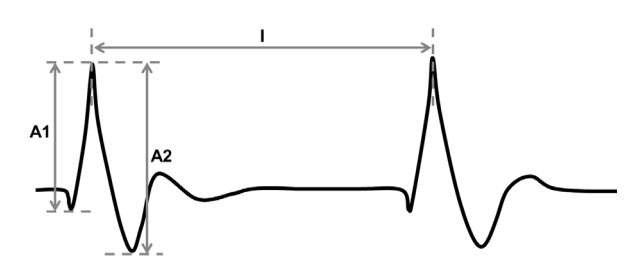
뇌파에서 기록된 PLEDs의 형태학적 분석을 위하여 벤조디아제핀 투여 전에 기록된 30개의 연속된 주기성 방전을 임의로 선택하였다. 형태학적 변수로 방전의 평균 진폭, 방전의 평균 빈도, 그리고 방전의 빈도의 일관성을 측정하였다. 측정을 위하여 대역필터(band-pass filter)는 0.5-70 Hz로 설정하였으며 반대측 귀 기준 몽타주(contralateral ear referential montage)를 사용하였다. 방전의 평균 진폭은 각각의 환자에서 선택된 30개의 주기성 방전의 진폭들의 평균으로 하였다. 방전의 진폭은 주기성 방전의 시작점에서부터 최고점까지의 진폭(A1)과, 최고점에서부터 최저점까지의 진폭(A2)을 더하여 이분한 값을 사용하였다(Fig. 1). 방전의 빈도(F)는 30개의 주기성 방전의 극점간의 간격(I)을 모두 측정하여 평균값을 낸 후 이의 역수를 사용하였다. 방전의 빈도의 일관성(R)을 측정하기 위해 각각의 환자에서 방전의 극점간의 간격(I)들의 분산을 구하였다.
뇌파의 정량적 분석을 위하여 기록된 뇌파들은 공통평균기준몽타주(common average referential montage)로 변경하였다. 벤조디아제핀 투여 이전에 기록된 뇌파 중에서 2초 길이의 에포크(epoch) 140개를 무작위로 선택하였고, 이들 중 과도한 잡파(artifact 혹은 noise)가 혼입된 에포크들은 배제하였다. 결과적으로 각 환자당 평균 137.6±4.3개의 에포크들이 선택되었다.
스펙트럼전력분석(spectral power analysis)을 위하여 우선 각각의 에포크에 고속푸리에변환(fast Fourier transformation)을 적용하였고, 변환된 에포크들은 스펙트럼 추정을 향상시키기 위하여 평균화(averaging)하였다. 주파수 대역은 1 Hz부터 40 Hz까지로 하였고 주파수 해상도는 0.4 Hz로 하였다. 이들 주파수를 다시 다음과 같은 대역으로 분류하였다: Delta, 1-3 Hz; Theta, 3-7 Hz; Alpha 1, 7-10 Hz; Alpha 2, 10-13 Hz; Beta, 13-30 Hz; gamma, 30-40 Hz. 뇌파 전극들은 전두극부(Fp1, Fp2), 전두부(F3, F4, Fz), 중심부(C3, C4, Cz), 두정부(P3, P4, Pz), 후두부(O1, O2), 좌측 측두부(F7, T7, P7), 우측 측두부(F8, T8, P8)의 7개 영역으로 분류하였다: 각 대역별로 절대 전력(absolute power)을 구하였고, 상대 전력(relative power)을 구하기 위해 각 대역별 절대 전력을 각 환자의 전체 스펙트럼 전력으로 나누었다. 상대 전력은 통계 분석을 위하여 로그 변환하였다.
전술한 6개의 주파수 대역에서, F3-C3, F4-C4, T7-P7, T8-P8, C3-P3, C4-P4, P3-O1, P4-O2의 8개 전극짝에 대한 반구내 스펙트럼일관성(intrahemispheric spectral coherence)과 F3-F4, T7-T8, P7-P8, C3-C4, P3-P4, O1-O2의 6개의 전극짝에 대한 반구간 스펙트럼일관성(interhemispheric spectral coherence)을 계산하였다. 계산에는 MATLAB의 신호 처리 toolbox의 magnitude-square coherence function을 사용하였다. 수학적으로, x와 y 사이의 교차 스펙트럼밀도(cross-spectral density)를 Cxy라 하고, x와 y의 자동스펙트럼밀도(auto-spectral density)를 각각 Gxx 및 Gyy라 할 때, 두 개의 뇌 신호 x(t)와 y(t) 사이의 스펙트럼일관성 Cxy는 다음과 같이 정의된다.
각 대역폭에서 전극짝에 대하여 전술한 바와 같이 계산한 일관성 값을 바탕으로 꼭지점(node)과 변(edge)으로 표현되는 그래프(graph)를 얻을 수 있다[15]. 여기서 꼭지점은 일관성 분석에 사용된 각각의 전극들이고 변은 유의한 일관성 값을 보인 전극짝 사이의 연결이다. 따라서 꼭지점은 해당 뇌영역을 대표하고 변은 이들 뇌영역들간에 기능적 연결이 있음을 뜻한다. 이 그래프는 대칭인접매트릭스(symmetrical adjacency matrix)를 통해 정량적으로 표현할 수 있다.
대칭인접매트릭스로 표현된 뇌의 기능적 네트워크(functional network)의 위상기하학적 특성을 Watts와 Stogatz가 제안한 다음의 위상기하학적 매개변수(topological parameters)를 사용하여 수치화 하였다[16]. 군집계수(clustering coefficient) C는 지역 연결성(local connectivity)의 지표이다. Ci를 전극 i와 인접한 이웃간에 연결된 변의 수와 이웃들간에 형성 가능한 최대 변의 수의 비로 정의하였을 때 군집 계수 C는 다음과 같이 정의된다.
네트워크의 평균군집계수는 개별 꼭지점들 주변의 군집된 연결성이 존재할 확률을 반영한다. 또한 이는 네트워크가 오류로부터 회복되는 정도를 반영할 수도 있는데, 이는 하나의 연결이 군집을 이룬 경우 하나의 꼭지점이 소실되더라도 이웃간의 연결이 유지될 수 있기 때문이다.
평균경로길이(average path length) L은 네트워크의 전반적인 연결성의 지표이다. 경로 길이 dij를 꼭지점 i에서부터 출발하여 j에 이르기까지 거쳐야 하는 변의 최소값이라 할 때 평균 경로 길이 L은 다음과 같이 정의된다:
L은 모든 가능한 꼭지점 짝 사이의 평균 경로 길이이기 때문에 그래프의 통합성, 즉 네트워크 내에서 정보들이 얼마나 빨리 그리고 쉽게 전송될 수 있는지를 반영한다.
지역 연결이 많고 긴 원거리 연결이 적은 형태의 네트워크를 작은 세상 네트워크(small world network)라 한다[16]. 이 작은 세상 네트워크는 질서정연한 네트워크(ordered network)와 무작위 네트워크(random network)의 중간에 해당하는 것으로, 지역 내의 정보 전달 뿐만 아니라 전반적인 정보 전달의 효율성이 높으면서도 연결 비용과 에너지 소모가 낮은 특징을 가지고 있다[17]. 작은 세상 지수(small world index) S는 작은 세상 네트워크를 정량화한 지표이다[18]. S는 검증하고자 하는 네트워크의 군집 계수와 무작위 네트워크(random network)의 군집 계수의 비를 분자로 하고, 검증하고자 하는 네트워크의 평균 경로 길이와 무작위 네트워크의 평균 경로 길이를 분모로 하는데, 다음과 같은 수식으로 표현할 수 있다.
S가 1보다 크면, 즉 무작위 네트워크보다 더 군집화되어 있으면서 무작위 네트워크와 유사한 평균 경로 길이를 가진다면 작은 세상 네트워크로 판단할 수 있다.
뇌파검사에서 PLEDs가 기록되었던 225명 중 선정기준을 만족하는 환자는 19명이었다. 환자들의 인구통계학적 및 임상 정보는 Table과 같다. 이들 중 벤조디아제핀 반응군은 9명, 벤조디아제핀 비반응군은 10명이었고, 이들 군 간에 연령과 성별의 차이는 없었다. 원인 질환은 뇌혈관질환이 10명(52.6%)이었고 대사성 뇌병증이 9명(47.4%)이었으며, 원인 질환별로 벤조디아제핀 반응군 비율의 차이는 없었다(p=0.414). 발병 30일 경과 시점에서의 임상 결과는 완전 회복 5명(26.3%), 부분 회복 5명(26.3%), 무회복 4명(21.1%), 사망 5명(26.3%)이었다. 대상 환자 수의 한계로 인해 벤조디아제핀 반응에 따른 임상 결과의 차이는 비교할 수 없었다.
PLEDs의 진폭은 벤조디아제핀 반응군에서 164.00±07.34 μV, 비반응군에서 130.57±97.03 μV로 두 군 간에 차이는 없었다(p=0.780). PLEDs의 빈도(반응군 vs. 비반응군=1.10±1.24/s vs. 1.99±2.17/s, p=0.133)와 간격의 분산(반응군 vs. 비반응군=399.60±270.44 vs 319.55±125.34, p=0.842) 역시 두 군 간에서 유의한 차이를 보이지 않았다.
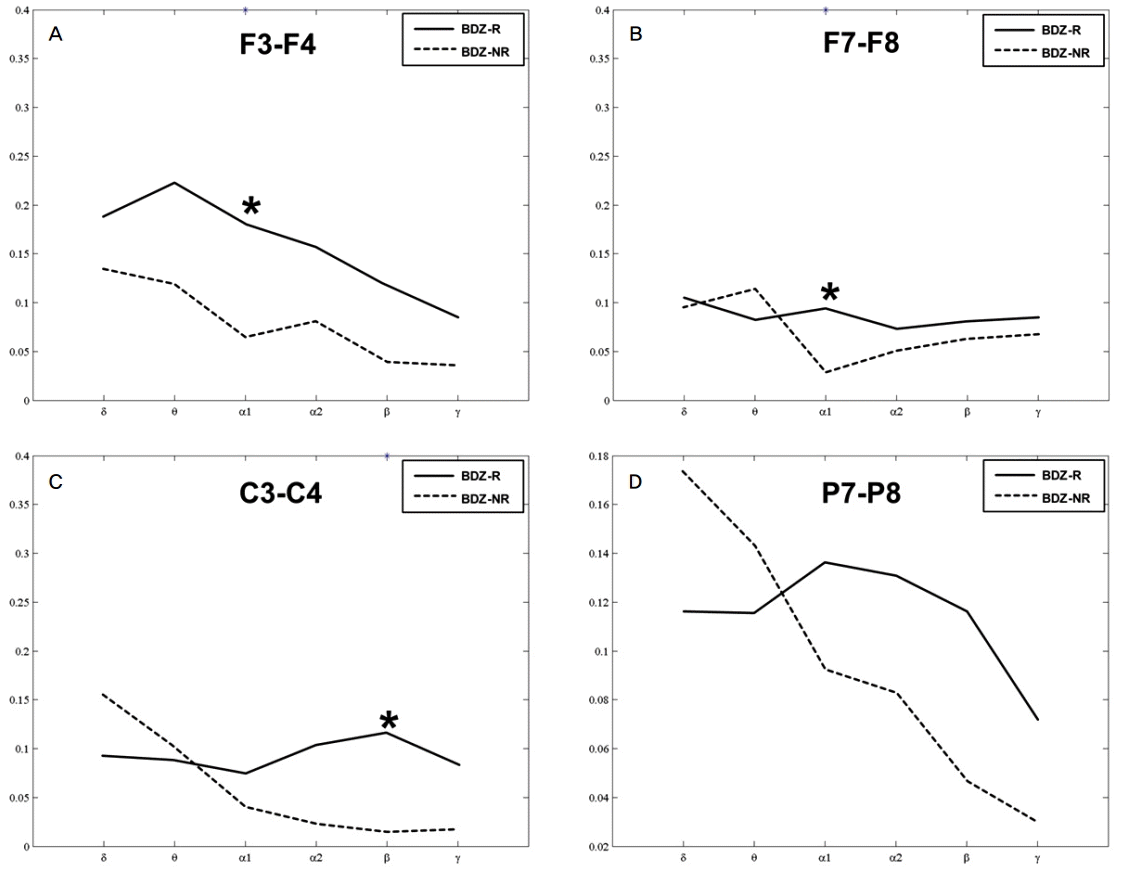
모든 전극에서의 각 주파수 대역 별 스펙트럼 전력을 비교하였을 때, 절대 전력 및 상대 전력 모두 양 군 간에 통계적 차이는 없었다. 뇌영역별로 나누어 보면 전두극부에서 벤조디아제핀 비반응군에 비해 반응군에서 alpha 1 및 beta 대역의 전력이 증가되어 있었고, 전두부에서는 반응군에서 delta 대역의 전력 감소 및 alpha 1 대역의 전력 증가가 관찰되었다(Fig. 2). 중심부, 그 외의 부위에서는 양 군간의 차이는 없었다.
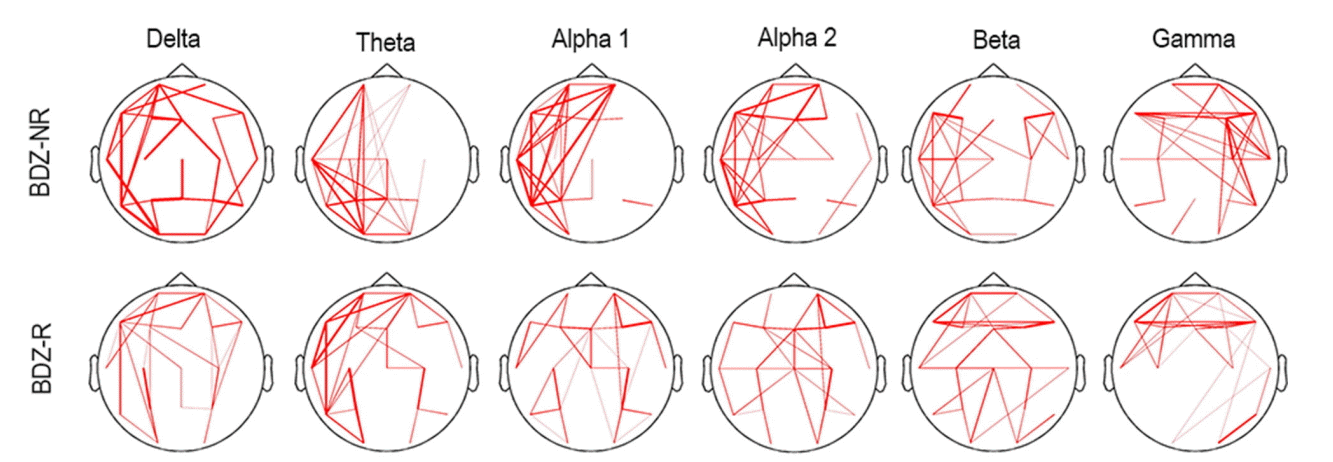
벤조디아제핀 반응군과 비반응군의 주파수 대역별 전반적 일관성 형태를 선형지형도(line topographic map)로 표시하였다(Fig. 3). 벤조디아제핀 비반응군에서 일관성의 형태가 비대칭으로 관찰되었는데, 특히 Alpha 1 이상의 고주파 대역에서 대칭성의 차이가 뚜렷하였다. 정량적 분석 결과, 반구내 영역들 간의 일관성은 양 군에서 유의한 차이를 보이지 않았다. 그러나 반구간 일관성 분석에서는 벤조디아제핀 반응군에서 비반응군에 비해 전두부 및 전측두부에서 alpha 1 대역의 일관성이 증가되었고, 중심부 영역에서 beta 대역의 일관성이 증가되어 있었다(Fig. 4).
본 연구에서 저자들은 PLEDs가 벤조디아제핀에 의해 억제 혹은 소실되는 환자군과 그렇지 않은 환자군에서의 뇌파의 정량적 차이를 규명하고자 하였다. 양 군에서 PLEDs의 형태학적 차이는 없었다. 뇌파를 정량적으로 분석한 결과, 벤조디아제핀 반응군에서 양측 전두극부의 alpha 1 및 beta 대역 활동이 증가되어 있었고 양측 전두부에서 alpha 1 대역 활동의 증가와 delta 대역 활동의 감소가 관찰되었으며, 전두부 및 전측두부, 그리고 중심부 영역에서 alpha 1 혹은 beta 대역의 반구간 일관성이 증가되었음을 확인하였다.
PLEDs는 1964년 Chartrian 등이 처음 기술한 흔하지 않은 뇌파 소견이다. 이런 특이한 형태의 방전은 대뇌 반구의 구조적 병변(뇌졸중, 뇌종양)이나 뇌전증, 헤르페스뇌염, 무산소뇌병증, 대사뇌병증 등 다양한 원인들에 의해 유발될 수 있는 것으로 알려져 있다. PLEDs의 임상적 의의에 대한 가장 의미있는 논란은, 이것이 활동적인 발작상태, 즉 발작기를 의미하는가 아니면 단지 발작간기에 나타나는 현상인가 이다[3,10,19,20]. PET과 SPECT를 이용한 연구에서 PLEDs가 관찰되는 뇌부위의 포도당 대사 및 혈류 증가가 관찰됨을 근거로 PLEDs가 발작 상태이며, 따라서 적극적인 항경련제 치료가 필요하다는 주장이 있다[9,10]. 반면에, 일부에서는 PLEDs가 뇌병변 이후 발생하는 신경세포들의 일시적인 비정상적 흥분으로 나타나며, 세포들이 회복되거나 사멸하면 사라지는 일시적 현상으로 발작 현상은 아니라는 주장도 있다[3].
뇌파 상 비경련성 뇌전증지속상태(non-convulsive status epilepticus, NCSE)는 (1) 1초에 3차례 이상 나타나는 전반화 혹은 국소 극파, 예파, 극서파복합체, (2) 1초에 3차례 미만으로 나타나는 전반화 혹은, 국소 극파, 예파, 극서파복합체가 관찰되나 적극적인 항경련제 치료에 의해 의식 상태의 호전이나 정상 뇌파로의 회복이 보이는 경우, (3) 주기적 혹은, 준주기적인 파형이 1초에 1차례 이상 나타나며, 이들이 빈도, 모양, 위치 측면에서의 진행이 보이는 경우가 10초 이상 반복될 때로 정의되고 있다. 이런 기준으로 분명하게 판단하기 어려운 뇌파 파형에 대해서 단기 작용 항경련제인 벤조디아제핀 투여에 대한 반응을 바탕으로 NCSE를 진단하는 기준들이 사용되어 왔다[21,22] 이는 PLEDs를 보이는 환자가 현재 발작기인지 아닌지를 감별하기 위한 수단으로도 사용되고 있다[23]. Jirsch와 Hirsch는 주기성 방전이 의식 저하 환자에서 나타날 경우 뇌파에서 주기성 방전이 사라지고 이전의 정상적 배경파가 나타나거나, 임상적 증상의 확실한 호전이 있거나, 혹은 약물의 부작용이 나타날 때까지 반감기가 짧은 미다졸람 등의 벤조디아제핀 약물을 1 mg씩 최대용량까지 반복 투약해 볼 것을 권고하였다[22]. 만약 벤조디아제핀의 정맥 주사 이후 환자의 신경학적 증상이 호전되거나 뇌파상 주기성 방전이 소실되고 정상적인 배경파가 나타날 경우 이전에 보였던 주기성 방전이 뇌전증발작을 시사하는 소견이라고 판단할 수 있다. 하지만 실질적으로 환자의 의식 회복이나 신경학적 증상의 호전은 수시간에서 하루 이상 소요되는 경우가 많기 때문에 뇌파 상의 주기성 방전의 소실만으로도 추가적인 치료 필요성 여부와 치료 방향을 결정에 중요한 역할을 한다[23]. 본 연구에서는 벤조디아제핀 투여 후 PLEDs가 억제 혹은 소실 되는 경우와 그렇지 않은 경우간에 PLEDs 형성의 병태생리학적 및 전기생리학적 기전에 차이가 있을 것이라 가정하였다. 때문에 벤조디아제핀 반응성의 기준을 NCSE 진단을 위한 Jirch와 Hirsch의 기준과는 다르게 적용하였다.
뇌전증지속상태의 일차 치료 약제로 사용되는 벤조디아제핀은 초기 투여가 용이하고 혈액뇌장벽을 신속히 투과하여 빠른 효과를 보여 전통적으로 발작 및 뇌전증지속상태의 조절을 위해 사용되어왔다[24]. 벤조디아제핀은 주로 GABA수용체에 작용하여 억제성 신호를 유발한다. GABA는 중추신경계의 주된 억제성 신경전달물질이며, GABAA수용체와 GABAB수용체를 통해 작용하게 된다. GABAA수용체가 활성화되면 염소 이온 투과성을 증가시켜, 과다분극(hyperpolarization)을 유발하여 신경 세포를 억제하며 GABAB수용체는 활성화되어 칼륨 이온 통로를 열거나 닫음으로써 지속적 과다분극과 이에 의한 시냅스후 억제를 유발하여 뇌전증모양방전의 발생을 막는다. 동물 모델에서 뇌전증발작이 지속될 경우 GABA수용체의 소단위들이 세포막 안으로 내재화되는 과정을 통해 세포막 표면의 발현도가 떨어지는 모습을 보이게 된다[25]. 이러한 receptor trafficking이 뇌전증 지속상태가 길어질수록 심해지는 항경련제에 대한 불응성의 중요한 기전으로 알려져있다.
뇌파기록에서 alpha 대역 활동은 10Hz 전후의 주파수 범주를 갖는 활동으로 최근의 연구들에서 대뇌의 정보 처리 능력과 밀접한 연관을 가지고 있는 것으로 알려졌다[26]. 또한, alpha 대역 활동은 피질의 흥분성을 조절하는데 중요한 역할을 한다고 생각되고 있으며, alpha 대역 활동의 증가가 대뇌피질의 흥분성을 억제한다는 보고도 있다[27]. Lehembre 등은 식물상태(vegetative state)와 최소의식상태(minimally conscious state)의 환자들을 대상으로 한 정량적 뇌파 분석 연구에서 최소의식상태 환자들, 즉 대뇌 기능이 더 보존된 군에서 대뇌반구의 모든 영역에서 alpha 대역의 활동성이 유의하게 보존되고 있었으며, 식물상태의 환자들에서 delta 대역 활동이 증가한 것을 보고한 바 있다[28]. 본 연구에서, 벤조디아제핀 비반응군에 비해 반응군의 전두부에서 고주파수 영역(alpha1 및 beta 대역) 활동이 증가되고 저주파수 영역(delta 대역)이 감소된 점은 대뇌 전반에 광범위한 연결을 가지고 있는 전두엽의 기능 보전이 PLEDs의 벤조디아제핀 반응성에 영향을 미친다는 점을 시사한다. 또한 비반응군에 비해 반응군에서 대뇌반구 간 고주파 영역에서만 일관성이 증가된 점은 대뇌반구 사이에 더 많은 정상 생리 상태에 가까운 정보들이 전송되고 있음을 시사한다. 즉 정상적인 뇌파의 주된 주파수 대역인 alpha 및 beta 대역의 보존과, 이 대역 활동의 양 반구간 원활한 상호작용이 벤조디아제핀 비반응성, 즉 GABA receptor trafficking의 발현 정도와 연관된 것으로 생각된다.
기존에도 뇌파검사에서 PLEDs가 보인 환자들의 예후를 예측하거나 전신경련발작과의 연관성을 밝히고자 했던 다양한 연구들이 있어 왔다. Orta 등이 118명의 PLEDs가 관찰된 환자를 대상으로 한 연구에서 원인 질환이 두개내신생물이 아닌 경우에 장기간의 예후가 좋았으며, PLEDs를 높은 주파수와 낮은 전압의 polyspike가 동반된 PLEDs-plus와 그렇지 않은 PLEDs-proper로 나누어 봤을 때 PLEDs-plus에서 임상적 경련과 뇌전증지속상태로 진행할 가능성이 높다고 보고하였다[6]. 다른 연구에서는 뇌파검사 당시 의식의 저하나, 증상 발생 시 임상적 경련이 있었던 경우, 중추신경계감염이 원인 질환인 경우 나쁜 예후와 관련이 있다고 주장한 바 있다[4]. 하지만 기존의 연구들은 PLEDs의 기저 질환이나 성별, 나이 등의 역학, 임상양상에 따른 예후를 예측하는 것에 초점을 둔 연구들이 대부분이었다.
본 연구에서는 대상환자 수의 한계로 PLEDs의 벤조디아제핀에 대한 반응성이 예후에 어떤 영향을 미치는가에 대해서는 분석할 수 없었다. 하지만 PLEDs를 발작기의 현상이라고 보았을 때, 벤조디아제핀에 대한 반응성 여부가 두 군에서 정량적인 뇌파의 차이와 연관된다는 점은 의미 있는 발견이라 생각된다.
이번 연구에서는 몇 가지 한계점이 있다. 첫째, 대상자 수가 적어 통계학적 의미가 낮아질 수 있다. 이러한 한계로 인해 PLEDs의 벤조디아제핀에 대한 반응성이 임상적 예후와의 연관성에 대해서는 분석할 수 없었다. 둘째, 기록한 뇌파 중 임의로 분석 구간을 설정함으로써 선택바이어스가 발생할 수 있다. 셋째, 모든 정보를 후향적으로 조사함으로써 정보의 일관성이 감소할 수 있다. 이런 한계에도 불구하고 본 연구에서 벤조디아제핀에 대한 PLEDs의 반응성 여부가 뇌파의 정량적 특성의 차이와 연관된다는 점은 의미 있는 발견이라 생각된다. 앞으로도 PLEDs가 나타난 환자에서 뇌파 특성에 따른 임상 양상의 차이 및 약물 반응성에 대한 더 많은 연구가 필요하다.
REFERENCES
1. Chatrian GE, Shaw CM, Leffman H. The Significance of Periodic Lateralized Epileptiform Discharges in EEG: An Electrographic, Clinical and Pathological Study. Electroencephalogr Clin Neurophysiol 1964;17:177-193.

2. Lawn ND, Westmoreland BF, Sharbrough FW. Multifocal periodic lateralized epileptiform discharges (PLEDs): EEG features and clinical correlations. Clin Neurophysiol 2000;111:2125-2129.

3. Garcia-Morales I, Garcia MT, Galan-Davila L, Gomez-Escalonilla C, Saiz-Diaz R, Martinez-Salio A, et al. Periodic lateralized epileptiform discharges: etiology, clinical aspects, seizures, and evolution in 130 patients. J Clin Neurophysiol 2002;19:172-177.

4. Kate MP, Dash GK, Radhakrishnan A. Long-term outcome and prognosis of patients with emergent periodic lateralized epileptiform discharges (ePLEDs). Seizure 2012;21:450-456.

5. Reiher J, Rivest J, Grand'Maison F, Leduc CP. Periodic lateralized epileptiform discharges with transitional rhythmic discharges: association with seizures. Electroencephalogr Clin Neurophysiol 1991;78:12-17.

6. Orta DS, Chiappa KH, Quiroz AZ, Costello DJ, Cole AJ. Prognostic implications of periodic epileptiform discharges. Arch Neurol 2009;66:985-991.
7. Firosh Khan S, Ashalatha R, Thomas SV, Sarma PS. Emergent EEG is helpful in neurology critical care practice. Clin Neurophysiol 2005;116:2454-2459.

8. Pohlmann-Eden B, Hoch DB, Cochius JI, Chiappa KH. Periodic lateralized epileptiform discharges--a critical review. J Clin Neurophysiol 1996;13:519-530.

9. Assal F, Papazyan JP, Slosman DO, Jallon P, Goerres GW. SPECT in periodic lateralized epileptiform discharges (PLEDs): a form of partial status epilepticus? Seizure 2001;10:260-265.

10. Kim JM. Periodic lateralized epileptiform discharges are ictal phenomena, and need an antiepileptic treatment. Korean J Clin Neurophysiol 2011;13:21-25.
11. Lim JG. Prognostic value of patients with periodic lateralized epileptiform discharges (PLEDs) [Master's thesis]. Chungnam National University; Daejeon, Korea: 2013.
12. Locatelli T, Cursi M, Liberati D, Franceschi M, Comi G. EEG coherence in Alzheimer's disease. Electroencephalogr Clin Neurophysiol 1998;106:229-237.

13. Adler G, Brassen S, Jajcevic A. EEG coherence in Alzheimer's dementia. J Neural Transm 2003;110:1051-1058.

14. Nunez PL, Srinivasan R. A theoretical basis for standing and traveling brain waves measured with human EEG with implications for an integrated consciousness. Clin Neurophysiol 2006;117:2424-2435.

15. Sporns O. Graph theory methods for the analysis of neural connectivity patterns. In: Kötter R, ed. Neuroscience Databases: A Practical Guide. Norwell MA: Kluwer Academic Publishers, 2002;121-136.

17. Achard S, Bullmore E. Efficiency and cost of economical brain functional networks. PLoS Comput Biol 2007;3:e17.

18. Humphries MD, Gurney K. Network 'small-world-ness': a quantitative method for determining canonical network equivalence. PLoS One 2008;3:e0002051.

19. Garzon E, Fernandes RM, Sakamoto AC. Serial EEG during human status epilepticus: evidence for PLED as an ictal pattern. Neurology 2001;57:1175-1183.

20. Chong DJ, Hirsch LJ. Which EEG patterns warrant treatment in the critically ill? Reviewing the evidence for treatment of periodic epileptiform discharges and related patterns. J Clin Neurophysiol 2005;22:79-91.

21. Young GB, Jordan KG, Doig GS. An assessment of nonconvulsive seizures in the intensive care unit using continuous EEG monitoring: an investigation of variables associated with mortality. Neurology 1996;47:83-89.

22. Jirsch J, Hirsch LJ. Nonconvulsive seizures: developing a rational approach to the diagnosis and management in the critically ill population. Clin Neurophysiol 2007;118:1660-1670.

23. Kim JH. Continuous Electroencephalogram Monitoring in the Neuro-Intensive Care Unit. J Neurocrit Care 2012;5:1-7.
25. Joshi S, Kapur J. GABAA Receptor Plasticity During Status Epilepticus. In: Noebels JL, Avoli M, Rogawski MA, Olsen RW, Delgado-Escueta AV, eds. Jasper's Basic Mechanisms of the Epilepsies. 4th ed. New York: Oxford
University Press, 2012;545-554.

26. Klimesch W. alpha-band oscillations, attention, and controlled access to stored information. Trends Cogn Sci 2012;16:606-617.

27. Haegens S, Osipova D, Oostenveld R, Jensen O. Somatosensory working memory performance in humans depends on both engagement and disengagement of regions in a distributed network. Hum Brain Mapp 2010;31:26-35.

28. Lehembre R, Marie-Aurelie B, Vanhaudenhuyse A, Chatelle C, Cologan V, Leclercq Y, et al. Resting-state EEG study of comatose patients: a connectivity and frequency analysis to find differences between vegetative and minimally conscious states. Funct Neurol 2012;27:41-47.
Figure 3.
The overall pattern of line topographic map of coherence in the benaodiazepine response (BDZ-R) group and the benzodiazepine non-response (BDZ-NR) group. The thickness of the line indicates the relative strength of coherence. BDZ_R; benzodiazepine response group, BDZ_NR; benzodiazepine non-response group
Table
Demographic and clinical characteristics of patients




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




