| J Korean Neurol Assoc > Volume 33(3); 2015 > Article |
Abstract
A 77-year-old man developed diplopia, gait ataxia, and paresthesia. A clinical examination also revealed ophthalmoplegia, facial palsy, ataxia of the limbs and trunk, and reduced deep tender reflexes. Laboratory and electrophysiological studies revealed albuminocytological dissociation and demyelination. He was diagnosed as Miller-Fisher syndrome and received intravenous immunoglobulin therapy. His clinical symptoms deteriorated at 12 weeks after onset. We diagnosed acute-onset chronic inflammatory demyelinating polyradiculoneuropathy, and which the patient recovered from following corticosteroid therapy.
만성염증탈수초다발신경뿌리병(chronic inflammatory demyelinating polyradiculoneuropathy, CIDP)은 점차 진행하거나 완화와 재발이 반복되는 경과를 보이는 말초신경계면역매개질환이다[1]. Miller-Fisher 증후군(Miller-Fisher syndrome, MFS)은 특징적으로 외안근마비, 보행실조 및 심부건반사의 소실을 보이는 질환으로 길랭-바레증후군(Guillain-Barré syndrome, GBS)의 여러 아형 중 하나이다. CIDP의 뇌척수액 및 전기생리학적검사 소견은 GBS와 유사해 초기 CIDP는 GBS와 감별이 어렵다[2]. 하지만 CIDP는 만성적인 경과를 보이며 장기적인 면역억제치료가 필요하기 때문에 이 둘을 감별하는 것은 치료방향결정을 위해 중요하다[3].
MFS로 판단하여 면역글로불린 치료 후 점차 회복되던 환자가 첫 발병 12주 후에 증상이 다시 악화되었으며, 급성발현CIDP (Acute-onset CIDP, A-CIDP)로 다시 진단되어 스테로이드를 사용하면서 증상은 호전되었다. 저자들은 MFS 형태로 발현된 A-CIDP 1예를 경험하였기에 문헌고찰과 함께 보고한다.
77세 남자가 3일 전부터 발생한 복시, 보행장애 및 하지의 이상감각으로 왔다. 증상은 점차 악화되어 타인의 도움 없이 걷기 힘들었다. 증상 발생 3주 전 상기도 감염으로 치료받았으며 당뇨병, 심장질환, 중추신경계감염, 알레르기 등에 대한 과거병력은 없었고 가계에서 유전질환을 가진 사람도 없었으며 신경계독성을 지닌 물질이나 약물을 복용하지 않았다.
신경학적진찰에서 의식은 명료하였고 뇌신경검사에서 양안의 대칭적인 전체 외안근마비와 양쪽 얼굴마비가 관찰되었다. 근력은 대칭적으로 상지는 medical research council (MRC) 4+등급, 하지 근위부는 4+등급, 원위부는 5등급이었다. 이상감각을 호소하는 양쪽 하지에서 촉각, 온도 및 통각감각의 저하를 보였다. 심부건반사는 양쪽 상지에서 감소되고 하지에서는 소실되어 있었으며 병적과다반사는 보이지 않았다. 경미한 근력저하에 비해 보행장애가 심하였으며 이는 사지와 체간에서 관찰된 운동실조로 인한 것으로 판단되었다. 입원 이후에는 혈압변동, 기립저혈압, 장마비로 인한 배변장애 및 배뇨장애와 같은 자율신경계 이상이 관찰되었다(Fig. 1-A). 뇌척수액검사에서 백혈구는 관찰되지 않았고 단백질은 106.41 mg/dL로 증가되어 있었으며 당은 혈액에서 118 mg/dL, 뇌척수액에서 61 mg/dL로 감소되지 않았다. 갑상선기능검사를 포함한 혈액검사 및 소변검사는 모두 정상이었다. GM1, GM2, GD1a, GD1b, 그리고 GQ1b에 대한 자가항체는 음성이었다.
증상발생 7일째 시행한 전기생리학적검사에서 양쪽 얼굴신경마비가 관찰되었고(Fig. 2), 오른쪽 비골신경의 F파가 관찰되지 않으며 양쪽 척골신경의 전도차단이 관찰되었다. 또한 모든 운동신경의 종말잠복기가 연장되었으며 거의 모든 운동 및 감각신경의 신경전도속도가 감소되었다(Table).
호흡기감염 이후 발생한 외안근마비, 운동실조, 심부건반사소실, 양쪽 얼굴마비와 뇌척수액검사에서 알부민세포해리를 보이고 신경전도검사에서 탈수초신경병이 관찰되어 MFS로 판단하였고, 면역글로불린을 하루 0.4 g/kg의 용량으로 5일 동안 정맥주사하였다. 치료시작 8일째 외안근마비와 운동실조가 호전되어 붙잡고 혼자서 일어서는 것이 가능하였다. 2주째에는 장마비가 호전되었다(Fig. 1-B). 3주째는 보조기를 사용하여 혼자서 조금씩 걷는 것이 가능하였으나 혈압변동과 외안근마비의 회복속도가 빠르지 않아 두 번째 면역글로불린치료를 처음과 같은 용량으로 시행하였다. 두 번째 면역글로불린치료 후 10일째 외안근마비가 많이 호전되어 복시는 없어졌으며 혼자서 보조기를 사용하여 활동이 가능한 정도까지 회복되어 퇴원하였다.
퇴원 후 6주 동안은 지속적으로 보행 및 배뇨장애가 호전을 보였으나 첫 번째 발병 이후 12주 정도부터 하지의 감각저하 및 저린 증상이 다시 악화되기 시작했고 16주 후에는 혼자서 일어나지 못했다.
신경학적진찰에서 우안의 가쪽주시제한과 양쪽 얼굴마비가 다시 관찰되었고 사지와 체간의 운동실조도 악화되었다. 근력은 상지 근위부는 MRC 5등급, 원위부는 4등급이었고 하지 근위부는 4등급, 원위부는 3등급이었다. 심부건반사는 상지는 감소, 하지는 소실되어 있었으며 배뇨 및 배변기능의 악화는 관찰되지 않았다.
뇌척수액검사에서 백혈구는 관찰되지 않았으며, 단백질은 260.11 mg/dL로 이전보다 더 증가되어 있었다. 신경전도검사에서 양쪽 비골 및 경골신경의 복합근육활동전위는 관찰되지 않았고 종말잠복기연장 및 신경전도속도의 감소가 처음보다 악화되었다. 복합근육 및 감각신경활동전위의 진폭크기도 이전보다 감소되었으며 이는 이차축삭변성에 의한 것으로 판단하였다 (Table). European Federation of Neurological Societies/Peripheral Nerve Society 지침에서 제시한 CIDP의 전기진단기준[4]에서 확진에 해당하는 50% 이상 말단잠복기의 연장이 양측 정중신경 및 척골신경에서, 30% 이상 연장된 F파가 양측 정중신경과 오른쪽 척골신경에서, F파의 소실이 왼쪽 척골신경, 양쪽 비골신경, 경골신경에서, 전도차단이 양쪽 척골신경에서 관찰되었다.
면역글로불린치료에도 불구하고 12주만에 증상이 다시 악화되었으며 지속적으로 뇌척수액의 단백질수치가 상승되어 있어 A-CIDP로 최종진단하였고 메틸프레드니솔론(methylprednisolone)을 하루 1 g의 용량으로 5일간 사용 후 경구프레드니솔론(prednisolone) 60 mg으로 변경하여 유지하였다. 5일간의 고용량스테로이드치료 이후 혼자서 붙잡고 서서 버틸 수 있을 정도로 회복을 보였고 3주 후에는 보조기를 붙잡고 걸을 정도로 호전되었다. 이후 프레드니솔론(prednisolone)은 점차 감량하여 30 mg으로 유지하였고 아자티오프린(azathioprine)을 추가하였다. 이후 1년 간 재발없이 정상적인 자가보행이 가능하고 감각증상도 호전되었다.
본 환자는 GQ1b에 대한 자가항체는 발견되지 않았지만 MFS의 3대 증상인 외안근마비, 보행실조 및 심부건반사의 소실이 관찰되었고 뇌척수액 및 신경전도검사에서 관찰된 소견을 통해 초기에 MFS로 진단되었다. GBS 환자 중 치료 후 증상이 일시적으로 호전되었다가 악화를 보이면 GBS의 치료와 연관된 변동(GBS-Treatment related fluctuation, GBS-TRF)으로 판단할 수 있으며 면역글로불린정맥주사나 혈장교환술 이후 약 10%에서 GBS-TRF가 발생한다고 보고된다[5]. 본 증례처럼 MFS로 진단되고 치료 이후 증상이 다시 악화되는 경우 TRF를 의심하게 되지만 A-CIDP의 재발을 감별하는 것이 반드시 필요하다. 하지만 GBS와 초기 CIDP는 신경계증상, 뇌척수액 및 전기생리학적 검사소견이 비슷하기 때문에 감별에 어려움이 따른다.
CIDP 환자 중 약 16%는 A-CIDP 형태로 발생하며, GBS로 진단된 환자 중에서도 약 5%는 CIDP의 만성경과를 보인다[2]. A-CIDP와 GBS를 비교한 최근 연구들[6-8]에 따르면 A-CIDP는 GBS에 비해 근력약화는 걷지 못하거나 인공호흡기치료가 필요할 정도로 심하지 않았고 감각증상은 더 뚜렷하게 나타나는 특징을 보였다. 뇌신경침범은 GBS군에는 16명 중 11명에서 관찰된 반면, CIDP군에서는 8명 중 1명에서만 관찰되었다[7]. 자율신경계이상은 23%에서 관찰되었고 주로 위장관, 비뇨생식계증상이었으며 심한 자율신경계장애가 발생하는 경우는 드물었다[8]. 선행하는 감염의 유무, 강글리오시드(ganglioside)에 대한 자가항체의 검출여부, 뇌척수액검사 및 전기생리학적검사에서 유의한 차이는 없었다[7]. 발병 후 임상경과에 대한 차이를 보면 증상의 악화가 최고조에 이르는 기간은 A-CIDP가 16.5일, GBS-TRF는 8.5일로 A-CIDP에서 더 길었으며, 치료시작 후 첫 번째 증상의 악화가 일어날 때까지의 기간(A-CIDP: 51일, GBS-TRF: 18일)과 두 번째 악화가 일어날 때까지의 기간(A-CIDP: 105일, GBS-TRF: 38일)도 A-CIDP에서 더 길게 관찰되었다[7]. 또한 이 연구에 포함된 GBS-TRF 환자 중에서 8주 이후에 증상악화가 나타난 환자는 한 명도 없었다. 한 연구에서는 CIDP에서 뇌척수액의 단백질수치가 지속적으로 상승되어 있는 특징을 보고하기도 하였다[9].
이 증례는 기존 연구에서 드물게 보이던 뇌신경침범과 자율신경계장애가 관찰되었으며, GBS의 아형인 MFS의 특징으로 발현된 A-CIDP라는 점이 특이하다고 할 수 있다. 발병 초기에는 CIDP로 판단하기가 어려웠으나 재발이 발생하기까지 기간이 길었다는 점, 지속적으로 뇌척수액의 단백질수치가 상승된 점 및 악화된 신경생리학검사를 토대로 A-CIDP로 진단할 수 있었다. 첫 번째 면역글로불린치료 후 증상의 악화는 없었으나 추가적인 증상호전을 위해 증상발생 3주 후에 두 번째 면역글로불린을 사용했다. 12주부터 환자의 증상이 악화된 것이 첫 번째가 아닌 두 번째 면역글로불린치료와 연관된 TRF를 의심할 수도 있으나, 두 번째 면역글로불린치료와 증상의 악화 사이에 8주 이상의 시간간격이 있어 A-CIDP로 판단할 수 있다.
A-CIDP와 GBS를 감별하는 것은 환자의 향후 치료방향을 결정하고 예후를 추정하기 위해 중요하다. 발병 초기 GBS에 합당한 증상을 보이는 경우라도 증상악화를 보일 때는 GBS-TRF와 A-CIDP를 감별해야 하며, 특히 8주가 지나서 증상의 악화를 보일 때는 CIDP의 가능성을 염두에 두어야 한다. 또한 A-CIDP에서는 드문 증상이 관찰될 때에도 감별진단으로 A-CIDP를 염두에 두는 것이 진료에 많은 도움이 되겠다.
REFERENCES
1. Barohn RJ, Kissel JT, Warmolts JR, Mendell JR. Chronic inflammatory demyelinating polyradiculoneuropathy. Clinical characteristics, course, and recommendations for diagnostic criteria. Arch Neurol 1989;46:878-884.


3. Ruts L, van Koningsveld R, van Doorn PA. Distinguishing acute-onset CIDP from Guillain–Barré syndrome with treatment related fluctuations. Neurology 2005;65:138-140.


4. Van den Bergh PY, Hadden RD, Bouche P, Cornblath DR, Hahn A, Illa I, et al. European Federation of Neurological Societies/Peripheral Nerve Society guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society - first revision. Eur J Neurol 2010;17:356-363.


5. Randomised trial of plasma exchange, intravenous immunoglobulin,
and combined treatments in Guillain-Barré syndrome. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Lancet 1997;349:225-230.
6. Dionne A, Nicolle MW, Hahn AF. Clinical and electrophysiological parameters distinguishing acute-onset chronic inflammatory demyelinating polyneuropathy from acute inflammatory demyelinating polyneuropathy. Muscle Nerve 2010;41:202-207.


7. Ruts L, Drenthen J, Jacobs BC, van Doorn PA; Dutch GBS Study Group. Distinguishing acute-onset CIDP from fluctuating Guillain-Barré syndrome: a prospective study. Neurology 2010;74:1680-1686.


Figure 1.
Abdominal X-ray at second day of admission. Small and large bowels were distended diffusely without evidence of obstruction (A). Previously shown distended bowel loops have been resolved after ten days (B).
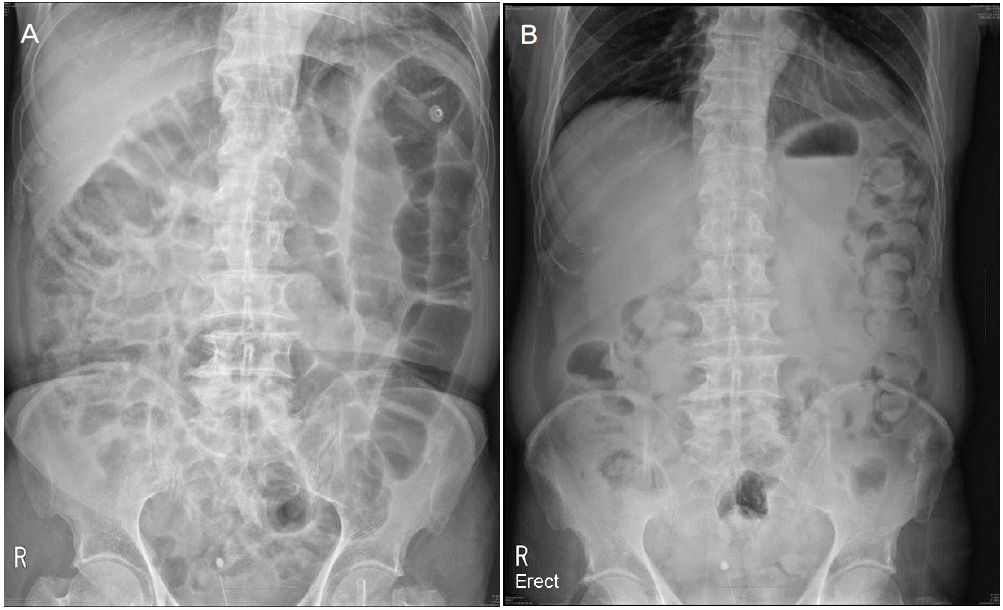
Figure 2.
The results of facial nerve conduction and blink reflex study. Facial nerve conduction study showed prolonged terminal latency and low CMAP amplitude with left facial nerve stimulation, no response with right one. Blink reflexes showed prolonged ipsilateral R1, R2 latencies and poor wave formation in contralateral R2 latency with left supraorbital nerve stimulation (A). There were no responses in ipsilateral R1, R2 latencies and prolonged contralateral R2 latency with right supraorbital nerve stimulation (B). NCS; nerve conduction study, CMAP; compound muscle action potential, NP; no potential, Amp; amplitude, d Lat; delta take off latency, Resp; response.
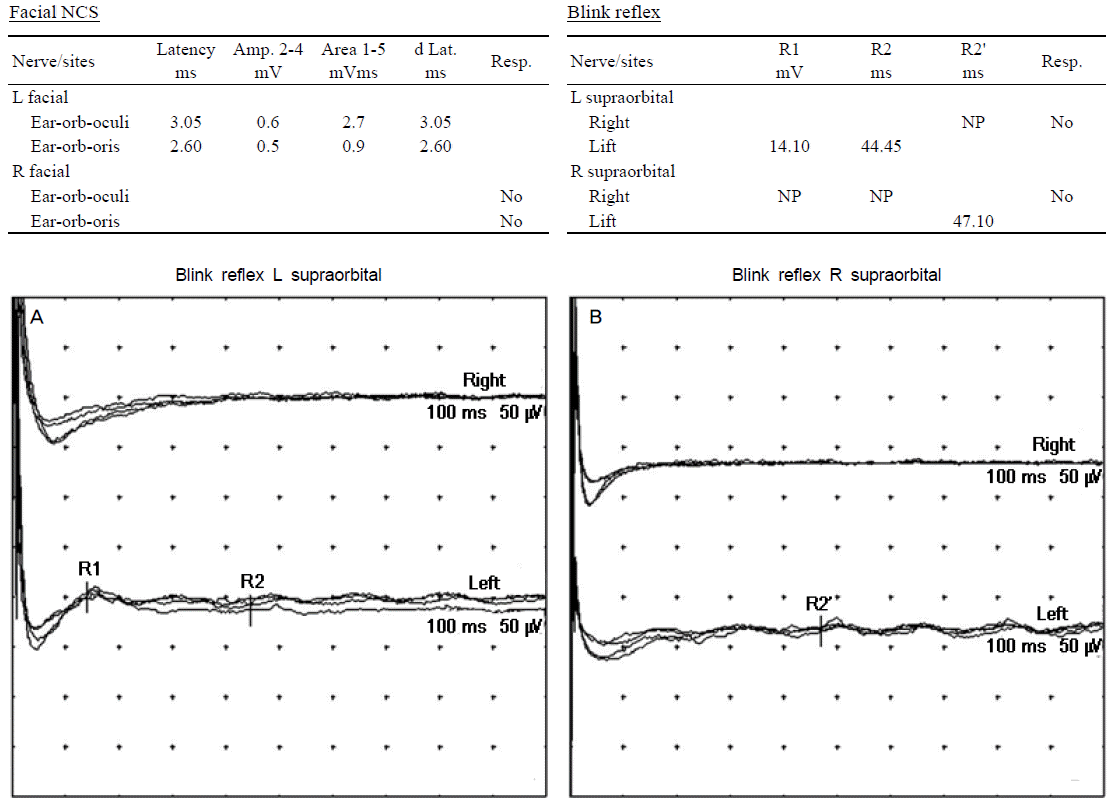
Table 1.
Serial nerve conduction studies at 1 weeks and 21 weeks after first disease onset
| Motor NCS |
July 11, 2013 |
December 4, 2013 |
|||
|---|---|---|---|---|---|
| Amplitude (mV) | NCV (m/s) | Amplitude (mV) | NCV (m/s) | ||
| Median nerve (right/left) | Normal value | ||||
| Terminal latency (ms) | 3.6 | 4.90/4.50a | 9.05/9.85a | ||
| Finger-wrist | Amplitude 5 mV | 7.3/8.4 | 0.7/2.6a | ||
| Wrist-elbow | 49.96 | 7.2/7.0 | 44.2/41.0a | 0.5/2.2a | 22.3/20.8a |
| Elbow-axilla | 55.96 | 7.2/6.7 | 43.2/39.6a | 0.5/2.0a | 25.5/27.7a |
| F-wave latency (ms) | 29.65 | 36.65/37.90a | 65.60/66.50a | ||
| Ulnar nerve (right/left) | |||||
| Terminal latency | 2.51 | 3.70/3.75a | 7.05/6.60a | ||
| Finger-wrist | Amplitude 5 mV | 11.2/11.4 | 2.7/3.0a | ||
| Wrist-below elbow | 50.61 | 5.9/9.0 | 45.1/42.0a | 1.5/1.6a | 15.7/15.8a |
| Below elbow-above elbow | 42.81 | 5.7/8.4 | 33.7/43.1a | 1.5/1.6a | 19.4/16.6a |
| Above elbow-axilla | 52.69 | 5.1/8.4 | 57.5/48.7 | 1.4/1.6a | 18.6/26.2a |
| F-wave latency | 29.65 | 40.75/38.50a | 78.10/NPa | ||
| Peroneal nerve (right/left) | |||||
| Terminal latency | 4.78 | 5.10/7.60a | |||
| Ankle | Amplitude 4 mV | 2.0/2.1a | NP/NPa | ||
| Knee | 41.85 | 1.4/1.7a | 34.5a | NP/NPa | |
| F-wave latency | 48.81 | NP/62.05a | NP/NPa | ||
| Tibial nerve (right/left) | |||||
| Terminal latency | 5.11 | 7.00/7.60a | |||
| Ankle | Amplitude 5 mV | 5.515.5 | NP/NPa | ||
| Popliteal fossa | 40.5 | 4.8a/5.0 | 31.3/29.7a | NP/NPa | |
| F-wave latency | 53.95 | 64.85/65.85a | NP/NPa | ||
|
|
|||||
| Sensory NCS | Amplitude (μv) | NCV (m/s) | Amplitude (μv) | NCV (m/s) | |
|
|
|||||
| Median nerve (right/left) | Amplitude 10 μv | ||||
| Finger-wrist | 41.26 | 5.7/8.0a | 32.5/38.4a | 1.8/2.1a | 28.4/37.2a |
| Palm-wrist | 34.05 | 2.7/5.8a | 37.4/39.3a | 1.5/3.1a | 39.1/36.6a |
| Wrist-elbow | 49.39 | 11.4/4.4a | 46.0/46.5a | 2.0/3.0a | 34.5/43.4a |
| Elbow-axilla | 53.95 | 10.5/9.6a | 23.1/33.3a | 6.2/4.1a | 24.7/29.5a |
| Ulnar nerve (right/left) | Amplitude 10 μv | ||||
| Finger-wrist | 39.26 | 4.2/6.2a | 28.6/31.1a | 1.6/1.6a | 29.0/29.0a |
| Wrist-elbow | 47.46 | 4.2/6.5a | 38.4/39.3a | 2.7/2.2a | 39.3/33.5a |
| Above elbow-axilla | 48.18 | 5.6a/11.5 | 38.6/39.3a | 6.9/3.8a | 36.2/44.2a |
| Sural nerve (right/left) | Amplitude 6 μv | 3.3/3.1a | 35.9/36.8 | NP/NPa | |
| 34.6 | |||||
| Superficial peroneal nerve (right/left) | Amplitude 4 μv | 3.5/2.0a | 35.9a/40.6 | NP/NPa | |
| 40.5 | |||||



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




