안구간대경련-근간대경련증후군(opsoclonus-myoclonus syndrome)은 불수의적인 신속눈운동(saccadic eye movement)이 불규칙한 진폭과 무작위 방향으로 반복적으로 나타나는 안구간대경련과 함께 사지 및 체간에서 나타나는 근간대경련을 특징으로 하는 질환으로 체간과 사지의 실조증이 나타나기도 하며 심한 경우 뇌병증(encephalopathy)의 증상을 보이기도 한다[1]. 소아에서 뇌염에서 동반되기도 하고 선천성으로도 나타날 수도 있지만 약 50% 이상에서 신경모세포종(neuroblastoma)이 원인이 되어 발병한다. 성인에서는 다양한 바이러스 및 세균 감염 후에 발생할 수도 있으며, 악성종양에서 동반되는 경우도 있지만 특별한 원인이 발견되지 않는 경우도 있다[2]. 발병기전은 명확히 밝혀지지는 않았으나 자가면역이 그 병리기전으로 이해되고 있고, 병리소견은 다양한데 주로 소뇌 푸르킨예세포(Purkinje cell)의 소실과 치아핵(dentate nucleus)의 신경세포 소실이 관찰되며 뇌간에서는 혈관 주변의 림프구 침윤이 동반되지만 대뇌피질 신경세포 소실은 없이 약간의 림프구 침윤만 국소적으로 나타난다고 한다[2-4]. 반면에 안구간대경련-근간대경련증후군 환자에서 시행한 18F-deoxyglucose (FDG) 양전자방출단층촬영(positron emission tomography, PET)에서는 주로 후두엽의 대사가 감소된 소견을 보여 부검에서 나타난 소견과는 달랐다[5,6].
국내에서는 감염성 뇌질환 후에 발생한 안구간대경련-근간대경련증후군 환자의 예는 보고된 바가 있으나[7] 아직 FDG PET소견에 대한 보고가 없어 상기도 감염 후 발생한 것으로 추정되는 두 명의 안구간대경련-근간대경련증후군 환자 증례를 FDG PET소견과 함께 보고하고자 한다.
증 례
증례 1
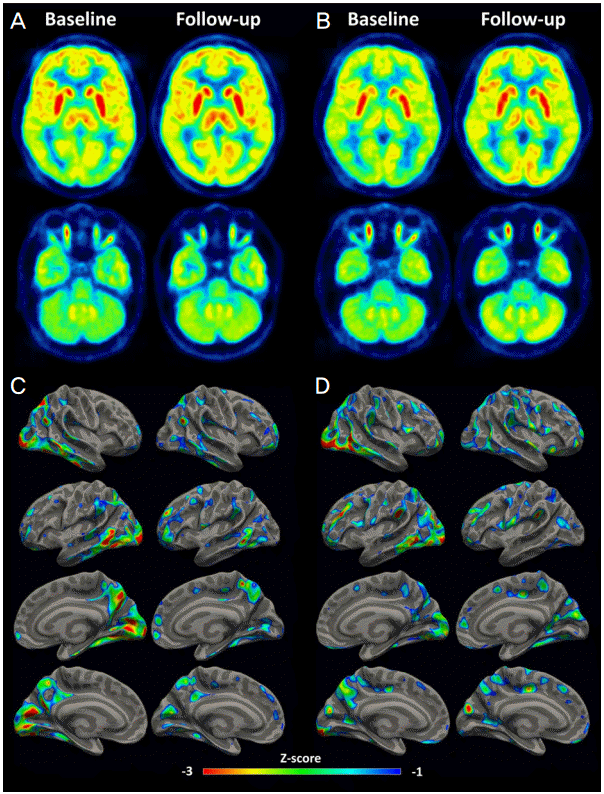
22세 남자가 어지럼을 동반한 양다리의 불수의적인 떨림과 보행실조 증상을 주소로 내원했다. 환자는 내원 15일 전부터 4일 정도 지속되는 고열과 기침을 동반한 두통 증상이 있었으며 폐단층촬영검사에서 기관지폐렴 소견을 보였다. 내원 5일 전부터는 사물이 흔들려 보이면서 어지럼이 시작되었고, 내원 당일부터는 서 있을 때 다리가 떨리고 걸을 때 몸이 흔들리는 증상이 시작되었다. 내원 당시 신경학적진찰에서 의식은 명료하였고 근력약화나 안구운동마비는 없었으나, 안구가 무작위 방향으로 빠르게 움직이는 안구간대경련과 양측 하지 근위부의 근간대경련이 관찰되었다. 사지실조증(limb ataxia)은 경미한 수준이었으나 서 있는 자세를 유지할 수 없을 정도로 심한 보행실조(gait ataxia)를 보였다. 뇌파검사, 신경전도검사, 유발전위검사는 모두 정상이었고, 뇌자기공명영상에서도 이상소견은 없었다. 혈액검사는 정상이었으며, 자가면역항체, 항Hu항체, 항Yo항체, 항Ri항체를 포함한 신생물딸림항체(paraneoplastic antibody) 및 종양표지자는 모두 음성이었다. 뇌척수액검사에서 압력과 단백질, 당 수치는 정상이었지만 단핵구로 이루어진 백혈구증가(26/mm3) 소견이 관찰되었다. 혈청 미코플라스마 IgG항체는 양성(>100; 정상<12)이었고 IgM항체가 경계치(0.9; 정상<1.0)로 상승되어 있었으며 저온응집소검사(cold agglutinin test)에서도 1:64 양성 소견을 보였다. FDG PET영상에서는 35명의 정상인(평균 나이 50.8±5.4세, 범위 41-58세) FDG PET 자료(전체 회색질 섭취율로 정규화한 상대적 국소 대사)와 비교했을 때 특히 후두엽의 상대적인 대사량이 2 표준편차(standard deviation, SD) 이하로 심하게 감소되어 있었고 두정엽과 측두엽은 1 SD 이하로 약간 감소되어 있었다. 5일간의 고용량 스테로이드(메틸프레드니솔론, 1 g/일) 정맥 치료와 경구 스테로이드(프레드니손, 60 mg/일) 치료를 시작했으며 이후 서서히 증상 호전되어 증상 발생 15일 뒤에는 모든 증상이 거의 사라졌고 FDG PET 추적검사에서 후두엽 대사량이 약 8% 증가되었지만, 두정엽과 후두엽의 약간의 대사감소는 여전히 관찰되었다(Fig. A, C).
증례 2
20세 남자가 두통과 어지럼을 동반한 머리와 몸통이 떨리는 증상을 주소로 내원했다. 환자는 내원 15일 전 고열을 동반한 기침, 가래 증상 및 두통과 오심 증상도 동반되었다. 내원 7일 전부터 두통이 심해지면서 걸을 때 몸이 떨리는 증상이 나타났고 급격히 증상은 악화되어 1일 후 심한 어지럼과 함께 가만히 서 있을 수 없을 정도로 몸이 흔들렸다. 증상은 누워 있을 때는 감소되지만 앉은 자세에서는 심하게 어지럽고 머리, 몸통과 팔이 심하게 떨렸다. 사물을 볼 때 눈이 흔들려서 초점을 맞출 수가 없었다. 내원 당시 신경학적진찰에서 의식은 명료하였고, 사지마비와 안구운동의 제한은 없었으나 안구가 무작위 방향으로 불규칙하게 움직이는 안구간대경련이 관찰되었고, 양측 상지와 하지 근위부의 근간대경련도 보였다. 사지실조(limb ataxia)는 경미한 수준이었지만 앉아 있거나 서 있는 자세를 유지할 수 없을 정도로 자세불안정이 심했다. 뇌자기공명영상, 뇌파검사, 신경전도검사, 유발전위검사에서 이상은 없었다 혈액검사는 정상이었으며, 뇌척수액검사에서도 백혈구는 관찰되지 않았고 압력, 단백, 당 수치 모두 정상이었다. 혈청 미코플라스마IgM항체는 정상이었지만 IgG항체는 경계치(17.1; 정상<12.0)로 약간 상승되어 있었다. 자가면역항체, 신생물딸림항체, 종양표지자는 모두 음성이었다. FDG PET영상에서 후두엽과 두정엽의 상대적인 대사량이 각각 정상인의 2 SD, 1 SD 이하로 떨어져 있었다. 3일간의 고용량 스테로이드(메틸프레드니솔론, 1 g/일) 정맥 치료와 경구 스테로이드(프레드니손, 60 mg/일) 유지요법을 시작했으며, 증상은 서서히 호전되어 내원 15일 뒤에는 미세한 안구간대경련을 제외한 다른 증상은 사라졌다. 이때 시행한 FDG PET 추적검사에서도 내원 당시에 비해 후두엽 대사량이 4% 정도 호전되었지만 후두엽과 두정엽의 대사감소는 1 SD 이하로 지속되었다(Fig. B, D).
고 찰
본 연구에서는 미코플라스마폐렴이 의심되었던 환자(증례 1)와 원인 불명의 상기도 감염으로 추정되는 환자(증례 2)에서 발생한 안구간대경련-근간대경련증후군을 보고했으며, 후두엽과 두정엽에서 특히 심하게 나타나는 광범위한 대뇌피질 대사 감소가 FDG PET에서 관찰되고 증상이 호전됨에 따라 후두엽의 대사가 증가함을 밝혔다.
안구간대경련의 발생 기전은 아직 정확히 밝혀지지는 않았지만 정중곁교뇌망상체(paramedian pontine reticular formation; PPRF)의 범정지신경세포(omnipause neuron)가 지속적으로 신속보기돌발파신경세포(saccadic burst neuron)를 억제하는 기능에 장애가 생겨서 발생할 것으로 생각하고 있다[2]. 그러나 장기간 지속되는 안구간대경련 증상에 불구하고 부검에서 소뇌 신경세포 소실 외에는 다른 부위 이상이 동반되지 않았던 예도 있고[3], 발병 초기 FDG PET소견상 소뇌 대사가 일시적으로 올라간다는 보고도 있어[8] 뇌간 외에 소뇌에도 원인도 있을 것으로 추정된다[2]. 기능자기공명영상(functional magnetic resonance image) 연구에서 안구간대경련이 소뇌심부핵(deep cerebellar nuclei) 활성 증가와 연관되어 있어 소뇌꼭지핵(fastigial nuclei)의 활성화로 범정지신경세포가 억제되고 그로 인해 돌발파신경세포가 탈억제되는 것이 다른 기전으로 알려졌다[9]. 이에 비해 다른 FDG PET 연구에서는 후두엽 전체 대사의 감소가 있었으며[5,6], 증상이 소실되었을 때 시행한 추적 검사에서 후두엽 대사가 증가했지만 정상 수준으로 회복되지는 않았다[5]. 본 증례에서도 광범위한 대뇌피질 대사감소 소견이 관찰되었고 특히 후두엽과 두정엽의 대사 감소가 뚜렷했으며, 추적 검사에서 후두엽 대사는 증가했지만 여전히 정상에 비해 감소된 소견을 보여 기존 보고와 일치한다. 이는 병변이 주로 소뇌와 뇌간에 국한된다는 기존의 부검 소견과는[2-4] 다른 것으로 대뇌피질에도 병변이 있을 것으로 추측해 볼 수도 있다. 그러나 FDG PET에서 나타난 뇌 대사는 그 부위 신경원 자체의 대사뿐만 아니라 시냅스(synapse) 활성도와도 관련되어 있으므로 후두엽으로 들어오는 시냅스전 신경세포의 활성도가 감소해서 후두엽 대사가 감소되었을 것으로도 생각할 수 있다[10]. 인위적으로 유발시킨 신속보기눈운동은 부적절한 시각 자극이 생기게 하고 기능자기공명영상에서 나타난 후두엽 활성을 떨어뜨린다[5]. 마찬가지로 안구간대경련도 부적절한 시각 자극을 유발시키므로 시각 움직임(visual motion)을 처리하는 과정을 억제함으로써 시각을 안정하려고 하기 때문에 후두엽의 대사가 감소되었던 것으로 추측할 수 있다[6]. 이와 같은 결과들을 종합해 볼 때 본 연구의 두 환자에서 나타난 후두엽과 두정엽 대사량 감소는 그 부위의 일차적인 병변때문인 것으로 판단하기보다 이차적으로 그 기능이 억제되어 나타나는 현상일 가능성이 높을 것으로 추정되지만 본 연구결과만 가지고는 이를 증명할 수 없다.
본 연구에서 기술한 증례 2의 상대적인 소뇌와 뇌간의 대사량은 모두 정상인의 2 SD 이상으로 증가해 있었다. 그러나 FDG PET의 상대적인 대사량 값을 얻기 위해 국소섭취율을 전체 회색질의 평균 섭취율로 정규화시키는 과정이 필요하고 광범위한 대뇌피질의 대사가 감소되어 있는 경우 상대적으로 대사가 보존되어 있는 뇌 부위가 정상보다 증가한 것으로 판단할 오류가 있을 수 있으므로 증례 2에서 관찰된 소뇌와 뇌간의 대사가 실제 증가한 것인지 아니면 상대적으로 보존되어 있는 것인지를 판단할 수는 없다. 그러므로 정량적 FDG PET 검사와 신경계 염증을 확인할 수 있는 PET검사를 통해 병변부위를 확인하는 것이 이 질환의 병인을 이해하는 데 도움을 줄 수 있을 것으로 생각한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print