모동맥에 50% 미만의 협착이 동반된 열공경색의 임상 특성
Clinical Characteristics in Lacunar Infarction with Less Than 50% Stenosis in the Parent Artery
Article information
Trans Abstract
Background:
Contrary to the initial hypothesis, there is accumulating evidence that the pathogenesis of lacunar infarction (LI) is heterogeneous. LI is often accompanied by intracranial stenosis, and while the clinical significance of severe stenosis of the intracranial parent artery in LI has been demonstrated, that of mild stenosis in LI has not been. Thus the aim of this study was to determine the clinical relevance of mild intracranial stenosis in LI.
Methods:
Ninety-three consecutive patients with acute LI were enrolled between March 2011 and December 2013. The patients were divided according to the presence of intracranial stenosis in the parent artery into pure LI (PLI) and LI with mild intracranial stenosis (<50% stenosis, BAD). Various clinical and laboratory characteristics were compared between the two groups.
Results:
PLI group were older and, had a less frequent history of smoking, a larger infarct, lower likelihood of a favorable outcome, and higher National Institute of Health Stroke Scale score at discharge in the univariate analysis. After adjusting for confounding factors, BAD was associated with older age at onset [odds ratio (OR) = 1.113, 95% confidence interval (95% CI) = 1.056-1.172, p<0.001), no history of previous statin medication (OR = 13.362, 95% CI = 1.014-176.062, p=0.049), and nonsignificant stenosis in the parent artery was associated with larger infarct (β=0.296, p=0.01) in the multivariate analyses.
Conclusions:
LI with mild parent-artery disease was demonstrated to have distinct clinical characteristics compared to LI without parent artery disease. Thus, even mild branch atheromatous disease in LI should be evaluated thoroughly and treated via a planned and systematic approach.
서 론
열공경색은 초기에 관통동맥의 지방유리질증(lipohyalinosis)이나 미세죽종(microatheroma)같이 소동맥에 국한된 질환으로 추정되었지만[1,2], 그 후 많은 연구들을 통해 심장성색전증이나 연관동맥(relevant artery)의 죽상경화증과 연관된 협착에 의해서도 발생할 수 있음이 알려졌다[3-5]. 특히 두개내 뇌혈관의 죽상경화가 흔한 동양인에서 연관동맥의 폐색 혹은 50% 이상의 유의한 협착은 열공경색의 중요한 원인이다[6]. 소동맥질환 이외의 원인에 의한 열공경색은 상대적으로 신경학적 예후가 나쁘고, 뇌경색 크기가 크며, 고혈압과 연관된 경우가 더 흔하다[7]. 그러나 열공경색에서 연관동맥의 50% 미만 경도 협착의 임상적 의미에 대해서는 연구가 부족한 실정이다.
따라서 본 연구에서는 급성기 열공경색으로 내원한 환자 중 연관 동맥의 협착이 동반되지 않은 환자와 50% 미만의 협착이 동반된 열공경색 환자를 대상으로 한 비교 연구를 통해 연관동맥 경도 협착의 임상적 의미에 대해 알아보고자 한다.
대상과 방법
1. 대상
2011년 3월부터 2013년 12월까지 본원 신경과에 발생 7일 이내에 뇌경색으로 입원한 환자를 대상으로 하였다. 모든 뇌경색 환자에서 입원 중 본원의 뇌경색 영상프로토콜에 따라 뇌 CT, 뇌MRI, 전산화단층혈관조영술(CTA) 혹은 자기공명혈관조영술(MRA)을 시행하였고, 인구학적 정보, 과거력, 임상 증상에 대한 문진, 심전도검사, 흉부방사선촬영, 혈액검사 같은 전신 상태 평가도 하였다. 그리고 심장성색전증에 대한 평가를 위한 흉부경유심장초음파를 하였다. 뇌혈관질환 위험인자 중 고혈압은 입원 중 안정 시 혈압이 140/90 mmHg 이상 또는 고혈압약을 이미 복용하고 있던 경우로 정의하였으며 당뇨병은 내원 당시 공복혈당이 126 mg/dL 이상이거나 당뇨약을 복용하고 있던 경우로 하였다. 고지혈증은 공복 혈청 총 콜레스테롤 수치가 240 mg/dL 이상 또는 저밀도 콜레스테롤 수치가 160 mg/dL이거나 고지혈증약을 복용 중인 경우로 하였다. 흡연력은 재발 당시 흡연을 하고 있거나 금연 후 1년 미만인 경우로 하였다.
뇌경색 기전의 분류는 Trial of Org 10172 in Acute Stroke Treatment (TOAST) 분류에 따라[8], 큰동맥죽상경화증(large artery atherosclerosis, LAA), 소혈관질환(small vessel occlusion, SVO), 심장성색전증(cardioembolism, CE), 다른원인뇌졸중(stroke of other determined etiology, SOD) 및 원인불명뇌졸중(stroke of undetermined etiology)으로 나누었다. 원인불명뇌졸중은 두 가지 이상의 원인에 의한 경우(two or more causes, UT), 원인미상(negative evaluation, UN), 불완전검사(incomplete evaluation, UI)로 세분하였다. 전체 환자 중에서 열공경색 환자를 선별하기 위해서 뇌MRI를 시행하지 않았거나 TOAST분류에서 LAA, CE, 원인불명 중 UT와 UI를 제외하였다. 그리하여 SVO로 분류된 환자 이외에도 원인불명 중 UN으로 분류된 환자에서 관통동맥 영역의 열공경색이지만, 고전적 열공증후군이 아니거나 뇌경색 크기가 15 mm 이상인 경우도 대상 환자에 포함시켰다.
뇌경색의 중증도는 미국국립보건원뇌졸중척도(National Institute of Health Stroke Scale, NIHSS)로 입원 당시, 1일, 3일, 퇴원 시에 각각 기록하였다. 퇴원 시 임상 경과는 수정Rankin척도와 바텔지수를 이용하여 평가하였다. 양호한 임상 경과의 기준은 퇴원 시 수정Rankin척도가 0 또는 1이면서 바텔지수가 95점 이상인 경우로 정의하였다.
2. 방법
CTA나 MRA로부터 얻은 뇌혈관영상에서 열공경색의 연관 동맥 중 두개내 모동맥(parent artery)에 동맥경화에 의한 50% 미만의 협착이 확인되면 정도에 관계없이 branch atheromatous disease (BAD) 군으로 정의하였고(Fig. B), 협착이 확인되지 않고 정상 뇌혈관을 보이면 pure lacunar infarction (PLI)군으로 정의하였다(Fig. A). 두개내혈관의 협착 정도의 측정은 WASID 연구에서 사용되었던 방식을 적용하였고[9], 두 명의 공동저자(H-J Kim, S-K Lee)가 각각 독립적으로 측정하였으며 의견이 불일치하는 경우 제1저자(DH Lee)의 의견을 따랐다. 두 군 모두에서 MRI의 확산강조영상에서 관찰된 뇌경색 병변의 단면이 가장 큰 슬라이스에서 긴 직경의 크기를 0.1 mm 단위까지 측정하여 뇌경색 크기로 정의하였다.
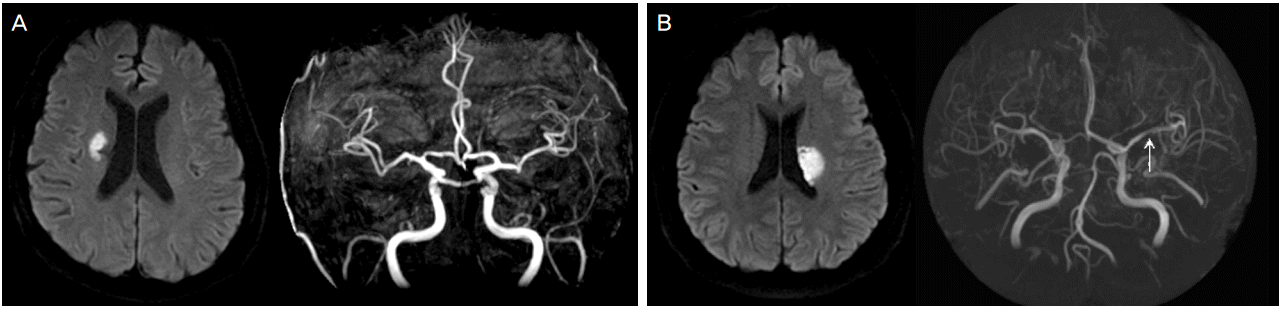
Illustrative cases of PLI group (A) and BAD group (B) are shown in the diffusion weighted imaging and intracranial time-of-flight MR angiography. PLI; pure lacunar infarction, BAD; branch atheromatous disease. White arrow shows less than 50% stenosis of left middle cerebral artery.
BAD군과 PLI군의 인구학적 특성, 혈관위험인자, 약물 복용력, 진단검사 의학 검사, 뇌경색의 크기, 입원 중 신경학적 악화 유무, 입퇴원 당시의 NIHSS 점수, 퇴원 시 임상경과를 비교하여 유의한 차이가 있는지 확인하였다. 이어서, 유의한 차이가 있는 변수들을 보정하여 BAD군과 PLI군에서 차이를 보이는 변수를 다변량분석으로 찾아내었다.
3. 통계
두 군에서 비교한 여러 변수들 중 연속형 변수들은 스투덴트 t-검정 혹은 Mann-Whitney U 검정을 시행하였고, 이분형 변수들은 카이제곱검정 혹은 Fisher정확검정을 시행하였다. 다변량분석은 변수의 속성을 고려하여 이분형 변수는 로지스틱회귀분석을 이용하였고, 연속형변수는 다중 선형회귀분석을 이용하였다.
통계 프로그램은 SPSS version 17.0을 사용하였고, 통계적 유의수준은 p값 0.05 이하로 하였다.
결 과
본 연구에 선별된 총 환자는 93명이었고, 그 중 정상 뇌혈관을 보였던 PLI군이 51명, 두개내 연관동맥의 50% 미만의 경도의 협착증을 보였던 BAD군은 42명이었다(Table 1).

Comparison of demographic, clinical, radiological characteristics in 93 patients classified according to the existence of stenosis in the intracranial relevant artery
1. 인구학적 인자와 혈관위험인자(Table 1)
모동맥 협착이 동반된 군은 연령대가 높았고(평균±표준편차: 54.0±11.75 vs 69.8±11.38, p<0.001), 성별의 차이는 관찰되지 않았다. 고혈압, 당뇨병, 고지혈증의 과거력은 두 군 간에 유의한 차이는 없었지만, 고혈압약 복용력이 BAD 군에서 높았고(57.1% vs 31.4%, p=0.012), 흡연자의 비율은 PLI 군에서 현저히 높았다(47.1% vs 16.7%, p=0.002). 항혈소판제, 고지혈증약, 당뇨병약 복용력의 차이는 없었다.
2. 뇌MRI, MRA 결과와 임상경과(Table 1)
열공경색의 크기는 BAD군이 PLI군보다 통계학적으로 유의하게 컸다(평균±표준편차: 1.49 ± 0.762 cm vs 1.13 ± 0.549 cm, p=0.010). BAD군과 PLI군 간에 내원 당시 NIHSS 점수의 차이가 없었고, 입원 중 신경학적 악화 혹은 변동에서도 차이가 없었지만, BAD군이 퇴원 시 NIHSS 점수가 높았으며(중위수[사분범위]: 2 [1.0-4.0] vs 0 [0.0-2.0], p=0.006) 좋은 임상경과를 보이는 비율이 낮았다(45.2% vs 66.7%, p=0.038).
3. 다변량분석 결과
단변량분석에서 두 군 간에 통계학적으로 유의한 차이를 보였던 연령, 흡연여부, 고혈압약 복용력, 그리고 임상적으로 죽상경화증의 경과에 영향을 줄 수 있는 고지혈증약과 당뇨병약 복용력이 두개내 연관동맥 질환이 있는 열공경색에 대한 기여인자로 작용하는지 로지스틱회귀분석을 이용하여 분석하였다(Table 2). 단변량분석에서 차이를 보였던 흡연력은 두개내 연관동맥 질환 여부에 유의한 영향을 주지 못했다. 연령은 나이가 1살 증가할 때마다 약 1.1배 BAD군에 속할 가능성이 높았고(Odds Ratio [95% CI] 1.113 [1.056-1.172], p<0.001), 고지혈증 약 복용력이 없는 사람일수록 약 13배 BAD군에 속할 가능성이 높았다(Odds Ratio [95% CI] 13.362 [1.014-176.062], p=0.049).
뇌경색의 크기와 두개내 연관동맥 질환의 연관성을 확인하기 위해서 뇌경색의 크기를 종속변수로 하고 단변량분석에서 유의한 차이를 보였던 인자들을 보정하여 다중선형회귀분석을 시행하였다(Table 3). 뇌경색의 크기에 영향을 줄 수 있는 다른 인자들을 보정하더라도 두개내 연관동맥에 50% 미만의 협착이 뇌경색의 크기와 밀접한 상관관계를 갖고 있었다(β=0.296, p=0.01).
단변량분석에서 차이를 보였던 퇴원 시 양호한 임상경과는 퇴원 시 임상경과를 종속변수로 하여 로지스틱회귀분석을 한 결과, 두개내 연관동맥 질환 유무가 임상경과에 영향을 주지 않았다(Odds ratio [95% CI] 2.138 [0.680-6.727], p=0.194, Data not shown).
고 찰
본 연구는 이전의 연구들과는 달리 확실한 심장성색전증의 인자가 있는 경우뿐만 아니라 연관 동맥에 50% 이상의 협착 혹은 폐색이 있어서 TOAST 분류상 LAA 또는 UT가 되는 경우를 제외하였고, 비연관(non-relevant)동맥에만 협착 혹은 폐색이 있는 경우도 제외하여, 다른 알려진 원인 없이 관통동맥 영역의 뇌경색이 발생한 환자를 대상으로 하였다. 또한 두개외 연관 동맥의 죽상경화가 동맥-동맥색전증(artery-to-artery embolism)으로 열공경색을 일으킬 가능성[10]을 배제하기 위해서 두개외혈관에만 죽상경화가 있는 경우도 제외하였다. 따라서 전형적인 열공경색 환자의 특성을 선별적으로 분석하였다는 장점이 있다. 이전 열공경색 연구에서 별도로 분류하지 않았던 50% 미만의 경도의 협착이 동반된 열공경색 환자를 선별하여 협착이 전혀 없는 관통동맥 질환으로 발생한 열공경색 환자와 비교함으로써 협착이 없는 열공경색 환자와 위험인자의 차이가 있고, 뇌경색의 크기도 유의하게 큰 것을 확인하였다.
허혈뇌졸중의 공통된 위험인자로 잘 알려진 고혈압, 당뇨병, 고지혈증의 과거력은 두 군 간에 유의한 차이를 보이지 않았으나, BAD군의 평균 연령이 약 16세가 많았고, 흡연자는 PLI 군에서 높았다.
고령은 두개내혈관의 죽상경화증의 잘 알려진 위험인자이다. 무증상협착증이 나이가 들수록 증가하는 것이 알려져 있다[11,12]. 단변량분석에서는 BAD군에서 상대적으로 고혈압의 유병률이 높은 경향을 보였고, 고혈압약을 복용했던 병력이 유의하게 높았다. 그러나, 다른 변수를 보정했을 때에는 두 군 간에 유의한 차이를 보이지 않았는데, 이는 고혈압이 두개내혈관의 죽상 경화증에 관여하는 위험인자일 뿐만 아니라[13], 열공뇌경색의 공통적인 위험인자이기 때문으로 생각한다.
흡연은 경동맥의 죽상경화증에 주요한 위험인자로 알려졌지만, 두개내혈관 죽상경화증과의 관계는 불확실한 상태이다. 흡연은 관통동맥과 같은 소동맥에서 일산화질소의 활성을 억제하여[14], 혈관 내피세포의 손상을 유발하고 혈액-뇌장벽의 기능을 저해시킬 수 있다[15]. 혈액-뇌장벽의 기능저하는 혈관 주변의 뇌조직에 세포외액의 저류, Virchow-Robin공간의 확장으로 이어져 열공경색의 지방유리질증과 섬유소모양괴사(fibrinoid necrosis)의 병리를 낳게 된다[16]. 열공경색을 대상으로 뇌경색 크기에 따른 위험인자의 차이를 분석한 최근의 연구결과에서도 흡연이 지방유리질증으로 인한 열공경색과 연관되어 있을 가능성이 제시된 적이 있다[17]. 하지만, 동양인에서 인구 집단을 기반으로 한 무증상두개내혈관협착의 유병률과 위험인자를 분석한 대규모 연구결과에서는 흡연과의 유의한 연관성은 없었다[18]. 본 연구에서도 모동맥의 죽상경화가 동반되어 있어 분지죽상질환에 의한 열공경색의 가능성이 높은 BAD군에 비해 PLI군에서 흡연의 빈도가 높았다. 그러나, 두개내 연관동맥질환의 동반 여부에 흡연력이 영향을 주지 않았고(Odds Ratio [95% CI] 0.545 [0.158-1.884], p=0.338), 뇌경색의 크기와의 연관성을 본 다변량분석에서는 오히려 양의 상관관계를 보이는 상반된 결과로 나와서 경동맥과 마찬가지로 두개내혈관의 죽상경화증에도 위험인자로 작용할 가능성이 있어 이에 대한 추가 연구가 필요할 것으로 보인다.
고지혈증약 스타틴은 지질강하효과 이외에도 혈관내 염증반응의 억제, 죽상경화의 감소, 혈관내피세포의 기능개선, 혈전생성 억제 등의 다양한 효과를 통해서 관상동맥질환, 뇌경색에 예방 효과가 있음이 잘 알려져 있다[19,20]. 본 연구에서는 다른 인자를 보정하더라도 스타틴 제제를 복용하지 않은 환자일수록 BAD군 즉, 두개내 연관동맥의 협착이 동반되어 있을 가능성이 13배 높음을 알 수 있었다. 대상 환자 수가 작기는 하지만 스타틴 제제를 투여하고 두개내 뇌혈관의 협착을 추적 관찰한 연구에서[21,22], 스타틴 제제가 두개내혈관의 죽상경화를 방지할 가능성이 있음을 보여 본 논문의 연구결과를 뒷받침할 수 있다.
열공경색에서 죽상경화가 모동맥에 있는 경우 분지죽상폐색(branch atheromatous occlusion)이나 미세죽종(microatheroma)에 의한 관통동맥 폐색으로 뇌경색이 발병할 가능성이 높고, 이 경우 열공경색의 크기는 5-20 mm로 알려져 있다[23]. 한편 모동맥에 죽상경화가 없이 관통동맥의 원위부에서 지방유리질증으로도 뇌경색이 발병하는데, 이 경우 열공경색의 크기가 7 mm를 넘지 않는다[24]. 분지죽상질환은 관통동맥의 입구(orifice)가 모동맥 죽상경화에 의해 직접 막히거나, 죽상경화반이 모동맥에서 관통동맥의 입구로 확장되면서 막히거나, 미세죽종이 관통동맥의 입구에서 생겨 막히면서 열공경색을 일으킨다[25]. 모동맥의 협착이 경미한 경우에는 모동맥죽상경화의 연장보다는 미세죽종에 의한 관통동맥 입구의 폐색이 열공뇌경색을 일으키는 주된 기전일 가능성이 있다. 일반적으로 오랜 기간의 고혈압에 의한 혈관손상으로 발생하는 지방유리질증은 관통동맥의 뇌실질 내 경로를 따라 분절성 해체(segmental disorganization)를 유발하므로 뇌경색의 크기가 작다. 따라서 미세죽종이 관통동맥의 입구를 폐색하는 경우 지방유리질증에 의한 열공경색보다 크기가 클 것으로 예상할 수 있다.
본 연구결과에서 연관동맥의 협착과 뇌경색의 크기는 다른 유의한 인자들을 보정하더라도 밀접한 상관관계가 있었다(β=0.294, p=0.01). PLI군은 모동맥을 포함한 뇌혈관이 정상이었으므로 분지죽상질환보다는 관통동맥의 지방유리질증이 열공경색 발병의 주된 기전으로 추측할 수 있고, 모동맥의 경미한 죽상경화가 있는 BAD군에서는 미세죽종의 관통동맥 입구 폐색이 뇌경색 발병에 기여했을 것으로 추정할 수 있다. 50% 미만의 협착증은 TOAST분류에서 뇌경색의 주요 인자로 인정하지 않고 있다[8]. 그러나 모동맥의 죽상경화는 협착 정도에 관계없이 분지죽상질환의 일환으로 열공뇌경색의 원인이 될 수 있다[26,27]. 기저동맥이 MRA에서 정상이었던 교뇌경색 환자의 약 40%에서 기저동맥의 죽상경화반이 존재함을 고해상도 MRI로 확인했던 연구 결과[28]도 이를 뒷받침한다.
심장성색전증이나 경동맥협착증의 증거 없이 중대뇌동맥의 관통동맥 영역에 뇌경색이 발생한 201명의 환자들을 대상으로 한 최근의 연구에서 연관동맥에 협착이 없는 군보다 협착이 있는 군에서 뇌경색의 직경이 컸다[27]. 하지만 이 연구에서는 두개 내 연관동맥이 50% 이상 협착을 보였던 환자들도 협착이 있는 군에 포함이 되었고, 이와는 달리 본 연구에서는 TOAST분류에서 이러한 환자들은 LAA나 UT로 제외되어서 경도의 협착이 있는 환자들만 포함되었다는 차이점이 있다.
단변량 분석에서 유의하게 BAD군이 PLI군보다 퇴원 시 NIHSS점수가 높았고, 퇴원 시 양호한 임상경과를 덜 취했지만, 연령을 비롯한 다른 인자들을 보정했을 때는 통계학적으로 유의한 차이를 보이지 않았다.
이전 연구에서 잠재적 원인이 없이 열공경색이 발병한 군이 심장성색전증, 큰동맥죽상경화증 등의 잠재적 원인이 있는 열공경색 군보다 입원 당시 높은 NIHSS 점수, 퇴원 3개월 후 불량한 임상경과를 보였다[7]. 모동맥질환이 동반된 열공경색과 동반되지 않은 열공경색의 임상경과를 비교한 연구[29]에서 입원 당시 NIHSS 점수와 입원 중 신경학적 악화 혹은 변동의 비율에서 차이가 없었으나, 1년 이내 뇌경색 재발은 모동맥폐색이 동반된 군에서 유의하게 많았다. 그러나 이 연구는 모동맥질환을 모동맥폐색이 있는 경우로 국한하였기에, 본 연구보다 중증도가 높고, 임상경과가 상대적으로 더 불량했을 가능성이 있다. 일반적으로 열공경색 환자의 단기간 임상경과는 전반적으로 양호한데[23], 본 연구에서는 퇴원 후 장기간 임상경과에 대한 추적 정보가 없어서 두 군에서 유의한 차이를 보이지 않았을 수도 있다. 따라서 연관동맥 경도 협착에 따른 열공경색의 예후에 대해서는 장기간의 추적 관찰을 통한 추가 연구가 필요하다.
본 연구에서 50% 미만의 모동맥 죽상경화 유무가 열공경색의 단기간 신경학적 임상 경과에 영향을 미치지 않았다. 그러나, 50% 미만의 모동맥 죽상경화가 동반된 경우 환자의 나이가 유의하게 많았고, 흡연자의 비율이 낮은 경향을 보였고, 뇌경색의 크기가 컸다. 이러한 결과는 경미한 모동맥의 죽상경화가 동반된 열공경색은 정상 뇌혈관을 보였던 열공경색과는 다른 기전에 의해 뇌경색이 발생했을 가능성을 시사한다. 모동맥의 경미한 죽상경화도 분지죽상경화 기전에 의해 뇌경색을 유도했을 가능성이 있다. 분지죽상질환에 의한 열공경색은 재발률이 높고 예후가 좋지 않아 큰동맥죽상경화증의 아형으로 보고 있다는 점을 고려할 때, 경미한 죽상경화를 동반한 열공경색도 순수관통동맥 질환에 의한 열공경색보다는 적극적인 진단과 치료 계획의 대상이어야 한다[26,27].
본 연구는 몇 가지 제한점이 있다. 첫째, 두개내혈관의 협착 정도를 단일 검사가 아니고 CTA 또는 MRA로부터 얻은 영상에서 측정하여 두 검사 방법 간의 차이로 오차가 발생했을 가능성이 있다. 하지만 두개내혈관 협착을 측정하는 데 있어서 CTA가 MRA에 비해서 민감도와 양성예측도가 낮지 않아[30], 오차가 있다고 하더라도 본 연구결과에 영향을 줄 수 있는 정도는 아니라고 생각한다. 둘째, 모든 영역의 열공경색 환자를 대상으로 선정하여 줄무늬체섬유막 영역, 시상 영역, 교뇌 영역 등 다양한 부위에서 발생한 열공경색이 포함되었다. 따라서 동일한 크기의 열공경색이 발생하였다 하더라도 신경학적결손 정도에 상당한 차이가 있을 수 있고, 특히 시상 영역에서 발생한 뇌경색의 경우 NIHSS 점수로는 신경학적결손 정도를 정확히 반영하지 못하였을 가능성이 있다.
본 연구는 50% 미만의 모동맥협착을 동반한 열공경색에서도 분지죽상질환이 발병기전이 될 가능성이 있음을 제시하였다. 임상적으로는 열공경색 환자에서 모동맥의 폐색이나 중등도 이상의 협착이 없이 경미한 죽상경화가 있더라도 작은 동맥질환으로 치부하고 소극적인 진단과 치료에 머무르는 것보다는 숨겨져 있는 큰동맥죽상경화증의 증거를 찾고 적극적인 치료 전략을 세우는 것이 중요하다.

